6.6: Modificación covalente
- Page ID
- 79448
Los inhibidores reversibles son extremadamente importantes en la regulación de la actividad enzimática. Pueden activar o desactivar las enzimas, actuando como activadores o inhibidores, respectivamente. Además, las enzimas pueden regularse mediante modificación covalente o modificación postraduccional. Eso significa que, una vez que la enzima ha sido ensamblada en la célula, su estructura puede modificarse aún más agregando grupos especiales a ubicaciones específicas. En el caso de la regulación, estos grupos se suman de manera reversible. A pesar de que el grupo se agrega covalentemente —está unido a la proteína— existe una ruta de reacción para la eliminación del grupo nuevamente.
Hay tres ejemplos de estas modificaciones que veremos aquí. En cada caso, el comportamiento de la proteína se modifica debido a cambios en las atracciones intermoleculares dentro de la proteína (o entre la proteína y otra molécula).
La fosforilación es una modificación muy común. En la fosforilación, un grupo fosfato se une a una cadena lateral de aminoácidos. La cadena lateral fosforilada más comúnmente es una serina. La tirosina a menudo también se fosforila. Esos sitios se prefieren debido al fuerte enlace P-O formado durante la reacción.
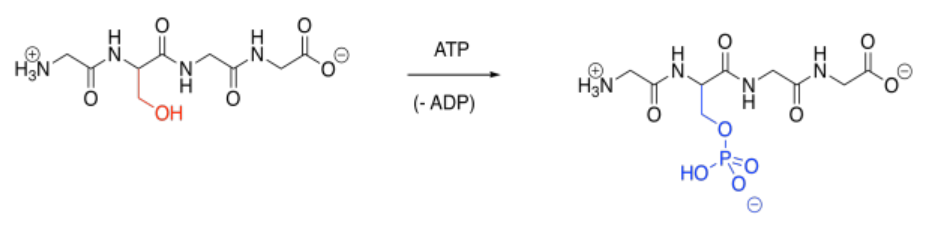
La fosforilación se lleva a cabo típicamente bajo el control de otra enzima llamada quinasa. Así es, una enzima se unirá a otra, atando un grupo fosfato a ella antes de liberarlo nuevamente. Un grupo fosfato puede ser removido de nuevo a través de otra enzima llamada fosfatasa. El hecho de que estas modificaciones sean llevadas a cabo por enzimas específicas ayuda a explicar su especificidad. Una quinasa particular puede unirse a su proteína diana en una posición bien definida, fosforilándola solo en esa posición (aunque algunas quinasas pueden ser menos selectivas).
Por supuesto, el resultado clave de la fosforilación es que una serina neutra es enmascarada repentinamente por un grupo fosfato aniónico. Esa carga negativa altera de manera bastante marcada las atracciones intermleculares, porque de pronto surgen fuerzas atractivas y repulsivas donde antes no las había.
La acetilación también es bastante común. La acetilación es la adición de un grupo acetilo o etanoilo; generalmente, el grupo se agrega a una lisina. La reacción directa es impulsada por el fuerte enlace amida que resulta.
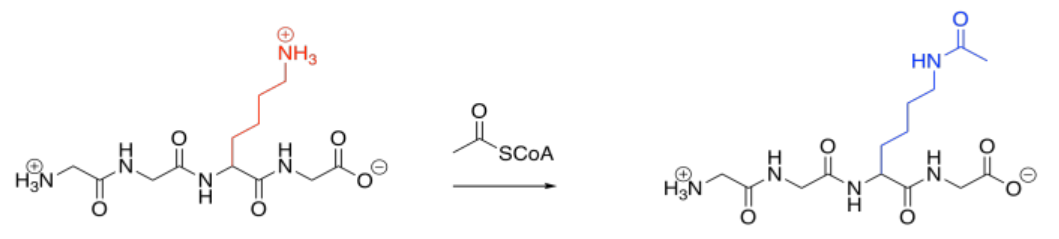
La acetilación se lleva a cabo por una acetilasa o una aciltransferasa. Al igual que las fosfatasas, estas son enzimas que unen sus proteínas diana para modificar sus estructuras. Debido a que las lisinas normalmente están cargadas positivamente a pH biológico, la acetilación da como resultado la desaparición repentina de especies cargadas porque están enmascaradas con grupos acilo neutros. Las atracciones intermoleculares pueden verse dramáticamente afectadas como resultado.
La prenilación es la adición de una cadena lateral de hidrocarburo, la mayoría de las veces a una cadena lateral de cisteína. El azufre es un nucleófilo particularmente bueno para las cadenas de carbono de este tipo, mejorando la selectividad para la cisteína. Como en los otros casos, sin embargo, la reacción se lleva a cabo bajo el control de una enzima (una geraniltrasnferasa, por ejemplo, o una farnesiltransferasa), y así otras cadenas laterales podrían ser dirigidas, en su lugar.
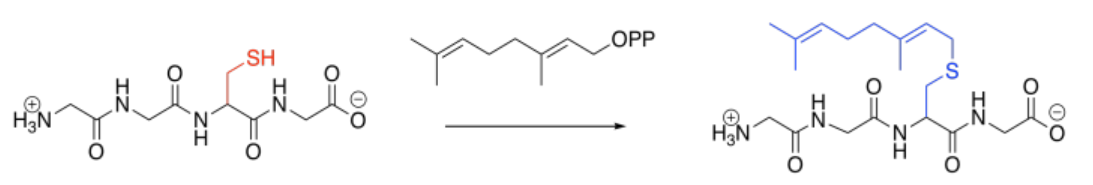
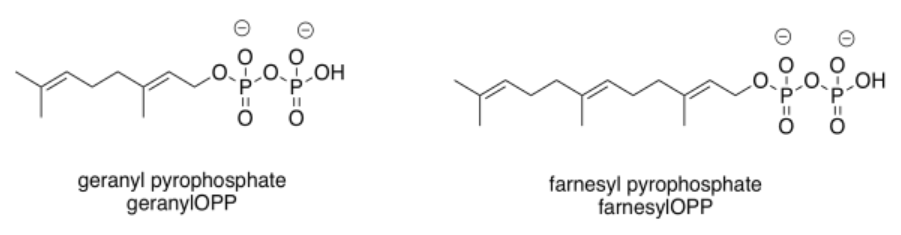
Esos tipos de enzimas destacan dos grupos comunes que se agregan en estos casos: el grupo geranilo y el grupo farnesil relacionado. Estos grupos están estructuralmente relacionados, y ambos pertenecen a la familia terpenoide de productos naturales. Los terpenos se basan en bloques de construcción de cinco carbonos, que se pueden rastrear fácilmente en las estructuras de geranilo y farnesil.
Los cambios en las atracciones intermoleculares son más sutiles en estos casos, porque la prenilación no va acompañada de un cambio completo en la carga de una cadena lateral como lo fue en los otros casos. En cambio, la adición de este grupo potencia la hidrofobicidad de esa parte de la proteína. Un grupo hidrófobo es aquel que es completamente incapaz de interactuar con moléculas de agua, careciendo de iones, dipolos o sitios de enlace de hidrógeno. Como resultado, tiende a ser desplazado o empujado fuera del camino por las moléculas de agua circundantes. Ese “alejamiento” por el agua tiene el efecto neto de apilar grupos hidrofóbicos juntos.
Lo que tendemos a conseguir, entonces, es que los grupos hidrofóbicos se pegan entre sí, a pesar de que su atracción mutua (las fuerzas londinenses) en realidad es bastante débil. Por supuesto, debido a que las fuerzas londinenses son relativamente débiles, la cantidad de fuerzas londinenses, o el área relativa de una molécula que puede interactuar con otra vía las fuerzas londinenses, se vuelve muy importante. Los grupos geranilo y farnesil son moderadamente largos, por lo que ejercen cantidades significativas de fuerzas londinenses. Como resultado, dos partes preniladas de una proteína podrían pegarse, o una parte recién prenilada podría agruparse con algunas cadenas laterales hidrofóbicas, como valinas, leucinas e isoleucinas. Además, la prenilación a veces provoca que una proteína que antes era más soluble en agua migre hacia la membrana celular, donde podría interactuar con la bicapa lipídica. Entonces, la prenilación, a pesar de causar cambios aparentemente modestos en las atracciones intermoleculares, puede provocar cambios dramáticos en el comportamiento de la proteína.
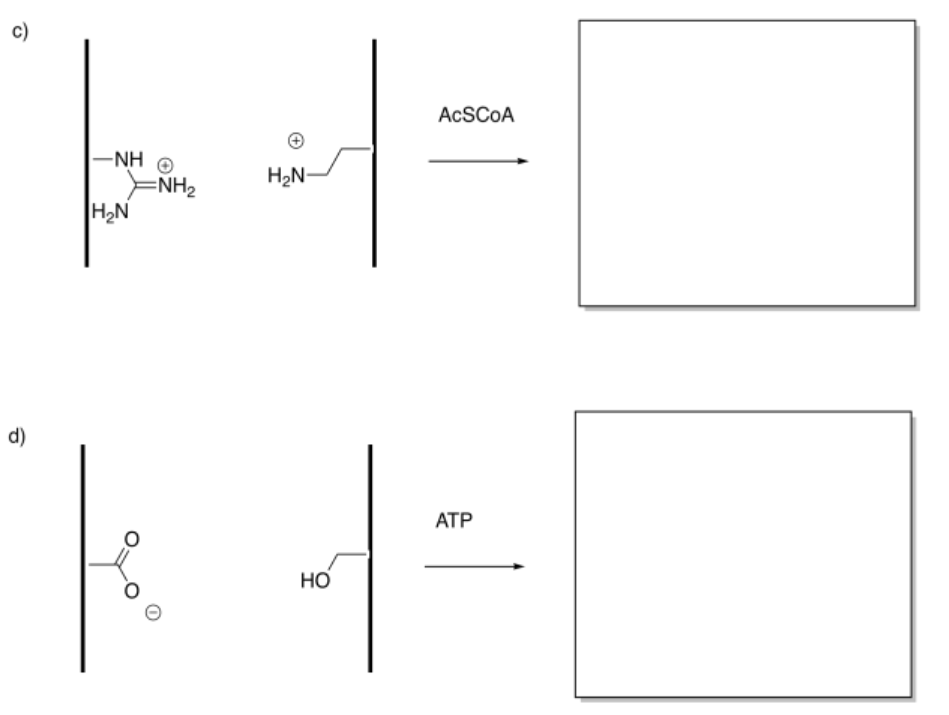
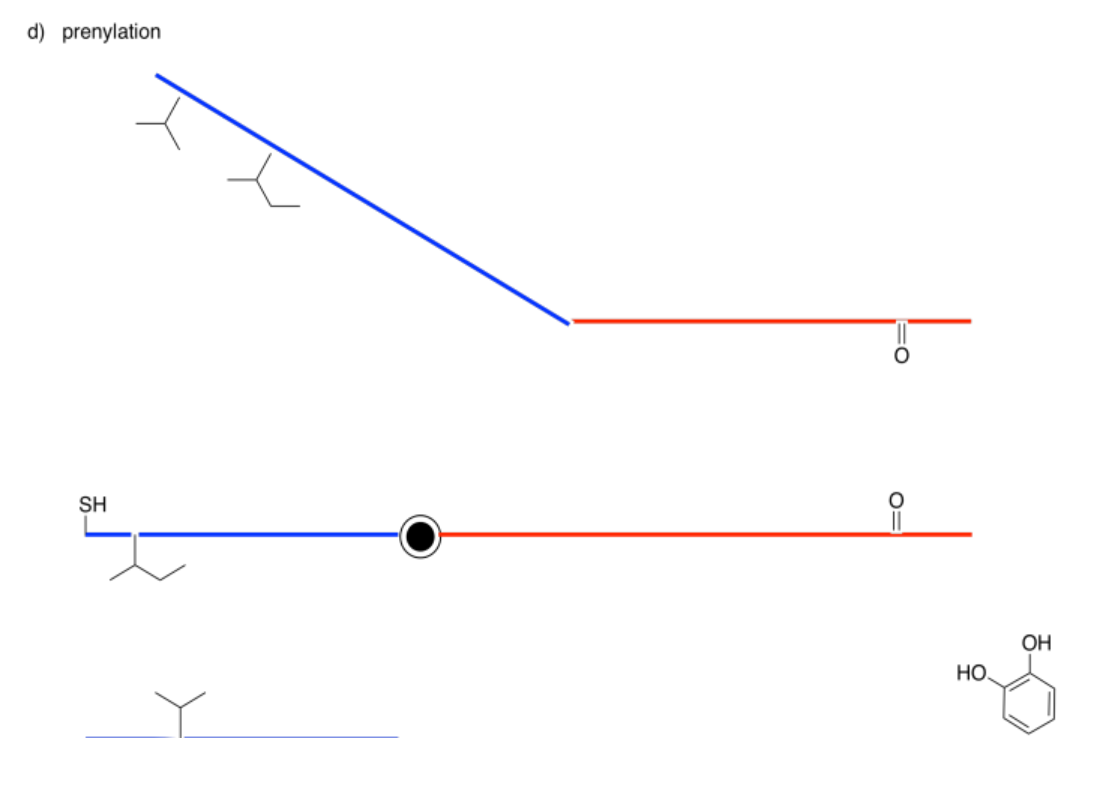
Mostrar los productos de las siguientes modificaciones.
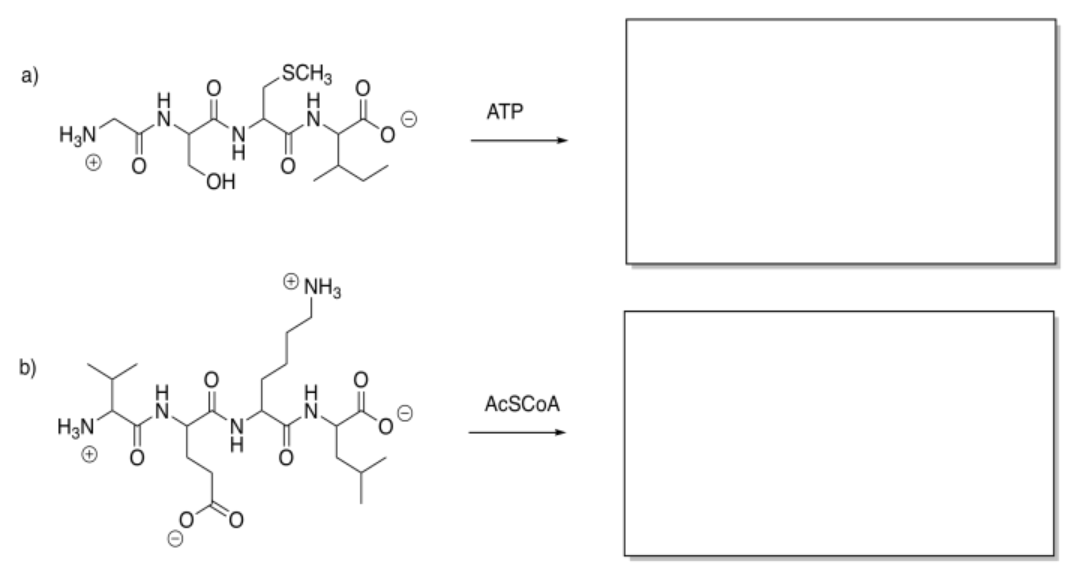
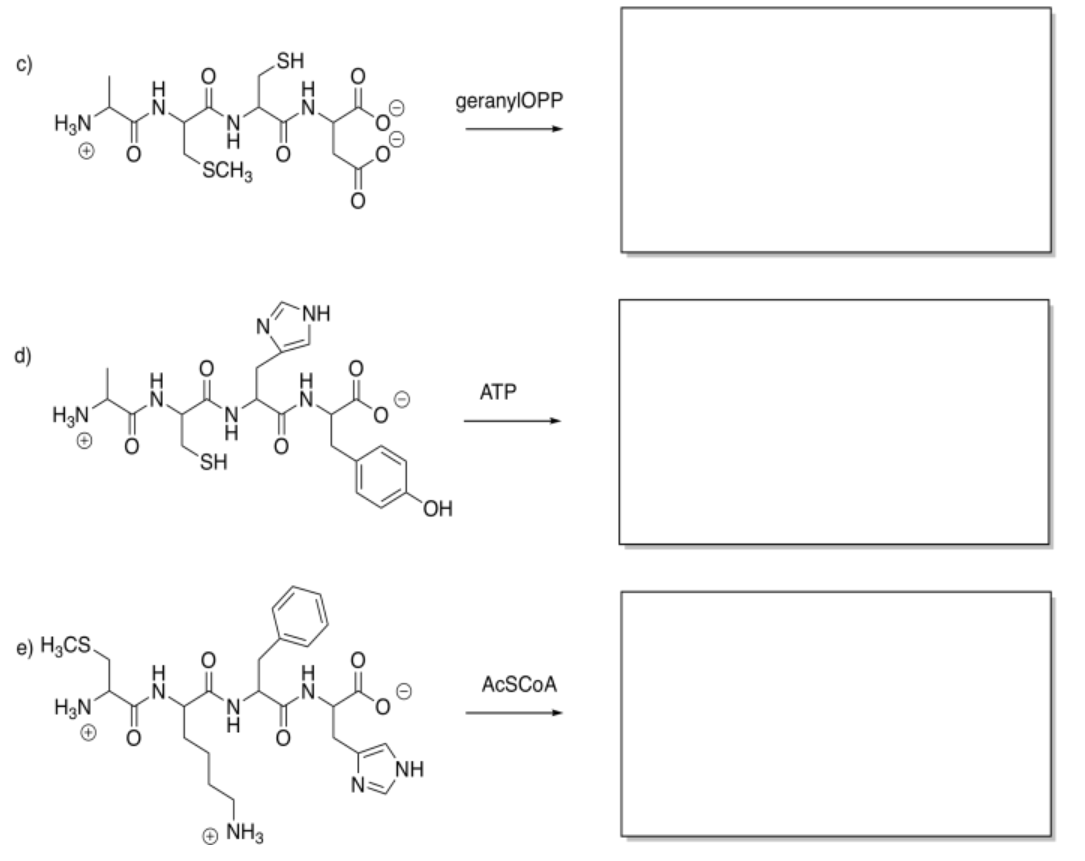
Contestar-
Indicar si la atracción entre las hebras aumentaría o disminuiría después de la modificación.
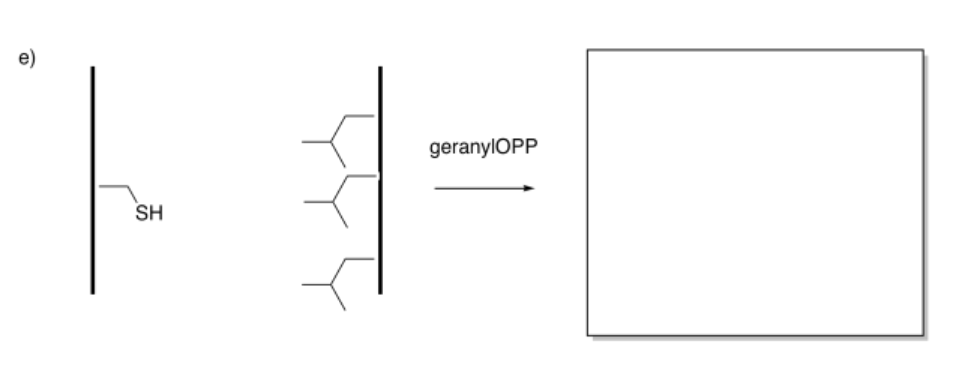
Contestar-

En los siguientes dibujos, la interacción del objeto con una de las superficies cambiará tras la modificación. Este cambio en la interacción resultará en un desplazamiento neto del objeto hacia la izquierda o hacia la derecha. El cambio puede resultar por fuerzas atractivas o repulsivas. Indicar la dirección del cambio en cada caso.
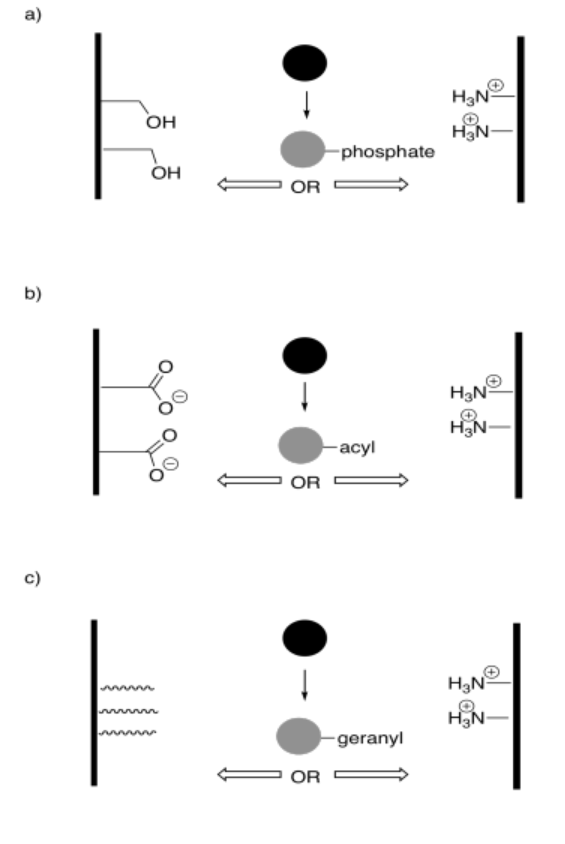
Contestar-

En los siguientes dibujos, el sitio activo está cerrado. Mostrar cómo se unirá el regulador, haciendo que el sitio activo se abra, y también mostrar cómo se unirá el sustrato.
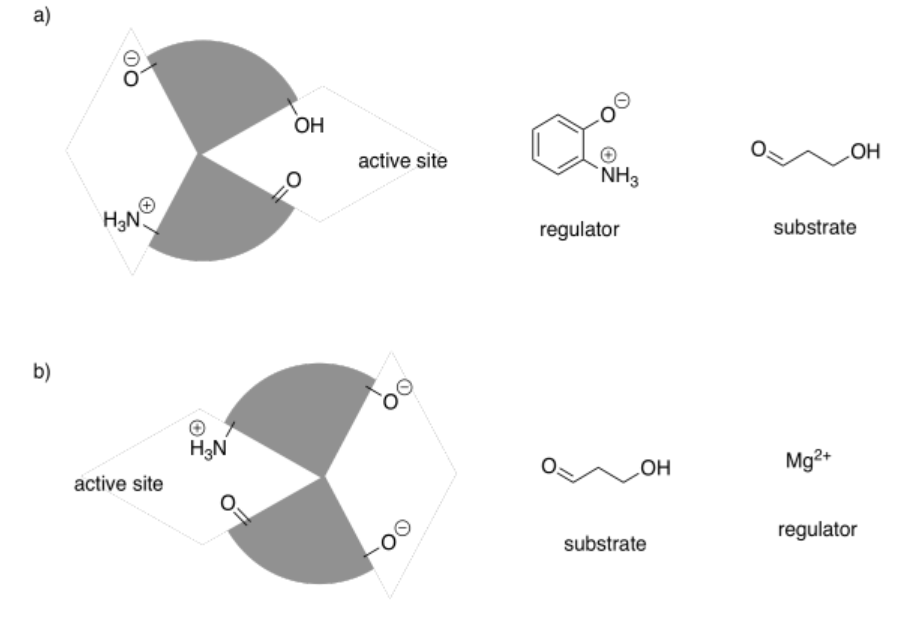
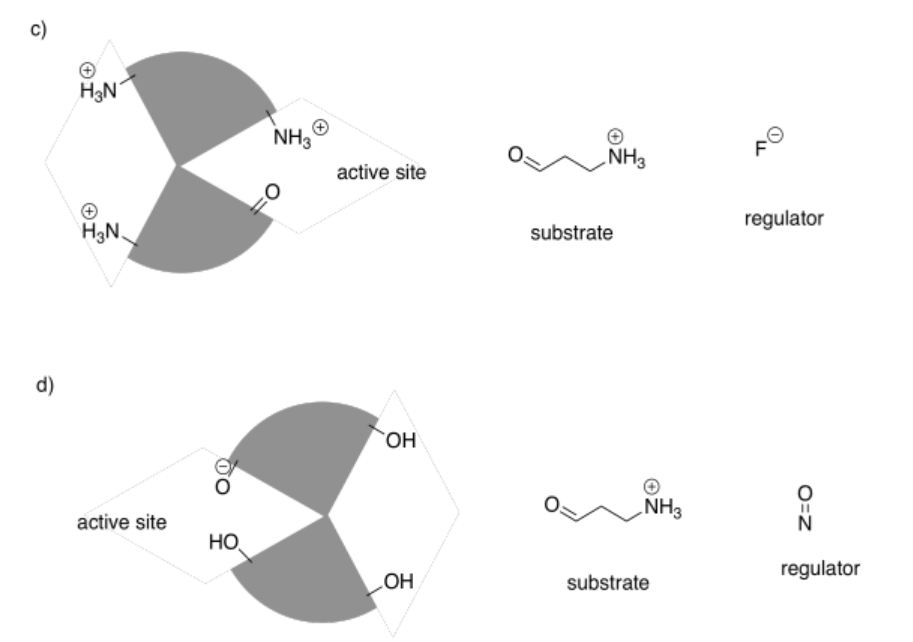
Contestar-

Los siguientes dibujos representan un sitio alostérico que se modificará a la izquierda y un sitio de unión a la derecha. Imagina que la barra central es una sierra que puede inclinarse hacia la izquierda o hacia la derecha. En cada caso, decida si la modificación conducirá a una unión más apretada o suelta del sustrato.
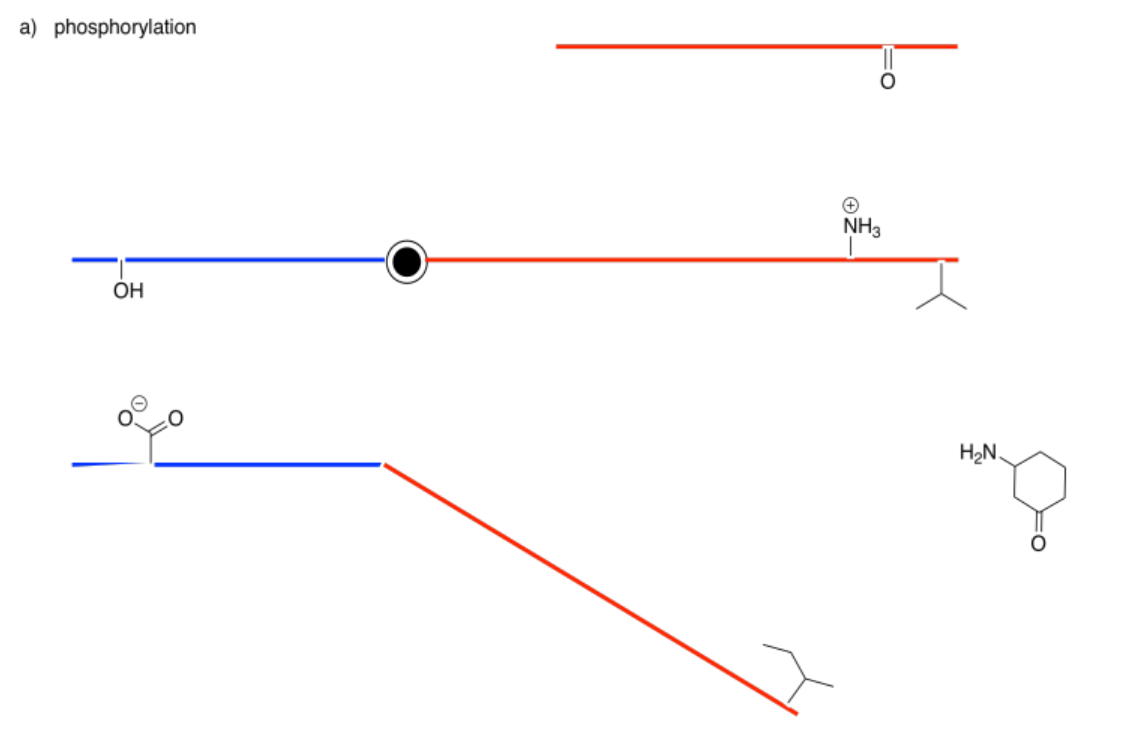
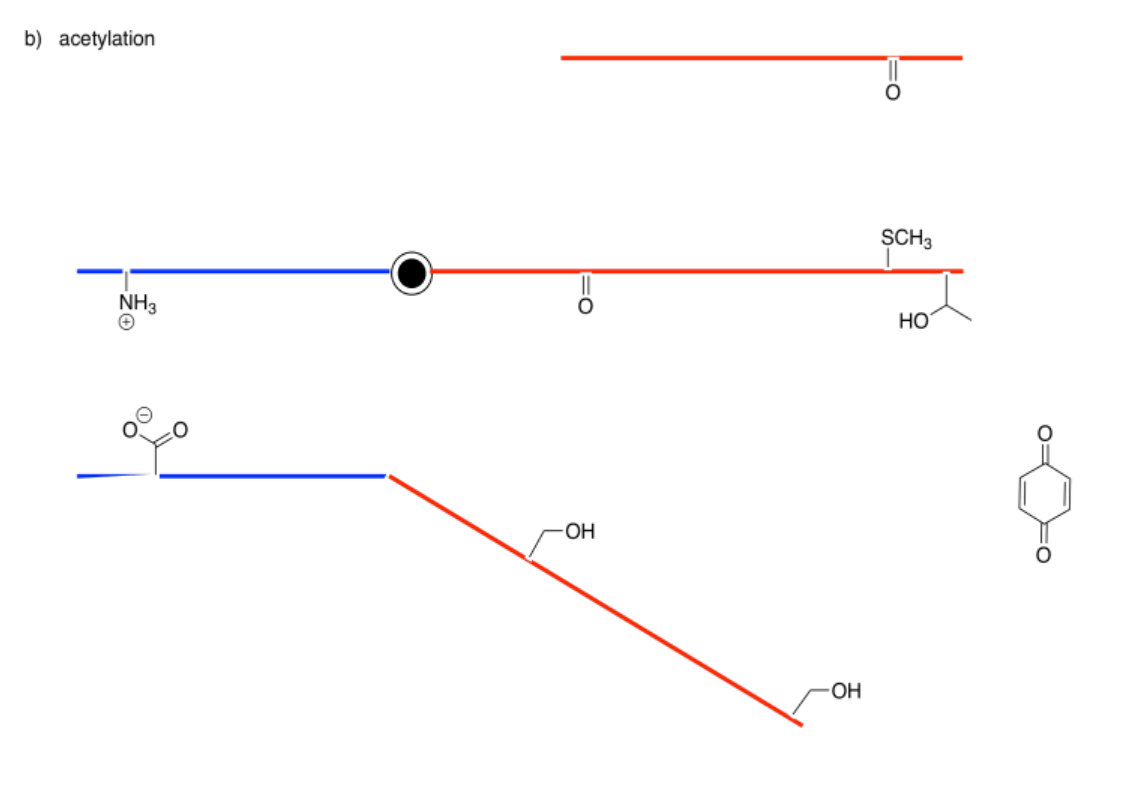
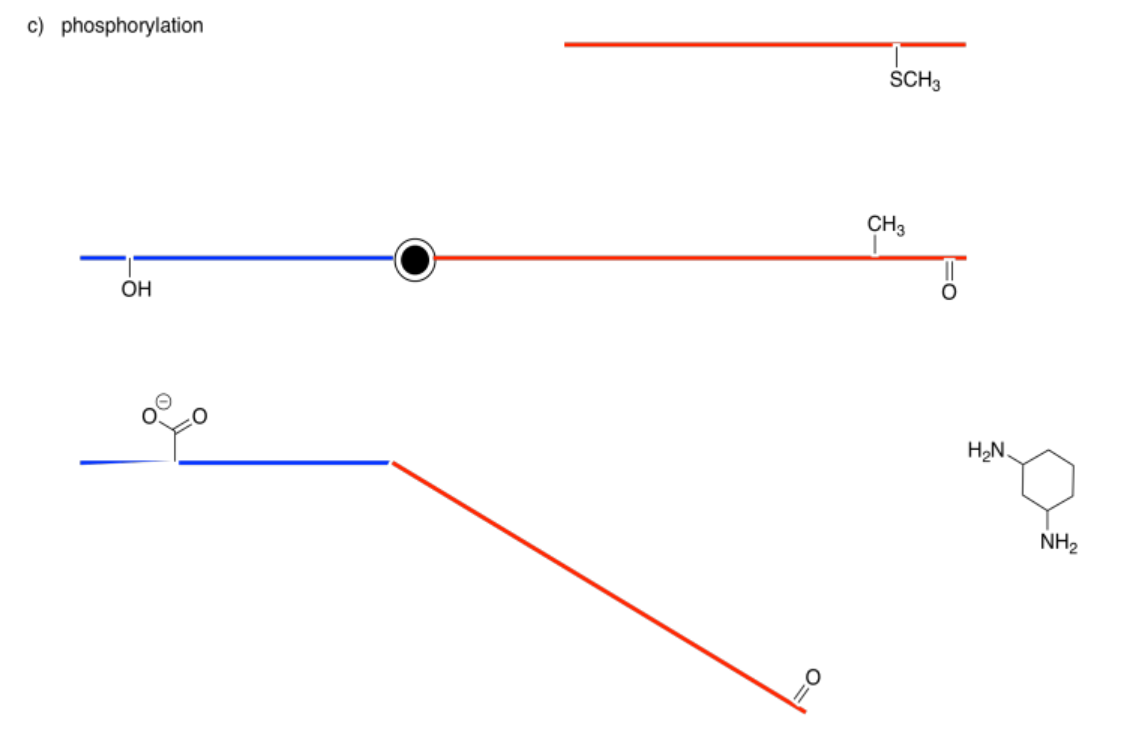
Contestar-


