8.1: Introducción a la glucólisis - Almacenamiento de Energía
- Page ID
- 79340
La glucólisis es una vía bioquímica en la que se consume glucosa y se produce ATP. Esta vía es un ejemplo de catabolismo, en el que las moléculas más grandes se descomponen en la célula para hacer otras más pequeñas. El tipo opuesto de vía es el anabolismo, en el que las moléculas más grandes se sintetizan a partir de las más pequeñas en la célula.
Desde la perspectiva del biólogo, el catabolismo se asocia con la descomposición de moléculas más grandes para liberar energía. Por ejemplo, en ciencias de primaria, es posible que hayas aprendido que la mayoría de los organismos derivan su energía de la descomposición de los carbohidratos. Es posible que hayas visto el proceso de respiración expresado a través de la siguiente ecuación de reacción:
\[\ce{C6H12O6_{(s)} + 6O2_{(g)} -> 6CO2_{(g)} + 6H2O_{(l)} + energy} \nonumber\]
Esa idea da lugar al paradigma ligeramente engañoso de que la energía se almacena en enlaces químicos. La idea va que, por ejemplo, cuando la única molécula de azúcar representada por la fórmula, C 6 H 12 O 6, se descompone para formar seis moléculas de dióxido de carbono, la energía de todos esos enlaces rotos se libera en beneficio del organismo.
También puede haber aprendido sobre otra molécula importante de almacenamiento de energía, el ATP. Al igual que la descomposición del azúcar, la descomposición del ATP se utiliza para alimentar otros procesos en la celda. Ese proceso podría expresarse en la siguiente expresión:
\[\ce{ATP_{(aq)} + H2O_{(l)} -> ADP_{(aq)} + P_{i(aq)} + energy} \nonumber\]
Una vez más, esto puede considerarse un proceso de desintegración, en el que una molécula de ATP se divide en una molécula de ADP más pequeña y un fosfato inorgánico.
Desde la perspectiva del químico, es erróneo sugerir que la energía se almacena en enlaces químicos. En cambio, la energía se libera cuando se forman enlaces. Esta perspectiva química es más que una idea; representa la realidad física. Se puede demostrar de diversas maneras que la energía se libera cuando se hacen los enlaces, y la energía debe ser utilizada para romper vínculos; al parecer, esta situación es lo opuesto al punto de vista biológico.
Algunos autores han sugerido que este aparente desacuerdo es algo así como una diferencia de perspectiva. Piense en un observador parado en la orilla del océano, observando un barco zarpar. Desde el punto de vista del observador, el barco finalmente se hunde bajo el océano. Después de un tiempo su casco ya no es visible; sólo quedan sus mástiles, y finalmente ellos también se deslizan hacia abajo y se van. A un pasajero en el barco, sin embargo, el barco todavía navega a lo largo de la superficie del océano. Los biólogos y químicos piensan en la vinculación de manera diferente porque lo están viendo desde un punto de vista diferente.
Los biólogos dicen que la energía se almacena en enlaces químicos porque pensar en las cosas de esa manera les es útil. Es útil pensar en procesos catabólicos, como la descomposición de azúcares, como liberadores de energía. Es útil pensar en procesos anabólicos, como la fotosíntesis o la síntesis de productos naturales complejos, como intensivos en energía.
Los biólogos están mirando las cosas puramente desde el punto de vista de la biomolécula. O se está descomponiendo en pedazos más pequeños (sus enlaces se están rompiendo), liberando energía, o de lo contrario se está construyendo en algo más grande (sus enlaces se están haciendo), costando energía.
En un sentido muy flojo, es como si la reacción de descomposición de carbohidratos se reduce a:
\[\ce{C6H12O6_{(s)} -> 6CO2_{(g)} + energy} \nonumber\]
Y la reacción de descomposición del ATP se abrevia a:
\[\ce{ATP_{(aq)} -> ADP_{(aq)} + P_{i(aq)} + energy} \nonumber\]
Es decir, se ignora parte de la reacción. Ese punto de vista permite enfocarse en la biomolécula, pero descuida algunas cosas importantes. Por ejemplo, en la descomposición de los carbohidratos, no es la ruptura del enlace C-C de los carbohidratos lo que es la fuente de energía. Es la formación de fuertes, nuevos enlaces O-H y C=O, y otros cambios, más sutiles, los que liberan la energía.
Como siempre, obtenemos más información sobre una reacción al observar las fórmulas estructurales en la ecuación, en lugar de las fórmulas condensadas. De esta manera, en realidad podemos ver qué vínculos se están haciendo y rompiendo.
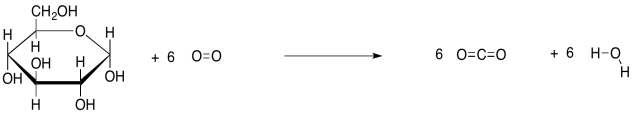
El caso de ATP es un poco diferente. Los bonos hechos y rotos son más o menos los mismos en la ruptura de la ATP; vagamente, solo negociamos un bono P-O por otro. Este caso es más complicado, pero la explicación más simple es que la escisión de ATP alivia la repulsión entre las múltiples cargas negativas en la molécula de ATP. La energía disminuye en las moléculas resultantes, y se libera el resto de la energía que solía estar en los reactivos.
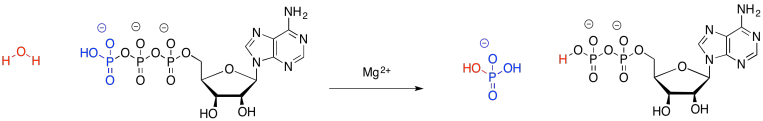
A la inversa, cuando ADP se fosforila para hacer ATP, el sistema sube de energía (el sistema simplemente significa todo en la reacción; es todo a un lado de la flecha o del otro). Esa energía, sin embargo, no se almacena realmente en ningún enlace químico. Se distribuye por todo el sistema, por ejemplo, en los movimientos de todos esos átomos. Los enlaces pueden estirarse, haciéndose más y más cortos, pero además los grupos en los extremos de los enlaces pueden girar, y las moléculas pueden voltear y deslizarse a través del espacio. Hay muchas maneras de distribuir esa energía a lo largo de toda esa colección de átomos; no se ve obligada a sentarse en ese único enlace que se formó recientemente entre dos átomos.
Entonces, aunque la idea de que la energía se almacene en enlaces químicos puede ser muy útil en el aula de biología, sólo se va a interponer en tu camino en el aula de química. Necesitas poder quitarte el sombrero de biólogo y ponerte la bata de laboratorio de químico cuando la necesites.
Nuestra economía está impulsada en gran medida por el consumo de combustibles fósiles, como el heptano. Dada la siguiente reacción para la descomposición del heptano:
CH 3 CH 2 CH 2 CH 2 CH 2 CH 2 CH 3 + 11 O 2 → 7 CO 2 + 8 H 2 O
Utilice la tabla de resistencias de unión para determinar cuánta energía se libera cuando se consume un mol de heptano.
| Bond | O=O | C-C | C-H | C=O | O-H |
| Fuerza Media de Adhesión (kcal/mol) | 120 | 80 | 100 | 190 | 110 |
- Comience por determinar la energía necesaria para romper los vínculos.
- Determinar la energía liberada cuando se hacen nuevos bonos.
- Determinar el cambio energético general.
- Contestar
-
Bonos Rotos:
C-C 6 x 80 kcal/mol = 480 kcal/mol
C-H 16 x 100 kcal/mol = 1,600 kcal/mol
O=O 7 x 120 kcal/mol = 840 kcal/mol
Total: 2,920 kcal/mol
Bonos hechos:
C=O 14 x (- 190 kcal/mol) = - 2,660 kcal/mol
O-H 16 x (- 110 kcal/mol) = -1,760 kcal/mol
Total: -4,420 kcal/mol
Total: 1,240 - 4,420 kcal/mol = -1,500 kcal/mol
Use la tabla de resistencias de unión para determinar cuánta energía se libera cuando se consume un mol de octano.
CH 3 CH 2 CH 2 CH 2 CH 2 CH 2 CH 2 CH 3 + 12.5 O 2 → 8 CO 2 + 9 H 2 O
- Contestar
-
Bonos Rotos:
C-C 7 x 80 kcal/mol = 560 kcal/mol
C-H 18 x 100 kcal/mol = 1,800 kcal/mol
O=O 12.5 x 120 kcal/mol = 1,500 kcal/mol
Total: 3,860 kcal/mol
Bonos hechos:
C=O 16 x (- 190 kcal/mol) = - 3,040 kcal/mol
O-H 18 x (- 110 kcal/mol) = -1,980 kcal/mol
Total: -5,020 kcal/mol
Total: 3,860 - 5,020 kcal/mol = -1,160 kcal/mol
Dada una fuerza de unión C-O aproximada de 85 kcal/mol, use la tabla de resistencias de unión para determinar cuánta energía se libera cuando se consume un mol de glucosa.
- Contestar
-
Bonos Rotos:
C-C 6 x 80 kcal/mol = 480 kcal/mol
C-H 7 x 100 kcal/mol = 700 kcal/mol
C-O 7 x 85 kcal/mol = 595 kcal/mol
O-H 5 x 110 kcal/mol = 550 kcal/mol
O=O 6 x 120 kcal/mol = 840 kcal/mol
Total: 3,165 kcal/mol
Bonos hechos:
C=O 12 x (- 190 kcal/mol) = - 2,280 kcal/mol
O-H 12 x (- 110 kcal/mol) = -1,320 kcal/mol
Total: -3,600 kcal/mol
Total: 3,165 - 3,600 kcal/mol = -435 kcal/mol
Proporcionar un mecanismo para la hidrólisis de ATP a ADP.
- Contestar
-
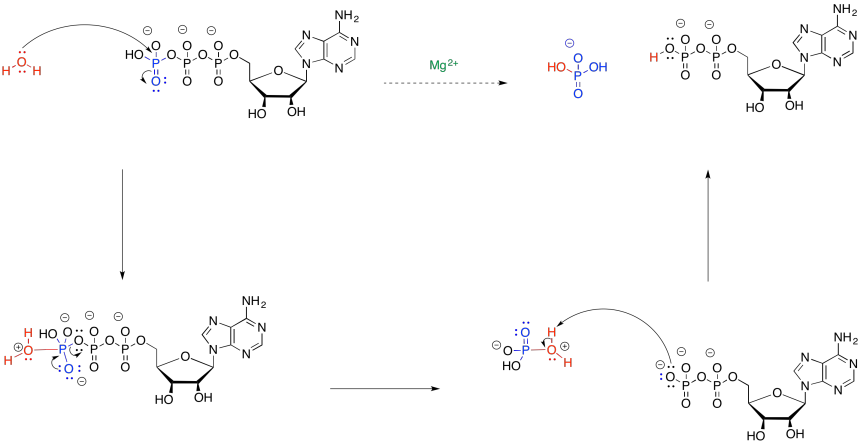
Sugerir un posible papel del ion magnesio en la hidrólisis de ATP.
- Contestar
-
En el mecanismo de hidrólisis, el agua actúa como nucleófilo y el ATP actúa como electrófilo. Eso es un problema porque el ATP está cargado negativamente. No atraerá electrones muy fácilmente. Al unirse al ion magnesio (Mg 2+), se bajará la carga sobre el ATP, acelerando la reacción con agua.

