8.8: Termodinámica de la Glicólisis
- Page ID
- 79327
La glucólisis está íntimamente ligada a la liberación de energía en los sistemas biológicos, y al aprovechamiento de esa energía para hacer el trabajo. De eso se trata el campo de la termodinámica. En esta sección, vamos a echar un vistazo muy breve a algunas de las consideraciones energéticas de esta vía.
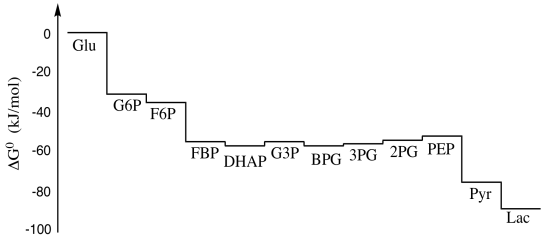
Hemos visto que la glucólisis es una secuencia de reacciones que conducen de un compuesto intermedio en la ruta al siguiente. (Para volver a ver ese camino, haga clic aquí.) Inevitablemente, hay cambios energéticos asociados con cada una de esas reacciones. Algunas de las reacciones pueden ser endotérmicas, otras pueden ser exotérmicas; algunas pueden ser esencialmente irreversibles, mientras que otras pueden ocurrir en equilibrio. Si mapeamos estos cambios de energía de principio a fin, obtenemos una imagen como la de abajo. Es una montaña rusa, con muchas gotas energéticas pero igual cantidad de colinas, y se hace difícil pensar en la glucólisis como un proceso que libera energía, a excepción de la caída dramática en los últimos dos pasos.
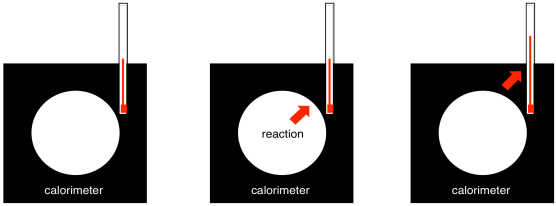
¿De dónde viene una imagen como esta? Bueno, representa una serie de reacciones, y el cambio de energía asociado con cada reacción. Podemos determinar el cambio de energía asociado a una reacción específica mediante calorimetría. Un calorímetro es un dispositivo bien aislado en el que podemos realizar una reacción. Un termómetro nos dice el cambio de temperatura como resultado de la reacción. Podemos calibrar el dispositivo liberando cantidades conocidas de calor y viendo cuánto sube su temperatura. En consecuencia, también podemos usar esa correlación hacia atrás: dado el aumento de temperatura, podemos deducir cuánta energía se liberó durante una reacción.
Ahora bien, si suficientes personas han estudiado este tipo de cosas durante el tiempo suficiente, podemos comenzar a compilar muchos datos. Dados suficientes datos, es posible que en realidad no necesite realizar calorimetría para determinar cuánta energía está involucrada en una reacción.
Para ilustrar por qué, considera uno de los tipos más comunes de datos termodinámicos que puedes encontrar: calores de formación. El calor de formación de un compuesto es la energía involucrada cuando el compuesto se forma a partir de los elementos. Entonces, por ejemplo, el calor de formación del metano sería la energía involucrada cuando el hidrógeno cas se combina con el carbono para formar metano:
\[\ce{2H2 + C -> CH4 \: \: \Delta H = ??} \nonumber\]
Sería difícil realizar calorimetría en este caso. En primer lugar, hay demasiadas cosas que podrían pasar si lograras que el hidrógeno y el carbono se combinaran; hay muchos otros compuestos hechos de hidrógeno y carbono, entonces, ¿quién sabe qué reacción ocurriría realmente?
Pero encontramos ese calor de formación indirectamente, utilizando otros datos. Podemos quemar metano:
\[\ce{2O2 + CH4 -> CO2 + 2H2O \: \: \Delta H = -802 \frac{kJ}{mol}} \nonumber\]
Podemos quemar hidrógeno para obtener agua:
\[\ce{H2 + 0.5 O2 -> H2O \: \: \Delta H = -285_{.}8 \frac{kJ}{mol}} \nonumber\]
Podemos quemar carbono para obtener dióxido de carbono:
\[\ce{O2 + C -> CO2 \: \: \Delta H = -393_{.}5 \frac{kJ}{mol}} \nonumber\]
Bueno, eso solo parece una serie de hechos aleatorios, pero las ecuaciones de reacción se parecen bastante a ecuaciones algebraicas, y esas flechas de reacción son bastante como signos iguales. Si tenemos eso en mente, podemos manipular estas ecuaciones para obtener información útil. Por ejemplo, ¿qué pasaría si tomáramos la reacción media y la multiplicáramos por dos?
\[\ce{2H2 + O2 -> 2H2O \: \: \Delta H = -571_{.}6 \frac{kJ}{mol}} \nonumber\]
Así como en álgebra, si multiplicamos cada término en una ecuación por el mismo factor, terminamos con una ecuación equivalente. Es una operación perfectamente legal. Tenga en cuenta que si multiplicamos la ecuación por dos, también multiplicamos la energía por dos; es parte de la ecuación.
Ahora bien, probablemente ya sepas lo que sucede si consideramos una de estas ecuaciones a la inversa:
\[\ce{2CO2 + 2H2O -> 2O2 + CH4 \: \: \Delta H = +802 \frac{kJ}{mol}} \nonumber\]
Si la reacción es exotérmica en una dirección, entonces debe ser endotérmica en la otra. Un camino es cuesta abajo, así que el otro camino es cuesta arriba.
Mira lo que pasa si sumamos estas tres reacciones juntas en sus formas actuales:
\[\ce{CO2 + 2H2O -> 2O2 + CH4 \: \: \Delta H = + 890_{.}3 \frac{kJ}{mol}} \nonumber\]
\[\ce{2H2 + O2 -> 2H2O \: \: \: \: \: \: \: \Delta H =-571_{.}6 \frac{kJ}{mol}} \nonumber\]
\[\ce{O2 + C -> CO2 \: \: \: \: \: \: \: \Delta H = -393_{.}5 \frac{kJ}{mol}} \nonumber\]
\[\ce{CO2 + 2H2O + 2O2 +2H2 + C -> 2O2 + CH4 + 2H2O + CO2 \: \: \Delta H = +802 \frac{kJ}{mol}} \nonumber\]
Varias cosas cancelan a izquierda y derecha, dejando:
\[\ce{2H2 + C -> CH4 \: \: \Delta H = -74_{.}8 \frac{kJ}{mol}} \nonumber\]
Lo que eso significa es que, si tenemos información energética sobre algunas reacciones, y podemos combinar las ecuaciones para esas reacciones para obtener una nueva ecuación de reacción, entonces automáticamente obtenemos la energía asociada a esa nueva reacción.
Esencialmente, si queremos saber sobre la energía de producir metano a partir del carbono y el hidrógeno, entonces no importa cómo lleguemos del carbono y el hidrógeno al metano. Primero podemos tomar el carbono y combinarlo con oxígeno, no hidrógeno, y hacer dióxido de carbono. Entonces, podemos tomar hidrógeno y combinarlo con oxígeno, no con carbono, para hacer agua. Si, finalmente, combinamos el agua y el dióxido de carbono que hemos hecho y producimos metano, entonces la energía de ese todo, proceso de rotonda es la misma que si convertiéramos el carbono y el hidrógeno directamente en metano.
Esta idea ilustra algo llamado Ley de Hess'. La energía general requerida para pasar de un conjunto de reactivos a otro conjunto de productos es siempre la misma, independientemente del camino que se tome. La Ley de Hess' es cierta porque la energía es una “función estatal”. Si conocemos el estado en el que actualmente se encuentra algo -por ejemplo, metano en fase gaseosa a cierta temperatura y presión- entonces conocemos su energía. No importa lo que le haya pasado antes, o cómo llegó a su estado actual.
Problema GL9.1.
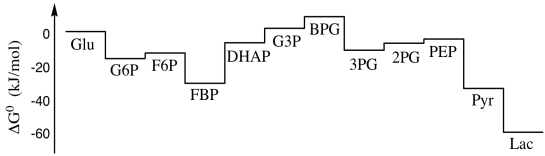
En la siguiente sección, vamos a ver una imagen ligeramente diferente del terreno energético de la glucólisis. En lugar de la montaña rusa que vimos antes, encontraremos que la glucólisis existe principalmente en una llanura enérgica, con solo un par de caídas empinadas. La razón de ello tiene que ver con las concentraciones relativas de las diferentes especies bajo condiciones celulares.