8.7: Catálisis de la Fase Dos
- Page ID
- 79384
En la fase dos de la glucólisis, el gliceraldehído-3-fosfato procede a través de una reacción de oxidación, en la que un aldehído hidrógeno es reemplazado por un grupo fosfato. Si te estás rascando la cabeza, preguntándote cómo podría suceder esa reacción, entonces eso es algo bueno. El hidrógeno no es un buen grupo de salida, y no se han visto muchos precedentes para este tipo de reacciones.

Este paso parece un muy buen lugar para la catálisis. La reacción no parece que vaya a funcionar muy bien, por lo que necesitamos una vía alternativa, de menor energía. Por lo menos, esta es una buena situación para la estrategia enzimática de aproximación, en la que dos sustratos se mantienen cerca uno del otro por sus respectivas colocaciones en el sitio activo. La aproximación es necesaria debido a ese pobre grupo lábil de hidruro, H -. Realmente no se puede desplazar de la molécula para convertirse en un ion hidruro en solución libre, porque no es lo suficientemente estable. Necesita ese aceptor NAD + para estar esperándolo ya que sale de la molécula de gliceraldehído-3-fosfato.
Pero el hidruro no es desplazado directamente por el fosfato; hay un paso invisible en el medio. Un residuo de cisteína de la enzima dona primero al carbonilo. El azufre es un nucleófilo muy bueno para los electrófilos de carbono; el azufre es un poco menos electronegativo y más polarizable que el oxígeno, por lo que puede donar electrones con relativa facilidad.
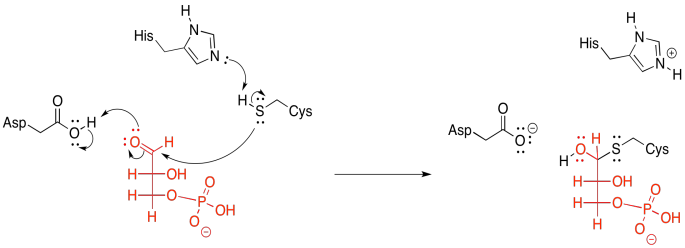
Esa donación da como resultado la formación de un hemitioacetal. Además, ata la molécula de gliceraldehído a la enzima. Esta característica es un ejemplo de la estrategia de transferencia grupal, en la que el sustrato se une temporalmente a la enzima que está trabajando en él. Esta transferencia grupal podría explicarse como ganar un borde entrópico para ayudar a superar un paso entálpicamente difícil. Esta siguiente parte puede ser un poco complicada, así que vamos a atar el sustrato por un momento.
Entonces, ahora estamos listos para donar pi desde el intermedio tetraédrico, empujando el hidruro hacia el NAD + en espera, como un tono rápido directamente en el manopla del receptor.
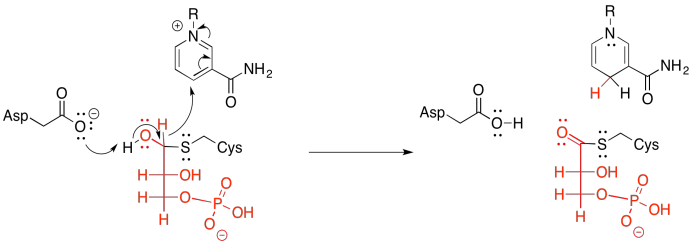
Por supuesto, la transferencia de grupo siempre se basa en que el sustrato se corte de nuevo de la enzima. De lo contrario, la transferencia sería un ejemplo de inhibición irreversible; la molécula sustrato quedaría atrapada en la enzima, bloqueando para siempre su sitio activo. Lo que pasa con el azufre, sin embargo, es que su polarizabilidad lo convierte en un grupo de salida bastante bueno. Recuerde, también, que los tioésteres son más reactivos que los ésteres regulares. Los tioésteres se sitúan más arriba en la colina de esquí ilustrando la reactividad relativa de los carboxiloides. Eso significa que el uso de un residuo de cisteína como grupo de fijación, en lugar de nitrógeno de lisina o oxígeno de serina, es particularmente ventajoso para la etapa de escisión.
La etapa de escisión implica la donación de un ión fosfato inorgánico. El carbonilo se abre para dar un intermedio tetraédrico, y cuando ese intermedio colapsa de nuevo, se libera la cisteína.
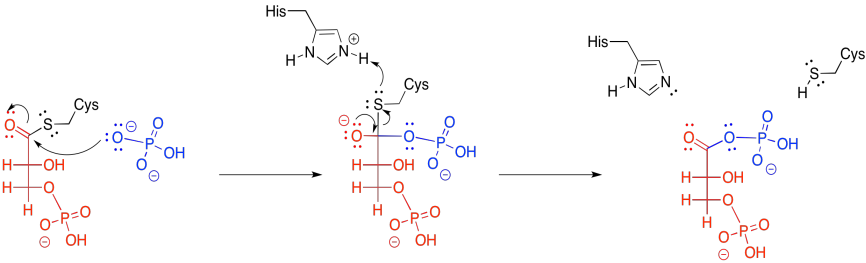
El segundo paso de la fase dos parece un poco más sencillo. Es solo un desplazamiento de un grupo de salida carboxilato de un fosfoanhídrido.

Recuerde, al igual que el tioéster del que se formó, este anhídrido estaba alto en la colina de esquí, porque el anión carboxilato es un buen grupo de salida. El fosfato dona al grupo fosforilo, resultando en un fósforo de cinco coordenadas. Este intermedio colapsa, expulsando el grupo de salida carboxilato.
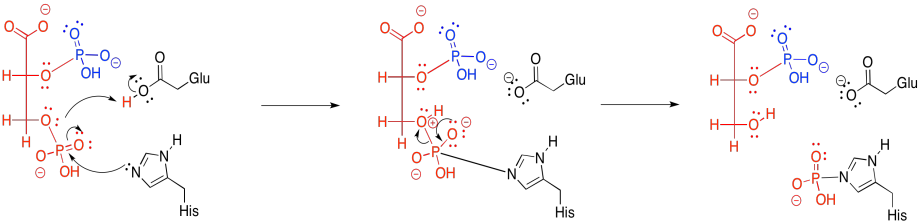
El tercer paso también parece sencillo. Parece que el fosfato apenas se está moviendo de un oxígeno a otro.

En la práctica, las cosas son un poco más complicadas. En los animales, el fosfato que viene de la posición 3 no es lo mismo que el fosfato que termina en la posición 2. Es decir, en lugar de simplemente mover el fosfato de un lugar a otro, se agrega un nuevo fosfato antes de que se elimine el viejo.
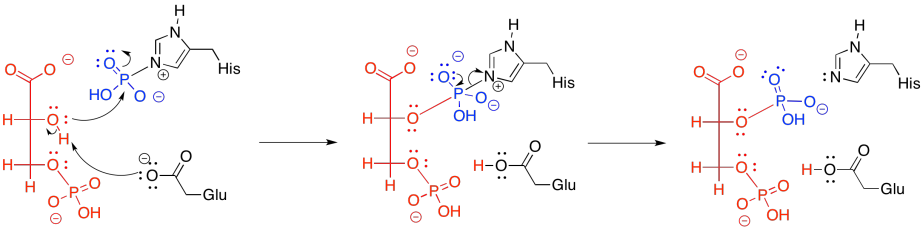
El nuevo fosfato se entrega a partir de un residuo de histidina modificado en la anzima. La misma histidina puede entonces recoger el fosfato viejo de la posición 3, que luego se aferrará, esperando para entregarlo a la siguiente molécula sustrato que llegue a la enzima.

El cuarto paso es, en principio, una simple deshidratación.
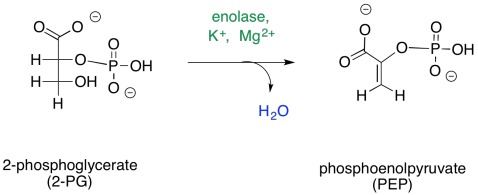
Una vez más, este paso requiere de un catión para activarlo. En algunos casos, dos iones magnesio parecen estar involucrados: uno para unir el fosfato y otro para unir el carboxilato. Otros casos emplean un ion magesio y un ion potasio.
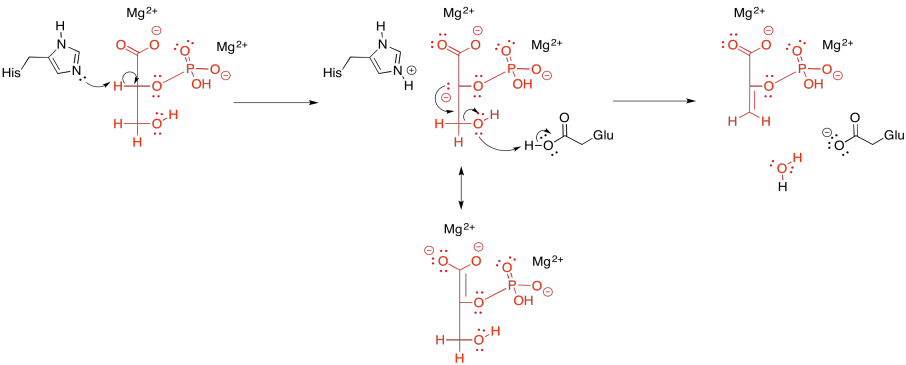
De cualquier manera, la coordinación a un ion metálico probablemente disminuye el pKa del hidrógeno alfa. En lugar de desprotonar para producir un trianión o tetra-anión (dependiendo de si el fosfato ya está desprotonado por separado o doblemente desprotonado), el sustrato unido a metal producirá un anión con una carga negativa global más baja que tendríamos de otra manera. La desprotonación parece ser realizada por una lisina en algunas enzimas y una histidina en otras.
Después de eso, se pierde el grupo beta-hidroxi. Necesita recoger un protón para convertirse en agua. Ese protón puede ser suministrado por un glutamato cercano, que transporta el protón de otra parte.
El paso final en la glucólisis es otra transferencia de fosfato.

Una vez más, el ADP es el nucelófilo que desplaza al grupo de salida del electrófilo de fosfato. Esta vez, el grupo de salida es un anión enolato. La reacción requiere iones de magnesio para mantener el ADP en su lugar.

