9.2: Transformaciones en el ciclo de TCA
- Page ID
- 79299
En esta sección, echaremos un vistazo a los pasos individuales que conforman el ciclo de TCA. Intentaremos ver cómo están cambiando las moléculas, y relacionar esos cambios con eventos estándar a partir de la reactividad orgánica.
El primer paso que conduce al ciclo del ácido cítrico es la conversión del piruvato en acetil coenzima A (o acetil CoA).

La acetil coenzima A es una molécula muy importante en una amplia gama de reacciones bioquímicas, además de su papel en el ciclo del ácido cítrico.
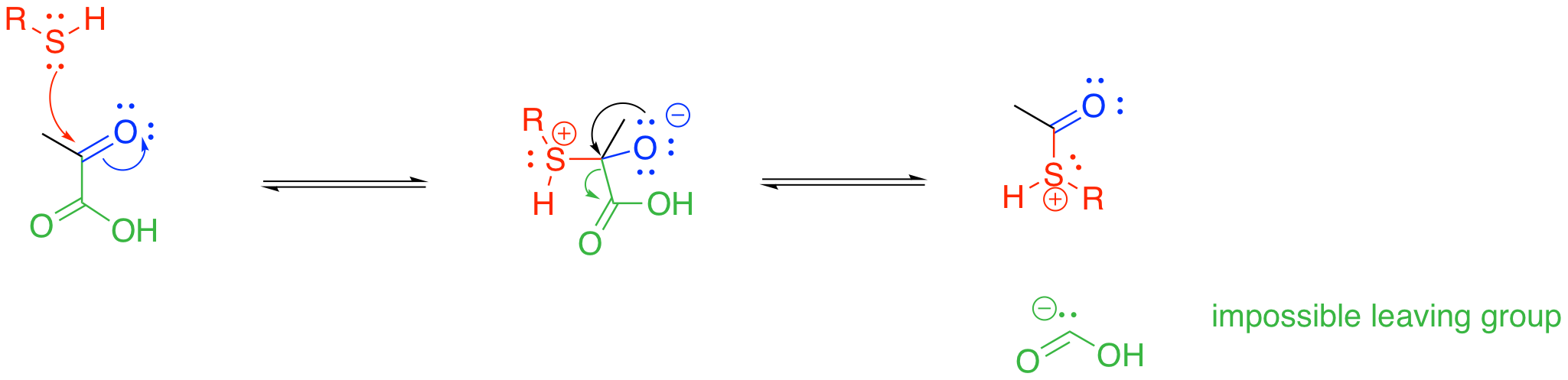
Entonces, esta es una transformación realmente importante, sin embargo, este paso plantea un problema irritante. Si miras la reacción, verás que uno de los tres átomos de carbono originales en el piruvato se pierde como dióxido de carbono. Esto se llama descarboxilación, y no es infrecuente en química biológica. Una descarboxilación comienza con un grupo carboxilato o ácido carboxílico, que ya contiene un enlace C=O así como un enlace C-O. Un par solitario del oxígeno C-O dona al carbono carboxilo, formando el segundo enlace C=O. Ese escalón desplaza a un grupo lábil del otro lado del carbono carboxilo. Más comúnmente, el grupo de salida necesario para esta etapa es un anión enolato estable.
A primera vista, las cosas pueden parecer bien para que eso proceda en la etapa de descomposición del piruvato, pero hay un problema. El grupo lábil no es un anión enolato, y no es un anión particularmente estable. Los aniones de carbono más estables están deslocalizados por resonancia, preferiblemente sobre oxígeno, como en un anión enolato o carbonato. El grupo de salida que tendríamos aquí, sin embargo, no ofrece tal ventaja.

Ejercicio\(\PageIndex{1}\)
Mostrar, con una estructura de resonancia adicional, por qué no es posible la deslocalización por resonancia del anión acilo.
- Contestar
-

Ejercicio\(\PageIndex{2}\)
Demostrar, utilizando caricaturas orbitales moleculares, por qué no es posible la deslocalización por resonancia del anión acilo.
- Contestar
-

Algo más está sucediendo también en el paso piruvato a acetil CoA. En esta etapa también se incorpora un grupo tiolato; de hecho, esta parte trae la coenzima A. Desde ese punto de vista, tal vez este paso se considere mejor como una sustitución carboxílica en el grupo acilo. Los tioles ciertamente pueden desplazar a los grupos salientes de los carboxiloides.
Desafortunadamente, nos topamos con el mismo bloqueo de esta manera. Todavía necesitamos un anión a base de carbonilo, y eso no va a suceder. De cualquier manera, la estrategia catalizada por enzimas para esta etapa debe abordar la estabilización de ese fragmento carbonilo como anión. Esa tarea se va a lograr a través del apego temporal a un iluro, que veremos en la siguiente sección.
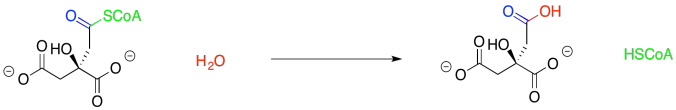
El ciclo de TCA realmente se inicia con la adición del acetil CoA al oxaloacetato, formando ácido cítrico. Ese paso también resulta en el desplazamiento del CoA tiol vía hidrólisis.

Este paso de formación de citrato es un poco más fácil de trabajar que el último que vimos. La clave es reconocer que el grupo acetilo, que contiene una posición carbonilo y una alfa, podría tautomerizarse fácilmente para formar un enol. Visto de esa manera, la parte acetil del acetil CoA como un nucleófilo, más que un electrófilo.

El mejor electrófilo en la molécula complementaria, el oxaloacetato, es el carbonilo de la cetona; recuerden, pi-donación, disminuye la electrofilicidad de los grupos carboxilato, por no hablar de la carga negativa. Entonces lo que tenemos aquí es una adición estándar de un nucleófilo a un carbonilo, con este último formando un grupo hidroxi ya que recoge un protón. Con un nucleófilo enol o enolato, es una reacción aldólica.
Además, el desplazamiento del tiol por el agua parece bastante trivial. Esa es la sustitución carboxiloide estándar.
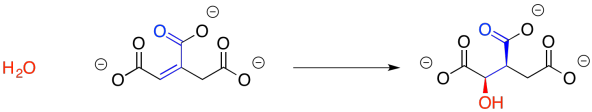
La posterior conversión de citrato a isocitrato parece, al principio, ser un poco más complicada. En una posición, un grupo hidroxi es reemplazado por un átomo de hidrógeno, mientras que un grupo hidroxi reemplaza a un átomo de hidrógeno en otra posición.

Sin embargo, éste tampoco es terriblemente complicado. Ayuda a ver que la reacción se logra en dos etapas separadas, y completamente complementarias. Ya has visto el primero antes en relación con las reacciones aldólicas. A veces una reacción aldólica va seguida de la pérdida de una molécula de agua. El grupo OH recién hecho recoge un protón de la posición alfa vecina para formar esa agua. Recuerde, el término más antiguo, “condensación aldólica”, se refería a la formación de agua, que se condensaría sobre la cristalería en la que se producía la reacción. Este paso suele ser promovido por la presencia de conjugación adicional que implica el nuevo doble enlace y a veces es promovido por el calor, pero en este caso se lleva a cabo por una anzima.

Tenga en cuenta que giramos alrededor de ese enlace medio del citrato, a la izquierda, pero sigue siendo la misma molécula.
Puede que no hayamos considerado antes la reversibilidad de esta reacción, pero eso es lo que tenemos que hacer ahora. El grupo enona, un carbonilo en conjugación con un enlace C=C, es electrófilo tanto en el carbono carbonilo como en el carbono beta. La molécula de agua simplemente podría volver a agregarse en donde solía estar, haciendo citrato nuevamente. Hay otra manera de ver el electrófilo, sin embargo, porque hay otro carbonilo en el otro extremo del doble enlace. Agregar en esa dirección conduce al isocitrato.
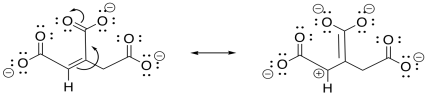
Ejercicio\(\PageIndex{3}\)
Dibujar estructuras de resonancia que demuestren la electrofilicidad de las posiciones conjugadas en el intermedio anterior.
- Contestar
-
Durante el ciclo de TCA, se pierden dos carbonos adicionales como dióxido de carbono, ya que el citrato de seis carbonos regresa al oxaloacetato de cuatro carbonos. El primero se pierde en la conversión de isocitrato a alfa-cetoglutarato. También en esta etapa, un grupo hidroxi se convierte en un carbonilo.

Entonces, este paso es otro caso de descarboxilación. Vimos ese evento en el inicio del ciclo de TCA, formación de acetil CoA. Así como vimos en ese caso, necesitamos un grupo de salida estable para que el dióxido de carbono lo deje atrás, pero tampoco parece que tengamos eso aquí, tampoco. Recuerda, lo mejor es tener un anión de carbono estabilizado por resonancia, pero no tenemos uno.

Esta vez, la otra mitad de la reacción podría ser muy útil. Si ese alcohol está encubierto a una cetona, se resuelve el problema de la descarboxilación porque dejaría atrás un anión enolato. El anión enolato está estabilizado por resonancia. Esa situación sería ideal para la descarboxilación.
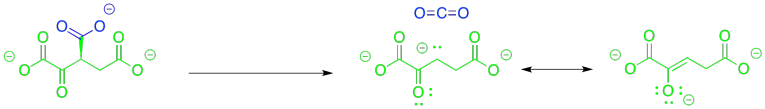
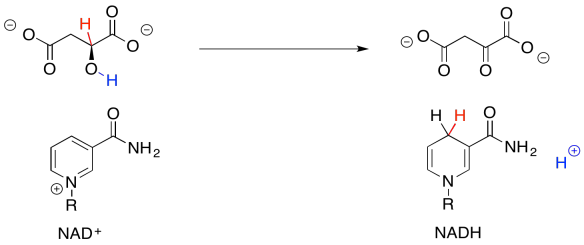
Desde el punto de vista de los tipos de reacciones con las que estás más familiarizado en este punto, la parte más difícil de este paso es pasar del grupo alcohólico a la cetona. Sin embargo, esa es una transformación bastante común y en biología a menudo se logra con el cofactor común, NAD +.

¿Por qué necesitamos este cofactor? Si analizas los cambios en los átomos de una estructura a la siguiente, notarás que la conversión del alcohol en una cetona requiere la pérdida de dos átomos de hidrógeno. Un estudiante principiante a menudo notará ese hecho y quitará los protones de la mejor manera que conozca: como protones.

Eso no va a funcionar. Si solo perdemos dos protones, entonces construimos una carga adicional de 2- en la molécula. Los electrones son muy pequeños, pero son muy importantes, y no sólo desaparecen porque haría las cosas más convenientes. Ahora, hay una clase de cofactores biológicos que se encargarán de este problema. Estos cofactores son oxidantes bioquímicos, y NAD + es un miembro. Puede aceptar dos, y sólo dos, electrones a la vez. Y eso es exactamente lo que necesitamos.
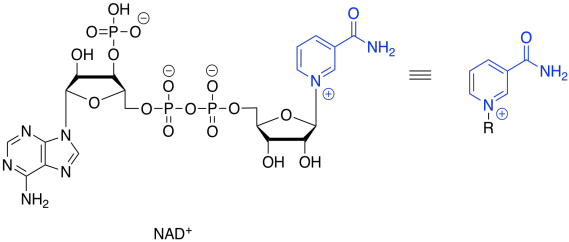
NAD + puede aceptar un par de electrones porque es muy electrofílico. Eso se debe en parte a la carga positiva completa. También contiene un carbonilo atrayente de electrones. Estos dos factores se combinan para hacer de este cofactor un buen electrófilo.
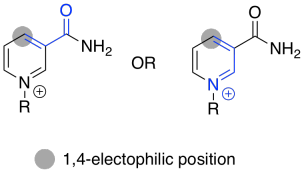
Ejercicio\(\PageIndex{4}\)
Utilizar estructuras de resonancia para confirmar la electrofilicidad de la posición indicada.
Cuando NAD + acepta este par de electrones, se convierte en NADH, un reductor bioquímico. Vale la pena verlo por un momento porque has visto el tipo de reacción que puede lograr el NADH: la entrega de un nucleófilo hidruro (H -) a un electrófilo carbonilo. Eso convertiría una cetona en un alcohol, por ejemplo. Eso es exactamente lo contrario de lo que estamos haciendo aquí. La oxidación del alcohol por NAD + es lo que se llama el “reverso microscópico” de la adición de hidruro, o reducción, de la cetona al alcohol. La reacción sigue el mismo camino, pero en sentido contrario. En lugar de que NADH empuje un ion hidruro sobre un carbonilo electrófilo, el alcohol está empujando un ion hidruro sobre el NAD + electrófilo.

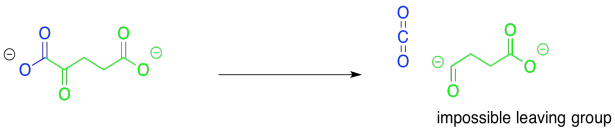
La siguiente etapa del ciclo de TCA es también una etapa de descarboxilación.

Una vez más, la mayor consideración aquí es la presencia de un buen grupo de salida. Esta vez, la reacción se parece muchísimo a ese paso original, la conversión del piruvato en acetil CoA. La descarboxilación proporcionará un anión que se asienta directamente sobre el carbono carbonilo, en lugar de alfa al mismo. De hecho, este problema se resolverá exactamente de la misma manera que en ese primer paso. La ruta implicará la unión temporal de un iluro para estabilizar el anión.
Llegamos ahora al paso de producción de ATP en el ciclo de TCA. En realidad, el ATP no se produce directamente, sino que se acopla a un ciclo GTP-PIB.

Recuerda que el ATP es el éster trifosfato del nucleótido, la adenosina.
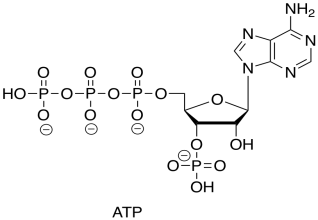
El PIB es solo el éster difosfato de otro nucleótido, la guanosina.
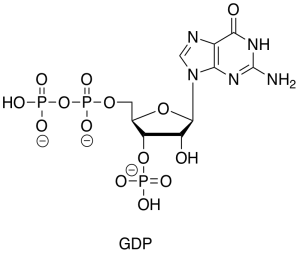
A primera vista, parece que el PIB solo está recogiendo otro grupo fosfato del ion fosfato inorgánico (P i es una taquigrafía bioquímica para el ion fosfato, ya sea que esté presente como PO 4 3-, HPO 4 2-, o H 2 PO 4 -). Por su parte, la coenzima succinilo A parece que simplemente se está hidrolizando: reaccionando directamente con el agua para desplazar al grupo de salida del tiol.
En realidad, el succinilCoA actúa como cebador para el grupo fosfato, activándolo como un fosfoanhídrido más electrófilo. Ese paso facilita que el PIB le done como nucleófilo, lo que lleva a una conexión adicional de fosfato.

El PIB simplemente desplaza un grupo de salida carboxilato del fosfoanhídrido.

En este punto, hemos logrado mucho en términos de los cambios generales en el ciclo de TCA. Se recogió una pieza de dos carbonos en forma de grupo acilo (CH 3 CO). Hemos hecho una molécula de ATP. Hemos descargado esos dos carbonos adicionales como dióxido de carbono y estamos de nuevo en un diácido de cuatro carbonos; casi hemos regenerado el oxaloacetato. Todavía tenemos un par de cosas que hacer para poder completar el ciclo. Necesitamos instalar otro carbonilo en la cadena de cuatro carbonos; es decir, necesitamos agregar un oxígeno, de alguna manera. En el camino, vamos a producir más NADH y FADH 2, que también son importantes para satisfacer las necesidades energéticas de la célula, así como sus requisitos de materia prima sintética.
Para ello, el succinato se convierte primero en fumarato. Eso le va a dar a la molécula una posición electrofílica donde sea necesaria, para permitir la instalación de ese átomo de oxígeno.

Si lo piensas bien, este paso es similar al que has visto antes en esta página. Tenemos que hacer un doble enlace donde antes había un enlace sencillo. Para hacer eso, necesitamos perder dos átomos de hidrógeno.

Perder dos protones parece bastante sencillo; eso es especialmente cierto en este caso, porque cada protón se perdería de una posición alfa. Esas posiciones alfa son siempre tan ligeramente ácidas. Sin embargo, eso no lleva todo el camino al malato, porque todavía tenemos dos electrones extra con los que lidiar.
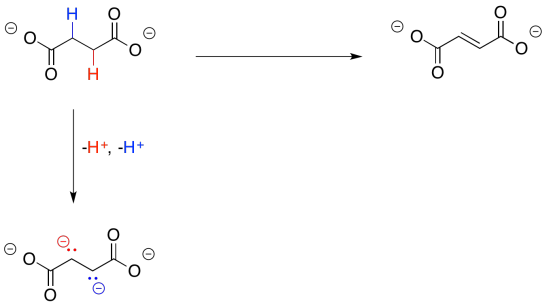
Nuevamente, nos ocupamos antes de este problema. Todo lo que necesitábamos era un oxidante, que aceptara los dos electrones extra. Esta vez, en lugar de NAD +, el proceso hará uso de una molécula de FAD.
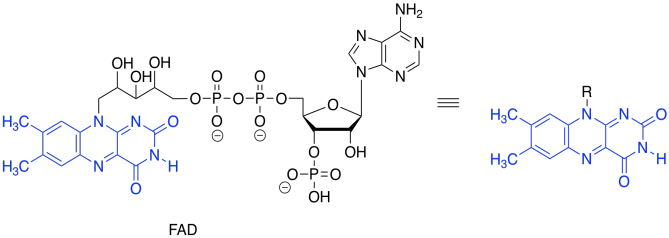
Al igual que la conversión de NAD + a NADH, la transformación de FAD a FADH 2 puede absorber un ion hidruro. Eso es un protón más un par solitario.
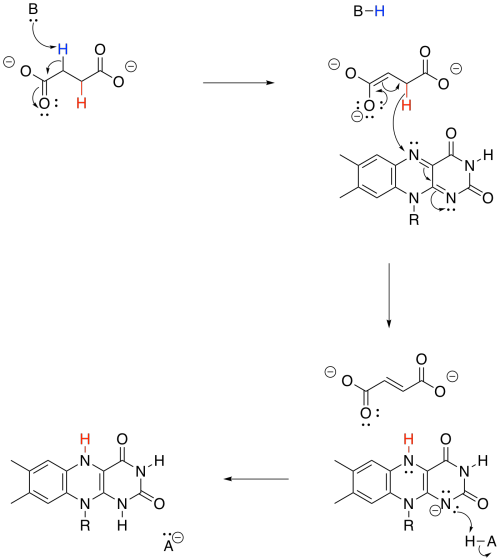
Ejercicio\(\PageIndex{5}\)
En general, el FAD toma tanto un hidruro (H -) como un protón (H +) en este paso. Pensamos en el hidruro como una adición al átomo de nitrógeno junto al benceno. Utilizar estructuras de resonancia para mostrar por qué probablemente ese es el caso.
Ya casi estamos ahí. Ahora, se instala un átomo de oxígeno en forma de grupo OH.

Por supuesto, en este punto parece bastante claro que ese grupo hidroxi solo viene de una 1,4-adición de agua al electrófilo enona del fumarato.

Finalmente, el malato resultante se vuelve a convertir en oxaloacetato, completando el ciclo. Se han visto pasos muy similares a éste, más temprano en el ciclo. En este punto estamos listos para comenzar de nuevo el ciclo.

Ejercicio\(\PageIndex{6}\)
Antes de seguir leyendo, explique el papel del NAD + en el paso final del ciclo de TCA.
Ejercicio\(\PageIndex{7}\)
Las moléculas de malato y oxaloacetato en el dibujo anterior están orientadas en dos direcciones diferentes. Rotar el malato para que se corresponda más estrechamente con la estructura del oxaloacetato.
Entonces, si no podías recordar dónde has visto este tipo de cambio antes, échale un vistazo más de cerca. La conversión de malato en oxaloacetato implica la pérdida de dos átomos de hidrógeno. Eso son dos protones más dos electrones.

Podemos hacer que esto suceda si tenemos un aceptor de electrones. Un oxidante bioquímico, como el NAD+, es un gran candidato. Aceptará un ion hidruro del malato, ayudándolo en su camino al oxaloacetato.
En la siguiente sección, analizaremos más de cerca los mecanismos que siguen estos compuestos a medida que avanzan a través del ciclo de TCA.

