3.4: Mecanismo disociativo y cinética
- Page ID
- 78577
¿Y una reacción disociativa? ¿Depende también de la concentración?
También podríamos cambiar las concentraciones de los dos reactivos, el nuevo ligando y el complejo metálico, en una reacción disociativa. Si lo hiciéramos, encontraríamos una relación lineal entre la concentración de complejo metálico y la velocidad. Si duplicamos la cantidad de complejo metálico, la tasa se duplicaría y así sucesivamente.
Sin embargo, los cambios en la concentración del nuevo ligando tendrían poco efecto sobre la velocidad. Si doblamos la concentración de nuevo ligando, la tasa no cambiaría.
Podemos escribir la siguiente expresión, llamada ley de tarifas, para describir esta relación:
Ley de tarifas:\(Rate = \frac{-d[ML_{n}]}{dt} = k[ML_{n}]\)
Este tipo de reacción a veces se llama reacción de primer orden. Eso significa que la ley de tarifas depende de un solo término de concentración.
¿Por qué el mecanismo disociativo depende de las concentraciones de esta manera específica?
Este es el caso de una molécula perdiendo un ligando. Una vez que lo hace, un segundo ligando puede reemplazar al que dejó. Sin embargo, perder un ligando puede ser más difícil de hacer que ganar uno nuevo. Para perder un ligando, se debe romper un enlace, lo que cuesta energía. Para obtener un nuevo ligando, se hace un enlace, liberando energía. Ese primer paso es más difícil de hacer, por lo que lleva más tiempo. Es un cuello de botella que ralentiza la reacción. Se llama el paso determinante de la tasa.
- El paso determinante de la velocidad es el paso lento de la reacción.
- El paso determinante de la velocidad controla la velocidad de la reacción general; todo lo demás tiene que esperar a que ese paso suceda.
- Una vez que se ha producido el paso determinante de la tasa, todo lo demás sigue muy rápidamente.
Figura\(\PageIndex{1}\): Un cuello de botella en una reacción. Si la reacción debe esperar a que la molécula blanca se disocie, no importa cuántas moléculas negras haya; la reacción sigue siendo igual de lenta. Sin embargo, cuantas más moléculas blancas haya, más frecuentemente podrán reaccionar con las moléculas negras a medida que se produzca la disociación.
No es necesaria ninguna colisión para que el complejo metálico pierda un ligando. En cambio, una unión en el complejo metálico tiene que romperse. Eso solo toma tiempo y energía. En consecuencia, las concentraciones importan muy poco.
Deberíamos pensar un poco más en los requerimientos de energía, la energía disponible y la velocidad de reacción. Se necesita cierta cantidad de energía para romper un vínculo. Durante cualquier período de tiempo dado, una cantidad específica de energía está disponible en los alrededores para su uso. Esa energía no está disponible de manera uniforme. Algunas moléculas obtendrán más energía de su entorno y otras obtendrán menos. Habrá una distribución estadística, como una curva de campana, de la energía disponible en diferentes moléculas. Eso significa que los eventos de ruptura de vínculos se rigen por las estadísticas.

Figura\(\PageIndex{2}\): Relación entre temperatura, energía disponible y barrera energética. La línea negra representa la energía necesaria para iniciar la reacción, también llamada barrera energética o barrera de activación. La curva azul es la distribución de la energía disponible en un grupo de moléculas a una temperatura más fría. La curva amarilla es para un grupo de moléculas que es un poco más cálido, y la curva roja aún más cálida.
En la figura\(\PageIndex{2}\), la mayoría de las moléculas a baja temperatura (azul) no tienen suficiente energía para iniciar la reacción. Una pequeña porción lo hacen, y así la reacción procederá, pero muy lentamente. En la curva amarilla, hay más energía disponible, por lo que una gran fracción de moléculas tiene la energía necesaria para comenzar la reacción. En la curva roja, la gran mayoría tiene suficiente energía para reaccionar. Así, uno de los factores que gobiernan la rapidez con que ocurrirá una reacción es la energía necesaria, o barrera de activación. Un segundo factor es la energía disponible, como lo indica la temperatura.
Por supuesto, aunque haya suficiente energía para la reacción, la reacción podría no ocurrir todavía. La energía es necesaria pero no suficiente para iniciar una reacción. También hay factores estadísticos en cuanto a si una molécula tiene su energía asignada a los lugares correctos, o en algunos casos, si dos moléculas que necesitan reaccionar juntas están orientadas adecuadamente.
Supongamos que a una temperatura dada toma una cantidad específica de tiempo para que la mitad de las moléculas obtengan suficiente energía para que puedan sufrir la reacción. Esa cantidad de tiempo se llama la vida media de la reacción. Después de una vida media, la mitad de las moléculas han reaccionado y la otra mitad permanece. Después de una segunda vida media, la mitad de las moléculas restantes (otra cuarta parte, para tres cuartas partes del material original en total) también han reaccionado, y una cuarta parte aún permanece. Después de una tercera vida media, la mitad de los restantes (otro octavo, haciéndolo siete octavos reaccionaron en total) habrán reaccionado, dejando atrás una octava parte del material original.
- El decaimiento exponencial se basa en una distribución estadística de la disponibilidad de energía.
- El concepto de vida media está relacionado con la decadencia exponencial.
- Se necesita un periodo de tiempo fijo para que la mitad del complejo metálico obtenga suficiente energía para disociarse.
Así, el tiempo que lleva que ocurra la reacción no depende realmente de la concentración de nada.
Sin embargo, el cambio en la concentración a lo largo del tiempo —la cantidad que normalmente podemos medir más fácilmente— depende de la concentración original, y por esa razón la concentración del complejo metálico aparece en la ley de tasas.
Figura\(\PageIndex{3}\): Las reacciones en la fila superior y la fila inferior están procediendo con la misma vida media a medida que nos movemos de izquierda a derecha. Sin embargo, la fila superior comienza más concentrada que la fila inferior. Como resultado, las concentraciones en la fila superior están cambiando más rápidamente que en la fila inferior.
Supongamos que la vida media para un caso particular de sustitución de ligando es de un segundo. Después de una vida media, una solución de 1 M se convierte en 0.5 M, por lo que la tasa de cambio en la concentración por tiempo es de 0.5m/s, pero después de la misma semivida, una solución 0.5 M se convierte en 0.25 M, por lo que el cambio en la concentración es de 0.25 M/s.
Si una reacción de primer orden tiene una vida media de 120 segundos, cuánto del material original queda después
a) ¿cuatro minutos? b) ¿seis minutos? c) ¿ocho minutos? d) ¿diez minutos?
- Responder a
-
4 minutos = 240 segundos = 2 x 120 segundos = 2 vidas medias.
Material restante = 50% x 50% = 0.5 x 0.5 = 0.25 = 25% restante
- Respuesta b
-
6 minutos = 360 segundos = 3 x 120 segundos = 3 vidas medias.
Material restante = 0.5 x 0.5 x 0.5 = 0.125 = 12.5% izquierda
- Respuesta c
-
8 minutos = 480 segundos = 4 x 120 segundos = 4 vidas medias.
Material restante = 0.5 x 0.5 x 0.5 x 0.5 = 0.0625 = 6.25% izquierda
- Respuesta d
-
10 minutos = 600 segundos = 5 x 120 segundos = 5 vidas medias.
Material izquierda = 0.5 x 0.5 x 0.5 x 0.5 x 0.5 = 0.03125 = 3.125% izquierda
Dada la ley de velocidad disociativa anterior, ¿qué pasaría con la velocidad de reacción para la sustitución en cada uno de los siguientes casos?
- la concentración de ligando se duplica y la concentración de complejo metálico se duplica
- la concentración de ligando se triplica y la concentración del complejo metálico se reduce a la mitad
- la concentración de ligando se duplica y la concentración del complejo metálico se triplica
- la concentración de ligando se reduce a la mitad y la concentración de complejo metálico se reduce a la mitad
- Responder a
-
Ley de Tasa Disociativa: Tasa = [ML n], si ML n es el complejo. No hay dependencia de [X], si X es el nuevo ligando.
La tasa se duplicará: Tasa = 2 x [ML n] 0, si [ML n] 0 es la concentración original.
- Respuesta b
-
Tasa se dividirá a la mitad: Tasa = 0.5 x [ML n] 0.
- Respuesta c
-
Tasa se triplicará: Tasa = 3 x [ML n] 0.
- Respuesta d
-
Tasa se dividirá a la mitad: Tasa = 0.5 x [ML n] 0.
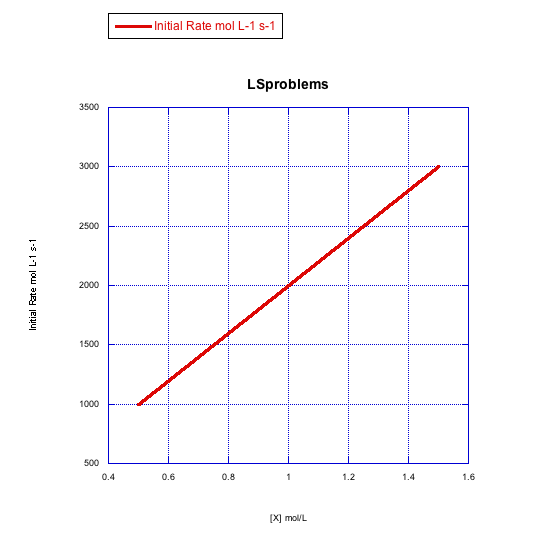
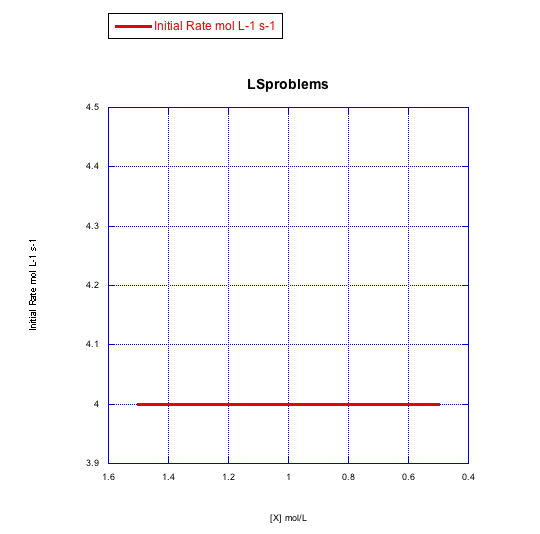
Grafica gráficas de tasa inicial vs concentración para mostrar lo que verías en la sustitución disociativa.
a) La concentración de complejo metálico, [ML n], se mantiene constante en 0.1 mol/L y la concentración de ligando se cambia de 0.5 mol/L a 1 mol/L y luego a 1.5 mol/L.
b) La concentración de nuevo ligando, [X], se mantiene constante a 0.1 mol/L y la concentración de complejo metálico se cambia de 0.5 mol/L a 1 mol/L y luego a 1.5 mol/L
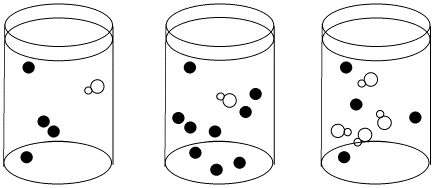
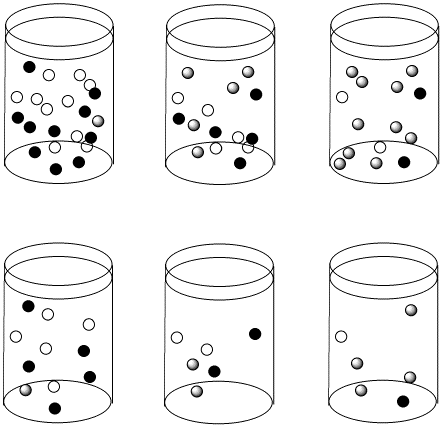
Dados los siguientes conjuntos de datos de velocidad inicial, determinar si cada caso representa una sustitución disociativa. [mLn] = concentración del complejo de coordinación; [X] = concentración del ligando entrante.
a)

b)

Responder a-
La velocidad aumenta tanto con la concentración de complejo metálico como con el ligando entrante. Esto parece un mecanismo asociativo.
- Respuesta b
-
La velocidad depende de la concentración del complejo metálico, pero no del ligando entrante. Esto parece un mecanismo disociativo.
- Respuesta c
-
La velocidad depende de la concentración de ligando entrante, pero no del complejo metálico. Sea lo que sea que esté pasando aquí, no es un simple mecanismo disociativo.
En los siguientes datos, la concentración del complejo metálico y el ligando entrante se mantuvieron constantes, pero se añadió más del ligando de salida a la solución.

a) Explicar lo que dicen los datos sobre la dependencia de la tasa de esta concentración.
b) Explicar esta dependencia de la tasa en términos de la reacción.
- Responder a
-
La velocidad de la reacción se reduce cuando se incrementa la concentración del ligando saliente.
- Respuesta b
-
Esta dependencia podría indicar un equilibrio en el paso disociativo. Cuanto más ligando saliente se agrega, más se empuja el equilibrio hacia el complejo metálico original. Con menos complejo metálico disociado alrededor, el ligando entrante no puede formar el nuevo complejo tan rápido.
En ciertos disolventes, como THF, acetonitrilo y piridina, la ley de velocidad para la sustitución a menudo parece ser Tasa = k 1 [ML n] + k 2 [ML n] [X], en la que X es el ligando entrante y ML n es el complejo metálico.
a) ¿Qué tienen en común estos disolventes?
b) ¿Cuál es una posible explicación de esta ley tarifaria?
c) Se ha demostrado que esta ley tarifaria es congruente con un mecanismo enteramente asociativo. ¿Cómo es eso posible?
- Responder a
-
Todos estos disolventes tienen pares solitarios. Podrían ser bases de Lewis o nucleófilos.
- Respuesta b
-
Parece dos mecanismos competidores. A término sugiere un mecanismo disociativo, mientras que el otro término sugiere un mecanismo disociativo. Podrían estar sucediendo en competencia entre ellos.
- Respuesta c
-
Por otro lado, podría ser que haya un mecanismo con dos nucleófilos diferentes. Si el ligando entrante es el nucleófilo, el término de la derecha aparece en la ley de tasas. Si el solvente es el nucleófilo, formando un tercer complejo, el término de la izquierda aparece en la ley de tasas. Eso es porque normalmente cambiaríamos la cantidad de complejo metálico y la cantidad de ligando que agregamos a la solución para determinar la ley de velocidad, pero normalmente no podríamos cambiar la concentración del disolvente, por lo que sería una constante. (¿Cómo pudo confirmar esta explicación en un experimento?)

