3.3: Mecanismo asociativo y cinética
- Page ID
- 78622
Podemos medir la velocidad de una reacción asociativa y hacer cambios en las condiciones de reacción para ver cómo se ve afectada la velocidad. Por ejemplo, podríamos cambiar fácilmente las concentraciones de los dos reactivos. Todo lo que tenemos que hacer es cambiar la cantidad de reactivo que disolvemos en la solución.
Si lo hiciéramos, encontraríamos una relación lineal entre cada concentración y tasa. Si duplicamos la concentración de nuevo ligando, la velocidad de reacción se duplica. Si lo triplicamos, la tasa se triplica.
Además, si duplicamos la cantidad de complejo metálico, la tasa se duplica y así sucesivamente.
Podemos escribir la siguiente expresión, llamada ley de tarifas, para describir esta relación:
Ley de tarifas:\(Rate = \frac{-d[ML_{n}]}{dt} = k[ML_{n}][L^{'}]\)
Este tipo de reacción a veces se denomina reacción de segundo orden. Ese término solo se refiere a la forma matemática de la ley de tasas, que depende de los tiempos de concentración concentración, o concentración al cuadrado. El “orden” de la reacción es el número de concentraciones multiplicadas juntas en la ley de tasas.
¿Por qué el mecanismo asociativo depende de las concentraciones de esta manera específica?
Este es un caso de dos moléculas que se unen. Si ambos compuestos se disuelven en solución, deben “nadar” o viajar a través de la solución hasta que choquen entre sí y reaccionen. Cuanto más concentrada esté la solución, o cuanto más abarrotada esté de moléculas, más probabilidades hay de que los reactivos choquen entre sí. Si duplicamos la cantidad de nuevo ligando en solución, un encuentro entre ligando y complejo se vuelve el doble de probable. Si duplicamos la cantidad de complejo metálico en solución, un encuentro también se vuelve el doble de probabilidades.

Figura\(\PageIndex{1}\): The effect of concentration on collision probability. In the first beaker, there is a chance that a black molecule and white molecule will meet and react together. The chance of a meeting is much higher in both the second beaker, where there are lots more black molecules, and in the third beaker, where there are many more white molecules.
Given the associative rate law above, what would happen to the reaction rate for an associative substitution in the following cases?
- the concentration of ligand is doubled, and the concentration of metal complex is doubled
- the concentration of ligand is tripled, and the concentration of metal complex is doubled
- the concentration of ligand is tripled, and the concentration of metal complex is tripled
- the concentration of ligand is halved, and the concentration of metal complex is doubled
- Answer a
-
Associative Rate Law: \(Rate = [ML_{n}][X]\), if MLn is the complex and X is the new ligand.
Rate will quadruple: \(Rate = (2 \times [ML_{n}]_{0}) \times (2 \times [X]_{0})= 4 \times [ML_{n}]_{0}[X]_{0}\), if [X]0 and [MLn]0 are the original concentrations.
- Answer b
-
Rate will sextuple: \(Rate = (3 \times [ML_{n}]_{0}) \times (2 \times [X]_{0}) = 6 \times [ML_{n}]_{0}[X]_{0}\).
- Answer c
-
Rate will nonuple: \(Rate = (3 \times [ML_{n}]_{0}) \times (3 \times [X]_{0}) = 9 \times [ML_{n}]_{0}[X]_{0}\).
- Answer d
-
Rate will stay the same: \(Rate = (0.5 \times [ML_{n}]_{0}) \times (2 \times [X]_{0}) = 1 \times [ML_{n}]_{0}[X]_{0}\).
Plot graphs of initial rate vs. concentration to show what you would see in associative substitution.
a) The concentration of new ligand, [X], is held constant at 0.1 mol/L and the concentration of metal complex is changed from 0.5 mol/L to 1 mol/L and then to 1.5 mol/L.
b) The concentration of metal complex, [MLn], is held constant at 0.1 mol/L and the concentration of ligand is changed from 0.5 mol/L to 1 mol/L and then to 1.5 mol/L.
- Answer
-
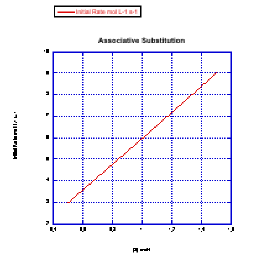
En el problema anterior, el experimento se realizó de una manera particular por razones particulares.
a) ¿Por qué se mantuvo constante una concentración mientras que la otra fue cambiada? ¿Por qué no cambiar ambos?
b) ¿Por qué la gráfica informa la “tasa inicial”, solo la tasa al comienzo de la reacción?
- Contestar a
-
Cambiar ambas concentraciones a la vez dejaría algunas dudas sobre si una concentración había afectado la tasa, o la otra concentración, o ambas. En la práctica, una concentración generalmente se mantiene constante mientras que la otra se mantiene en exceso y es variada.
- Respuesta b
-
La tasa cambia a lo largo del tiempo debido a que las concentraciones de reactivos cambian a medida que se consumen. Al informar solo la tasa inicial (generalmente significa menos del 5% o 10% completo, pero posiblemente incluso menos que eso si se pueden recopilar muchos datos muy rápidamente), las concentraciones siguen siendo sobre lo que empezaste. Eso significa que puedes reportar una tasa que corresponda a una concentración dada con confianza.
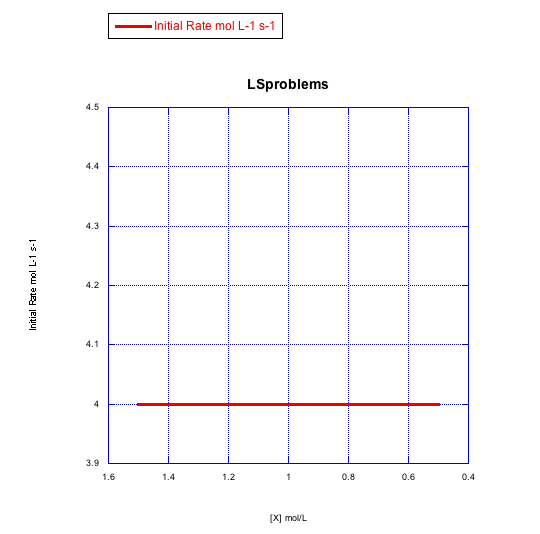
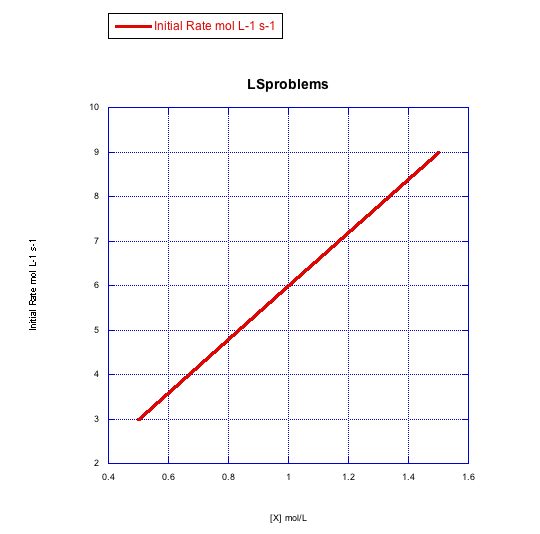
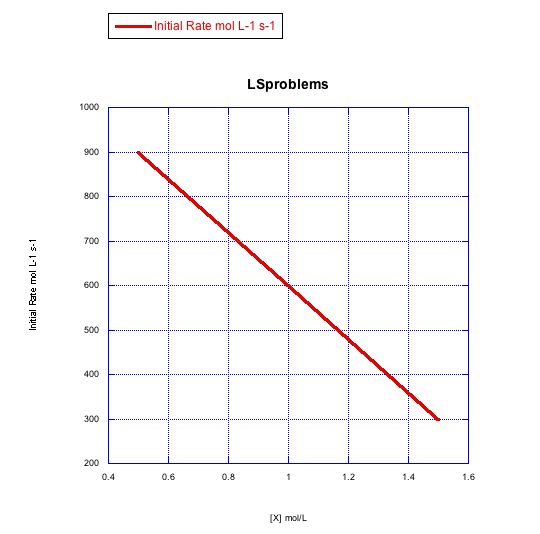
Dados los siguientes conjuntos de datos de velocidad inicial (velocidades medidas al inicio de una reacción), determinar si cada caso representa una sustitución asociativa.
a)
b)
c)
d)
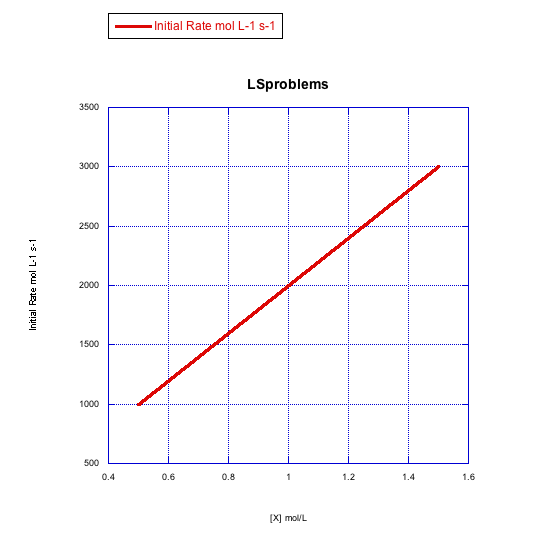
Contestar a-
La tasa cambiaría con la concentración de ligando si es asociativa. Esta velocidad es constante en un rango de concentraciones de ligando, por lo que la reacción no es asociativa.
- Respuesta b
-
La tasa aumenta linealmente con la concentración de ligando. Esta reacción procede a través de un mecanismo asociativo.
- Respuesta c
-
La tasa cambia a lo largo del rango de concentración, pero disminuye. Esto es lo contrario de lo que debería suceder. Esta reacción no sigue un simple camino asociativo.
- Respuesta d
-
La tasa aumenta linealmente con la concentración de ligando. Esta reacción procede a través de un mecanismo asociativo.
Qué información se puede obtener de las pendientes de líneas en Ejercicio\(\PageIndex{4}\) (Problem LS3.4.)?
- Contestar
-
Porque\(Rate = k[ML_{n}][L]\) is held constant while [L] is varied, then the slope of the line is k [MLn]. Since you would know the value of [MLn], you could obtain the rate constant from the quantity (slope/ [MLn]).

