4.20: Soluciones a problemas seleccionados
- Page ID
- 78826
Ejercicio 4.1.1:
Ejercicio 4.1.2:
Ejercicio 4.1.3:
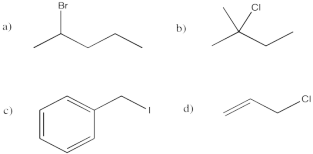
Ejercicio 4.2.1:
La electronegatividad del carbono (2.55 en la escala Pauling) es menor que la del flúor (3.98), cloro (3.16), bromo (2.96) o yodo (2.66).
- Sobre esa base, el carbono unido a un halógeno es electrófilo porque tiene una carga positiva parcial resultante del enlace polar carbono-halógeno.
- Esperaríamos que un fluoruro de alquilo sea el más electrófilo de estos compuestos, basado en la electronegatividad.
- Suponiendo que la energía requerida para romper el enlace carbono-halógeno juega un papel importante en la barrera de activación (no garantizada), esperaríamos que la barrera de activación sea la más baja con el yoduro de alquilo, luego el bromuro de alquilo, luego el cloruro de alquilo y finalmente el fluoruro de alquilo. Esta predicción contrasta con lo que podríamos esperar basado en la electronegatividad.
- La estabilidad de los fluoruros de alquilo frente a estas reacciones sugiere que existe, de hecho, un papel destacado desempeñado por las fuerzas de enlace, al menos en ese caso. El enlace carbono-fluoruro es lo suficientemente fuerte como para impedir la sustitución nucleofílica en este compuesto.
Ejercicio 4.2.2:
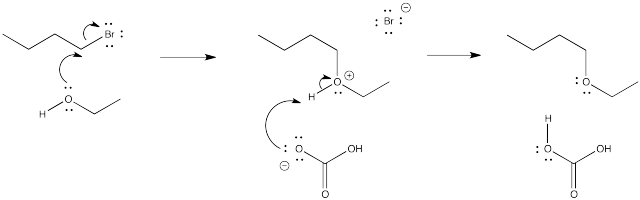
- En el mecanismo B, el disociativo, esperaríamos una mayor entalpía de activación. El primer paso, que parece ser la determinación de la tasa, es un paso de ruptura de enlaces, que costará energía. En el mecanismo C, la ruptura del enlace es compensada por alguna formación de enlaces; en general, esto probablemente cuesta menos energía.
- En el mecanismo B, el caso disociativo, se espera una entropía de activación más positiva. A medida que el enlace al haluro comienza a romperse, los fragmentos de haluro y carbocatión comienzan a moverse independientemente entre sí, ganando grados de libertad y aumentando en entropía. En el mecanismo C, el nucleófilo entrante parece coordinar su movimiento con el del haluro que sale; como resultado, hay menos grados de libertad en este caso.
Ejercicio 4.2.3:
- Los intermedios cargados están presentes en el mecanismo disociativo (B).
- Parece que un disolvente más polar favorecería ambos mecanismos, ya que ambos implican la interacción de un nucleófilo aniónico con un electrófilo y la pérdida de un grupo saliente aniónico. Sin embargo, el caso disociativo (B) implica una acumulación de carga en el intermedio. Es posible que un disolvente más epolar pueda reducir la barrera a esa acumulación de separación de carga, acelerando este mecanismo.
Ejercicio 4.2.4:
- El paso determinante de la tasa es probablemente el de romper el vínculo (el primero).
- Porque el nucleófilo aún no ha participado en ese punto,\(Rate = k [R-X]\), si R-X = el haluro de alquilo.
- Solo hay un paso; es el paso determinante de la tasa, por defecto.
- \(Rate = k [R-X][Nu]\).
Ejercicio 4.4.1:

Ejercicio 4.4.2:

Ejercicio 4.4.3:
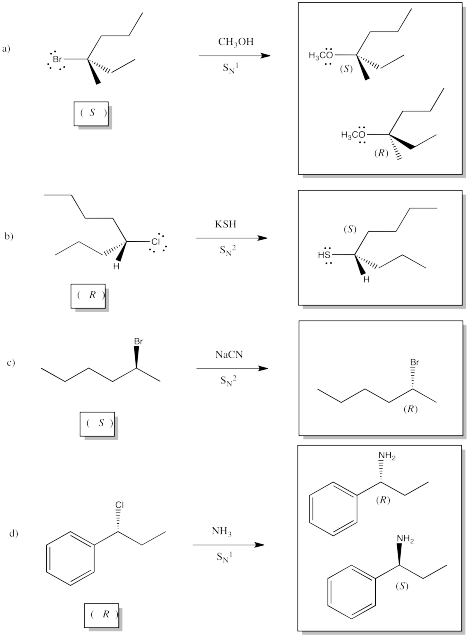
Ejercicio 4.5.1:
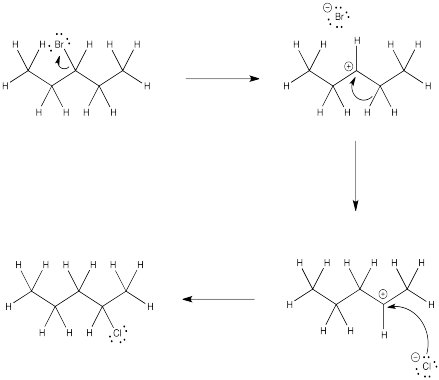
Ejercicio 4.5.3:
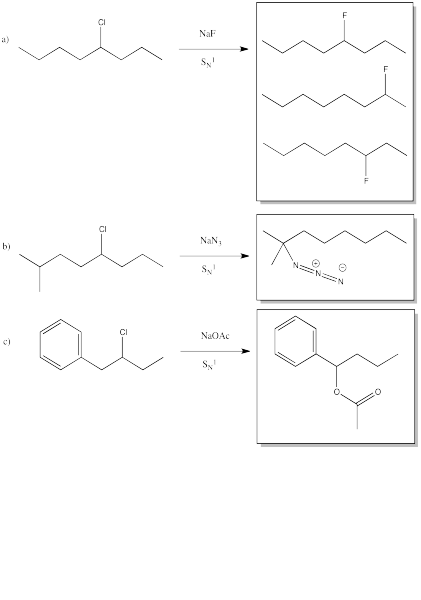
Ejercicio 4.6.1:
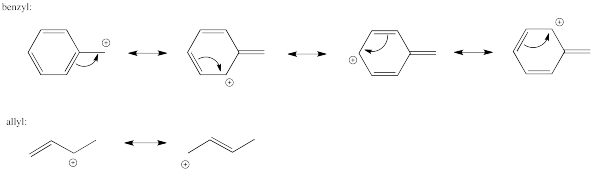
Ejercicio 4.6.2:
Tenga en cuenta que hay otros factores que pueden influir en la vía de reacción; lo que tenemos aquí son solo los mecanismos más probables.
a) S N 2 b) Ambas vías son muy posibles c) Ambas vías son muy posibles d) S N 2
e) S N 2 f) S N 2 g) S N 1 h) S N 1 i) S N 1 j) S N 1
Ejercicio 4.7.1:
- etanol, isopropanol, ácido trifluoroacético
- hexano, tolueno
- THF, acetonitrilo, DMF, diclorometano, éter, DMSO, trietilamina, piridina
- DMSO > DMF > ACN > piridina > DCM > THF > éter > TEA, basado en constantes dieléctricas. En general, los que tienen múltiples enlaces entre dos átomos diferentes son los más polares.
- piridina y trietilamina. El par solitario en el átomo de nitrógeno es básico hacia los protones. La tendencia en basicidad es trietilamina > piridina >> acetonitrilo; a medida que aumenta el carácter porcentual s en el par solitario, los electrones son menores en energía y menos disponibles para la donación.
Ejercicio 4.8.3:
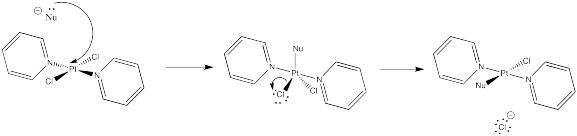
Ejercicio 4.9.1:
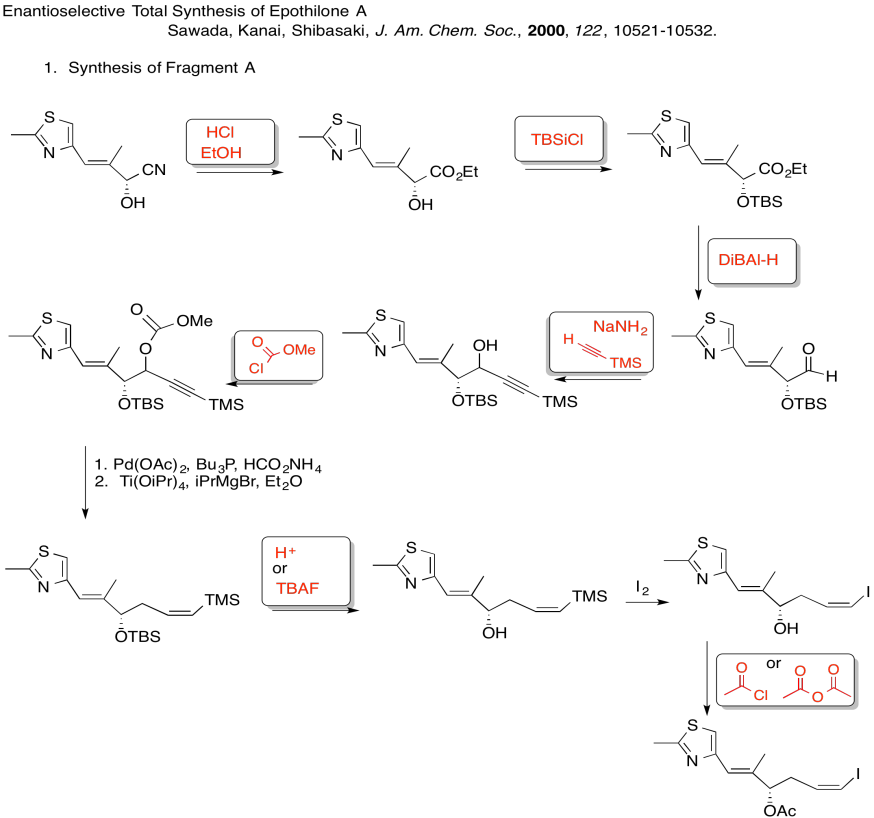
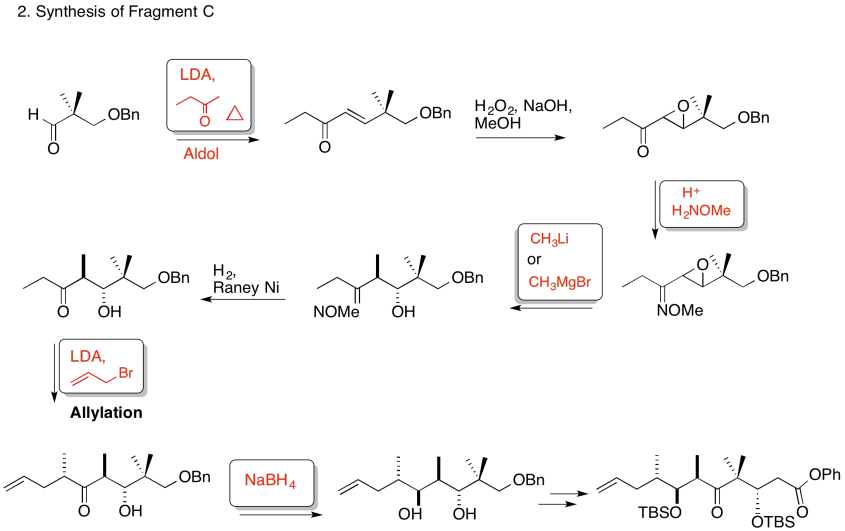
3. Cinético — para desprotonar completamente (no equilibrar o perder estereocontrol) y para el control de quelación.
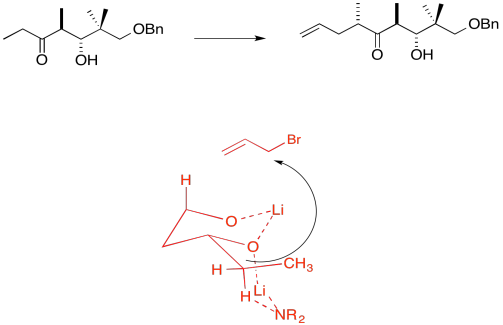
Debido a los efectos de quelación mostrados anteriormente, el LDA elimina preferentemente un hidrógeno para formar solo el Z-enolato que luego hará el SN2 al bromuro de alilo en una sola cara.

Ejercicio 4.10.1:
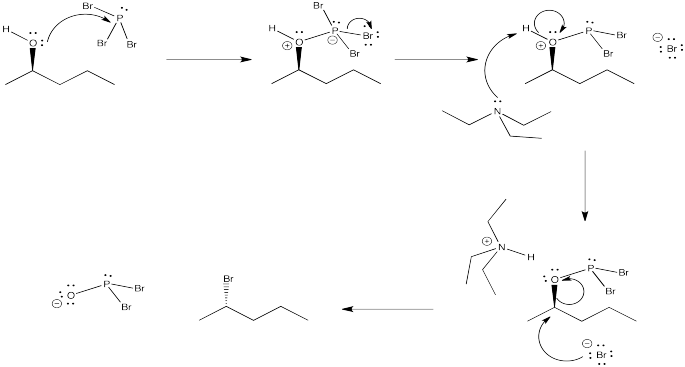
Ejercicio 4.10.2:
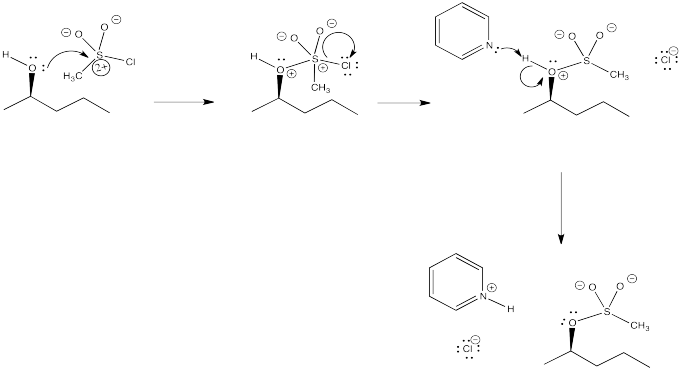
Ejercicio 4.10.3:
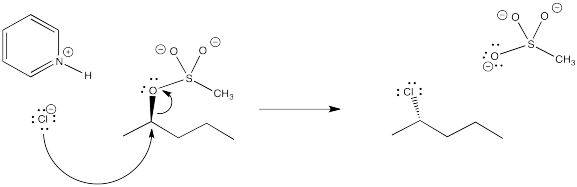
Ejercicio 4.10.4:
Ejercicio 4.10.5:
Ejercicio 4.10.6:

DEAD actúa como agente oxidante para convertir el producto de fósforo en un producto secundario estable, óxido de trifenilfosfina, Ph 3 P=O.
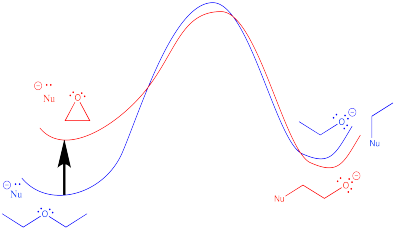
Ejercicio 4.11.1:
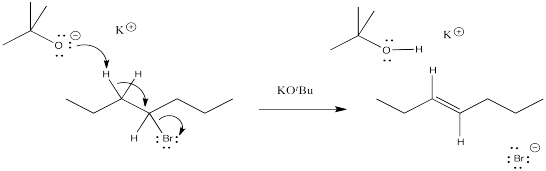
Ejercicio 4.12.1:
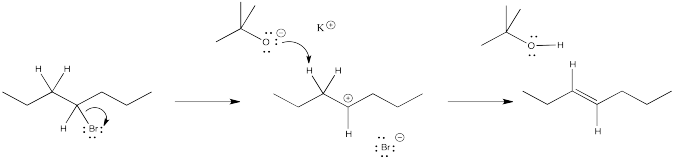
Ejercicio 4.12.2:
Ejercicio 4.12.3:
- productos de reordenamiento de cationes mediante desplazamientos de hidruro: 2-hepteno en lugar de 3-hepteno.
- La ausencia de reordenamiento sugiere la ausencia de cationes. El mecanismo para la reacción mostrada debe ser concertado en lugar de a través del intermedio iónico.
Ejercicio 4.12.4:
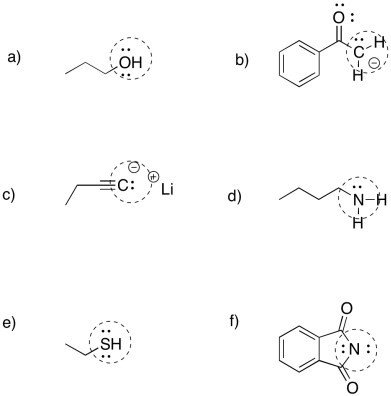
a) muy fuerte b) fuerte c) débil (resonancia) d) muy fuerte e) débil (neutro)
f) débil (polarizable) g) débil (resonancia) h) muy fuerte i) débil (polarizable) j) débil (neutro)
k) medio-débil (anión C pero sp) l) débil (neutro) m) débil (resonancia) n) débil (polarizable) o) fuerte
p) débil (anión O pero deslocalizado) q) débil (polarizable) r) muy fuerte s) débil (polarizable) t) fuerte
Ejercicio 4.13.1:
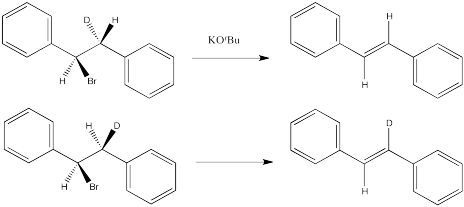
Ejercicio 4.13.2:

Ejercicio 4.14.3:
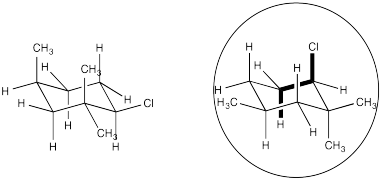
Ejercicio 4.14.4:
Ejercicio 4.14.5:

Ejercicio 4.14.6:
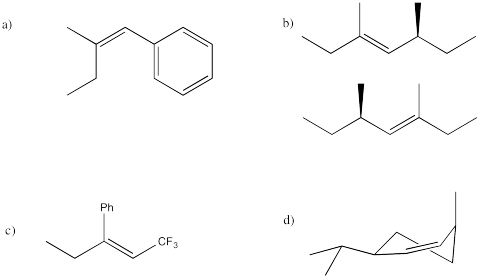
Ejercicio 4.14.7:

Ejercicio 4.15.1:
La estabilidad de los cationes es importante en una reacción de E1.
Ejercicio 4.15.2:
Cualquier haluro de alquilo terciario sería un buen ejemplo. Los haluros de alquilo bencílico también serían buenos ejemplos si son secundarios o terciarios.
Ejercicio 4.15.3:
Los solventes próticos podrían promover reacciones E1.
Ejercicio 4.15.4:
Una base fuerte podría promover una reacción de E2.
Ejercicio 4.15.5:

Ejercicio 4.16.1:
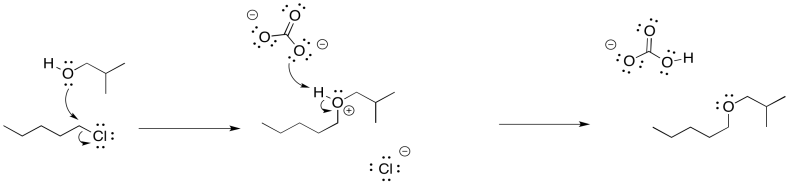
Ejercicio 4.16.2:
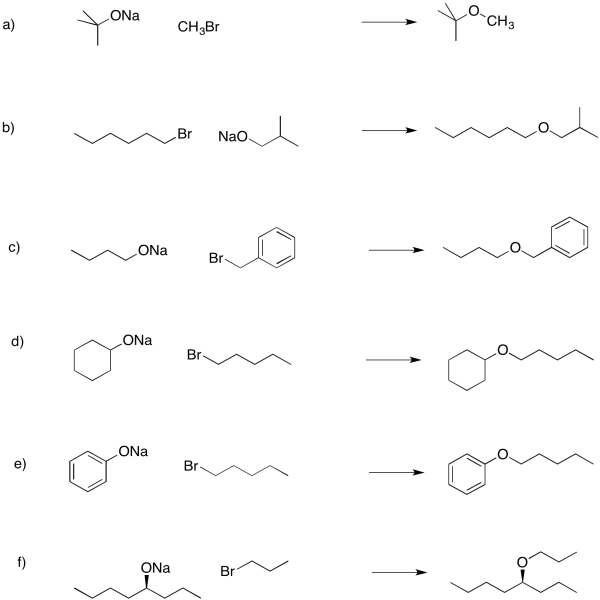
Ejercicio 4.16.3:
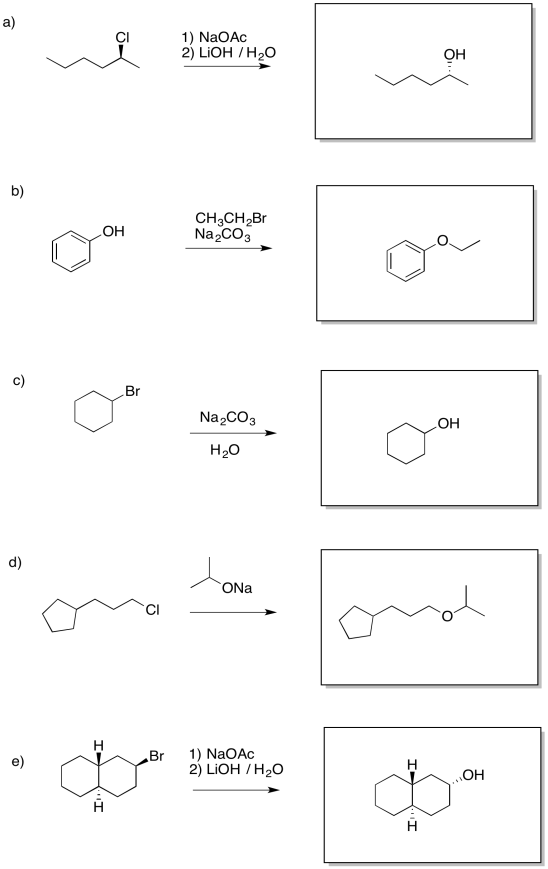
Ejercicio 4.17.1:
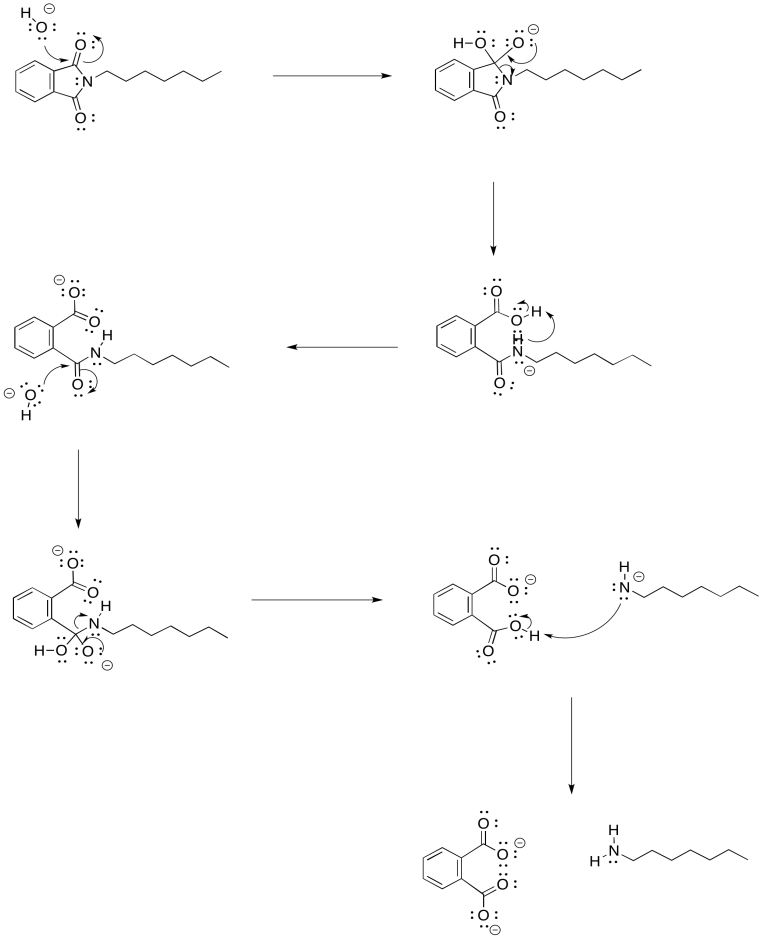
Ejercicio 4.17.2:
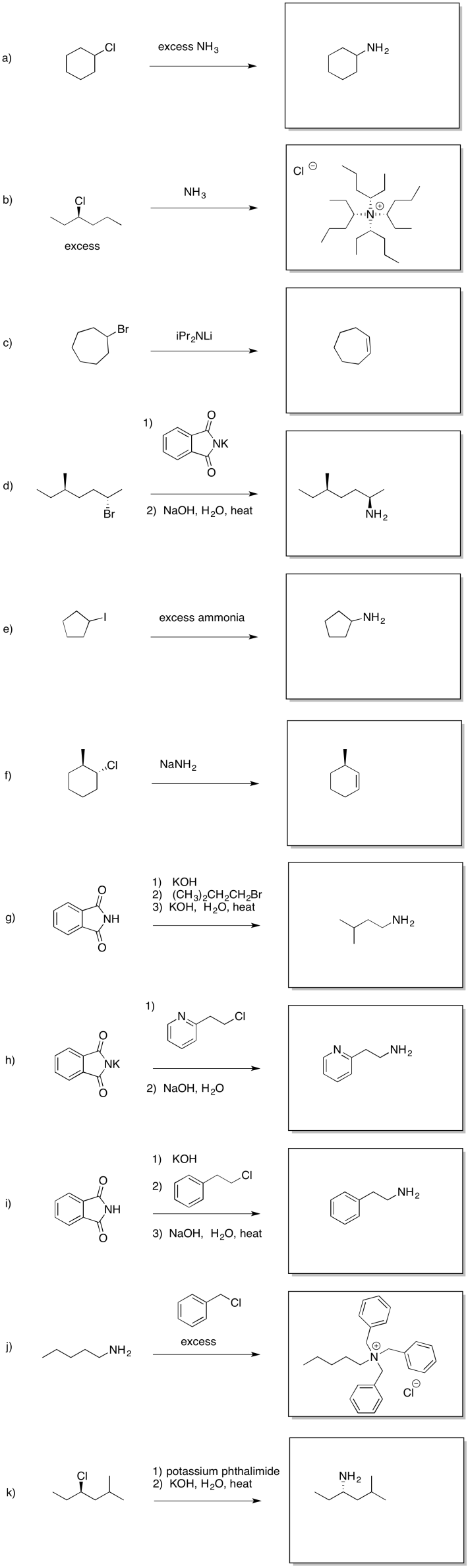
Ejercicio 4.17.3:
- 2 HO - 1 HS - 3 H 2 O; los aniones son más nucleofílicos que los neutros, pero el azufre es más polarizable que el oxígeno
- 2 H 2 O 3 H 3 O + 1 NH 3; los neutrales son más nucleofílicos que el catión, pero el nitrógeno es menos electronegativo que el oxígeno
- 1 CH 3 CH 2 NH 2 2 (CH 3) 2 CHNH 2 3 (CH 3) 3 CNH 2; efectos estéricos
Ejercicio 4.17.4:
a)
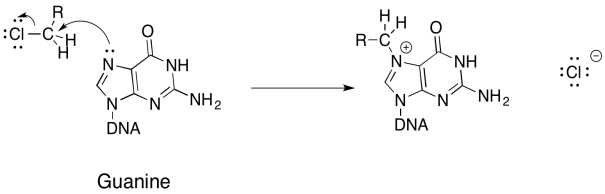
b)
c) La deformación del anillo favorece la apertura del anillo.
Ejercicio 4.18.1:
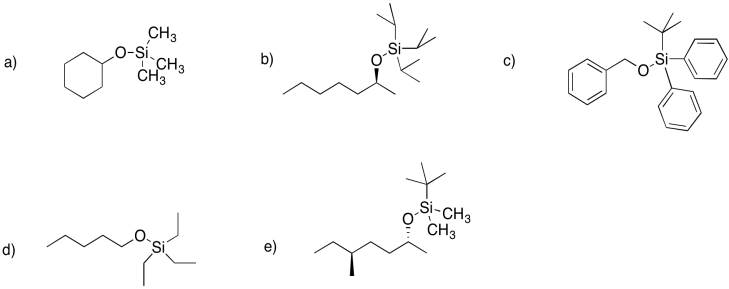
Ejercicio 4.18.2:
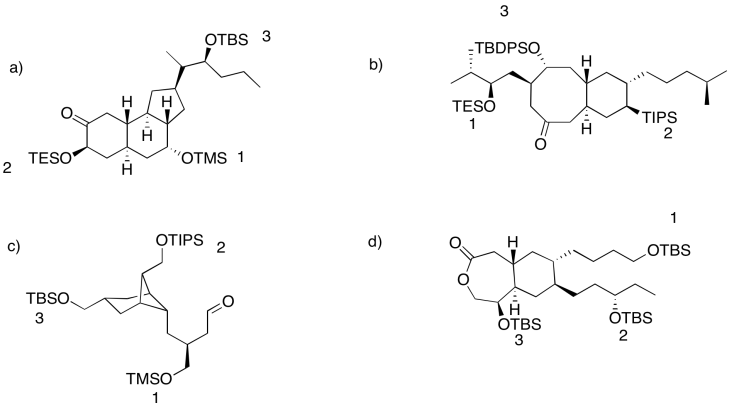
Ejercicio 4.18.3:
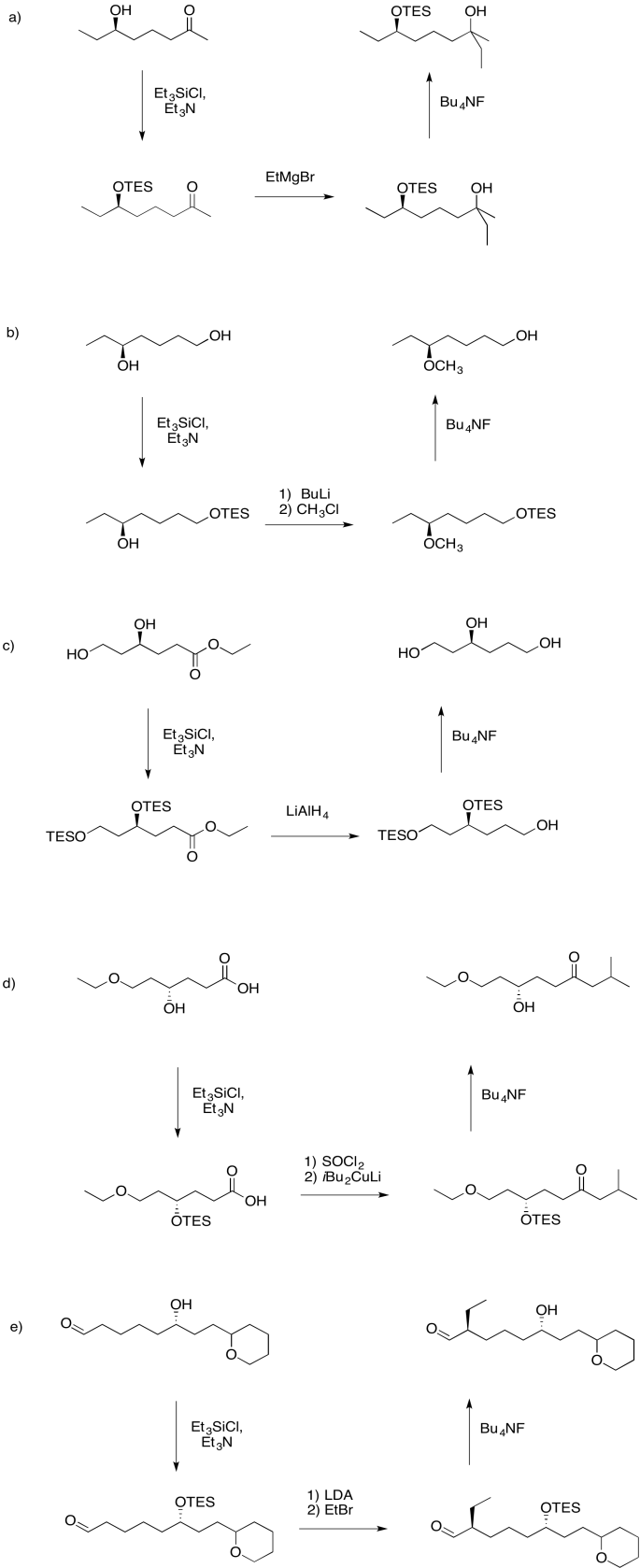
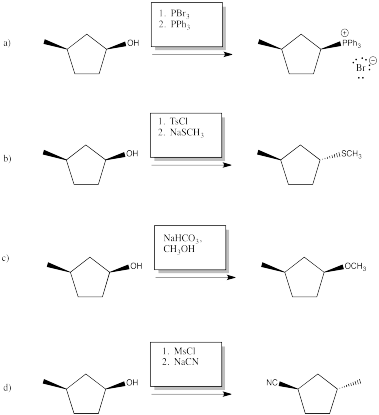
Ejercicio 4.19.1:
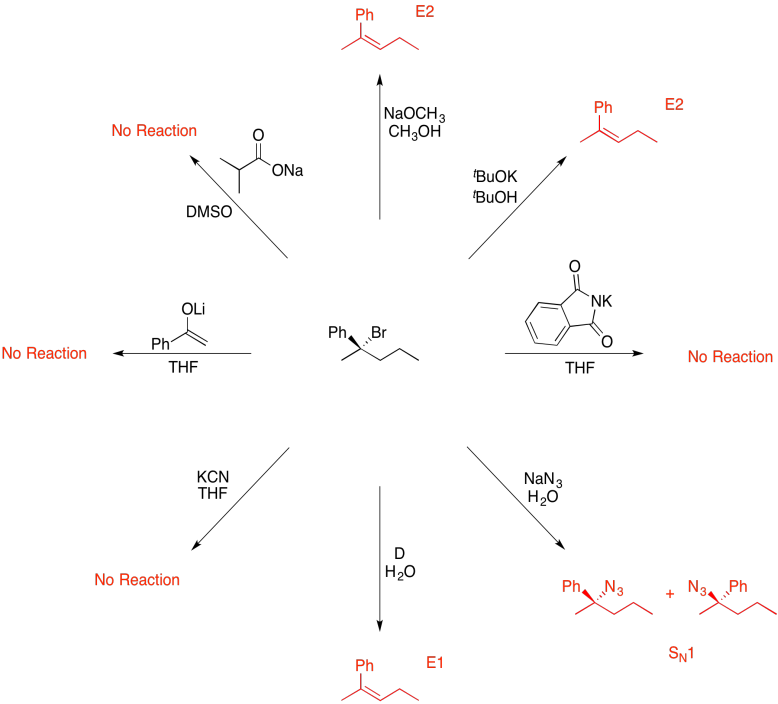
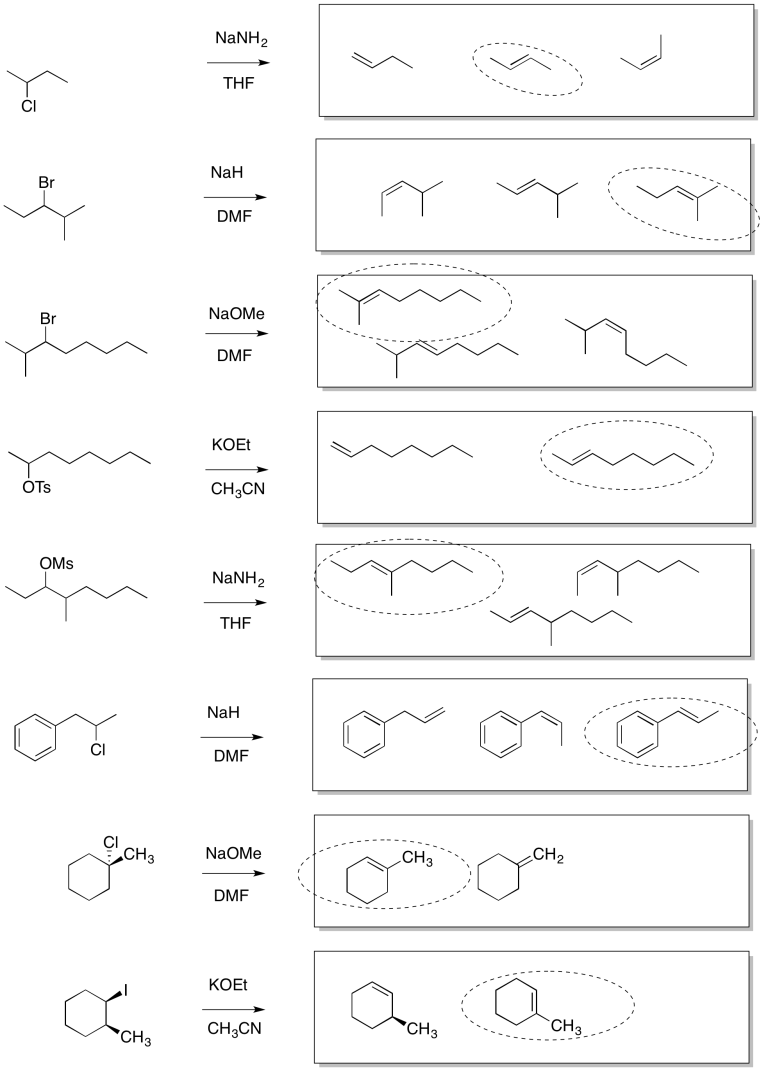
Las respuestas pueden suponer un tratamiento acuoso después de los reactivos mostrados. Solo se muestra una respuesta por caja; respuestas similares también pueden funcionar.
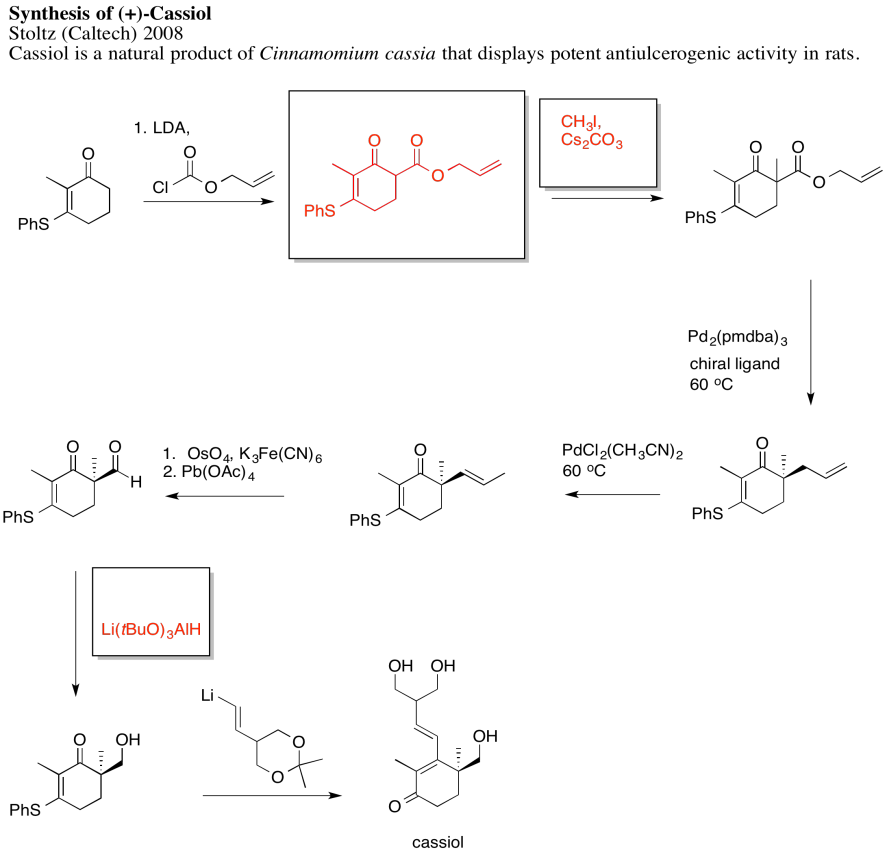
Las respuestas pueden suponer un tratamiento acuoso después de los reactivos mostrados. Solo se muestra una respuesta por caja; respuestas similares también pueden funcionar.

Ejercicio 4.19.3:
Las respuestas pueden suponer un tratamiento acuoso después de los reactivos mostrados. Solo se muestra una respuesta por caja; respuestas similares también pueden funcionar.
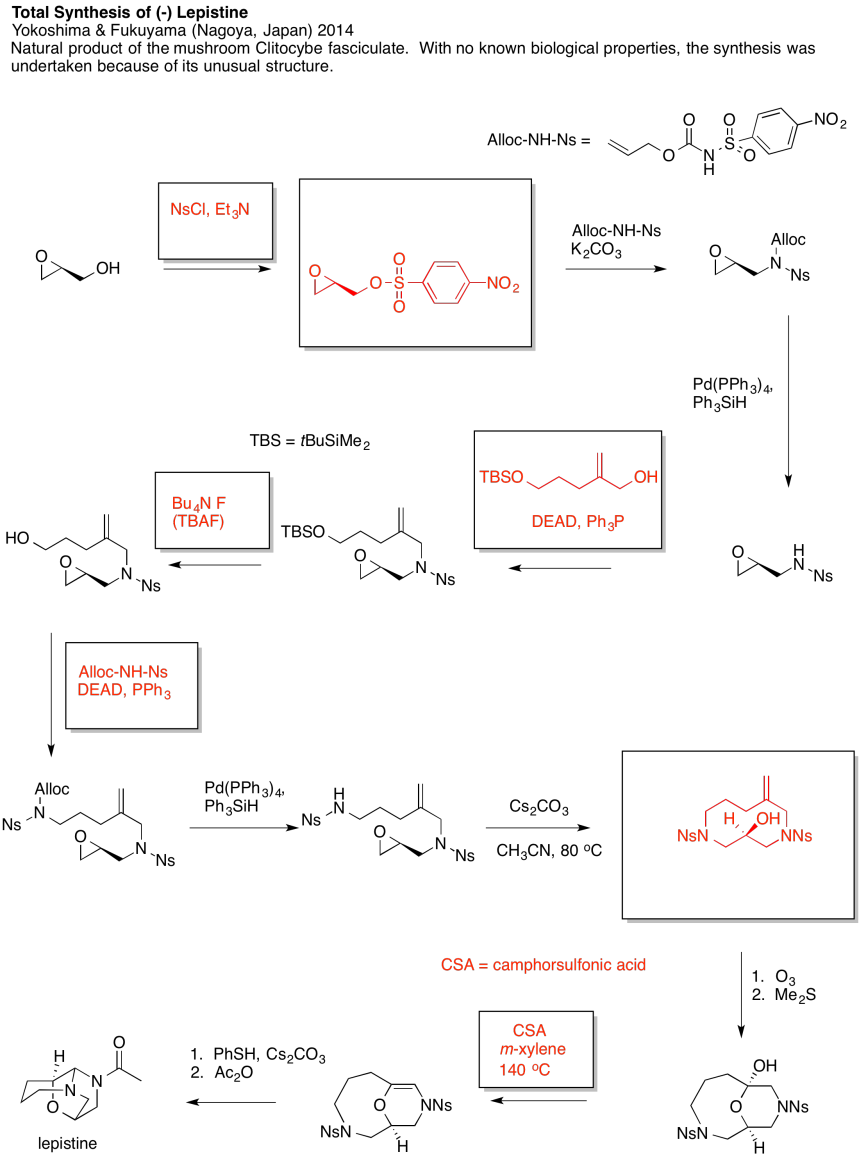
Ejercicio 4.19.4:
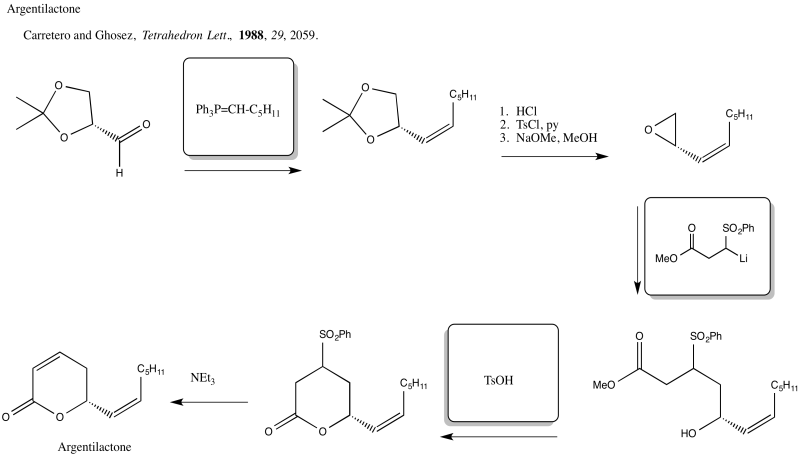
Ejercicio 4.19.5:
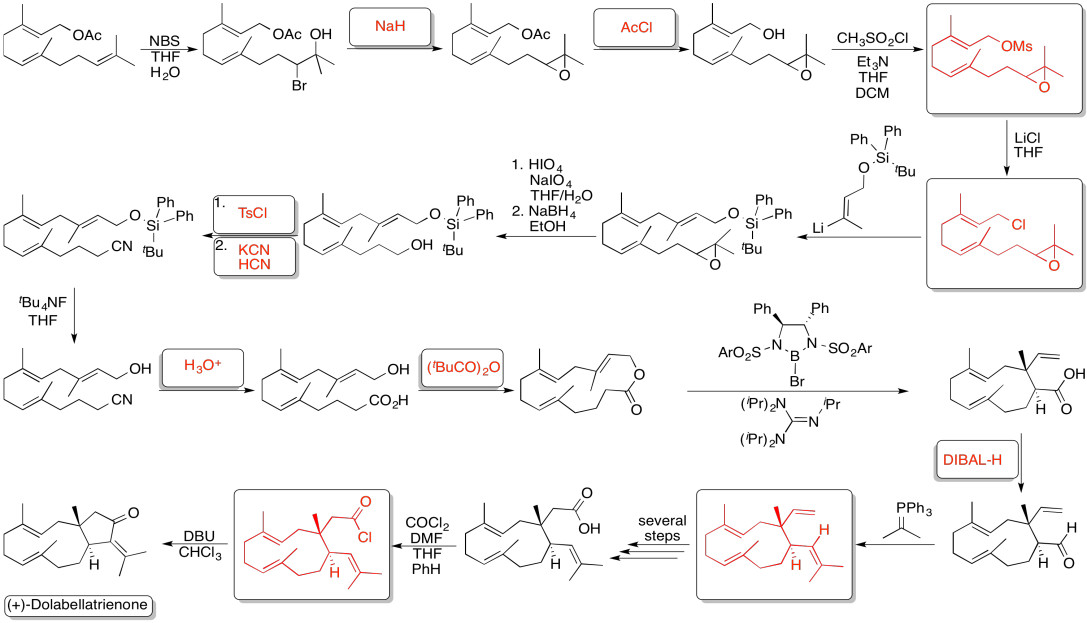
Ejercicio 4.19.6:
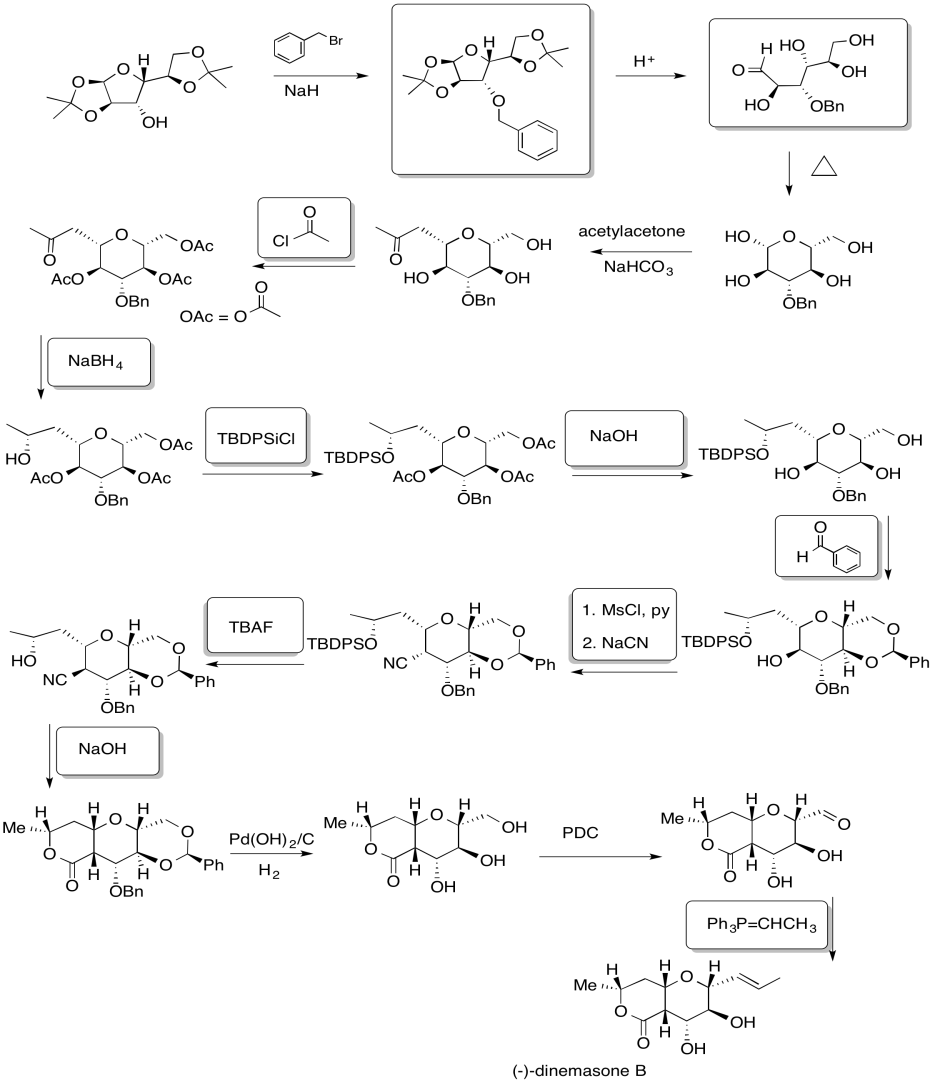
Ejercicio 4.19.7:
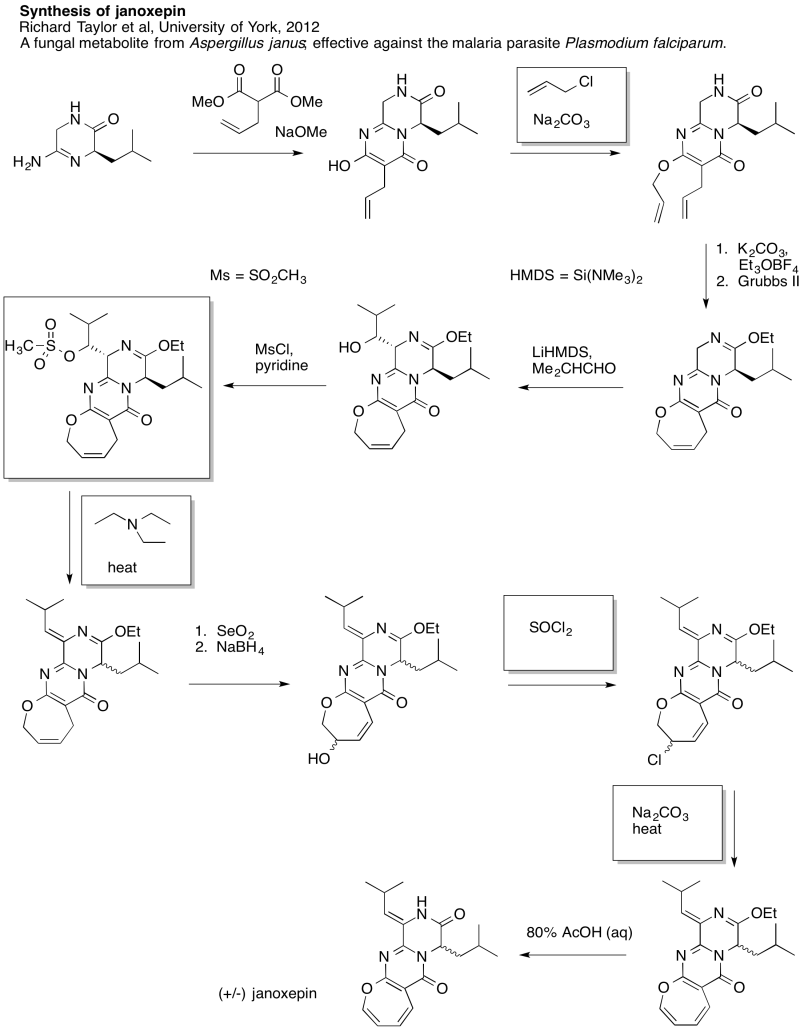
Ejercicio 4.19.8:
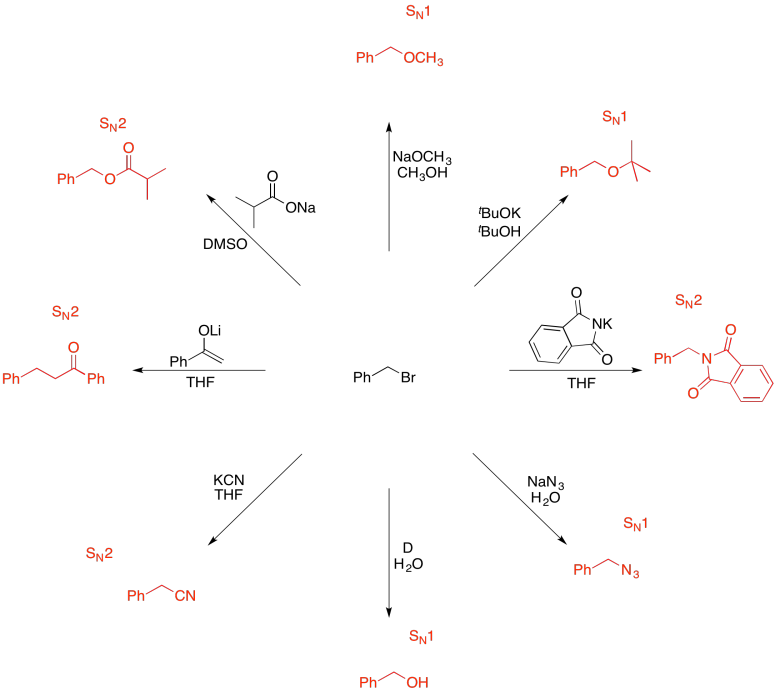
Ejercicio 4.19.9:
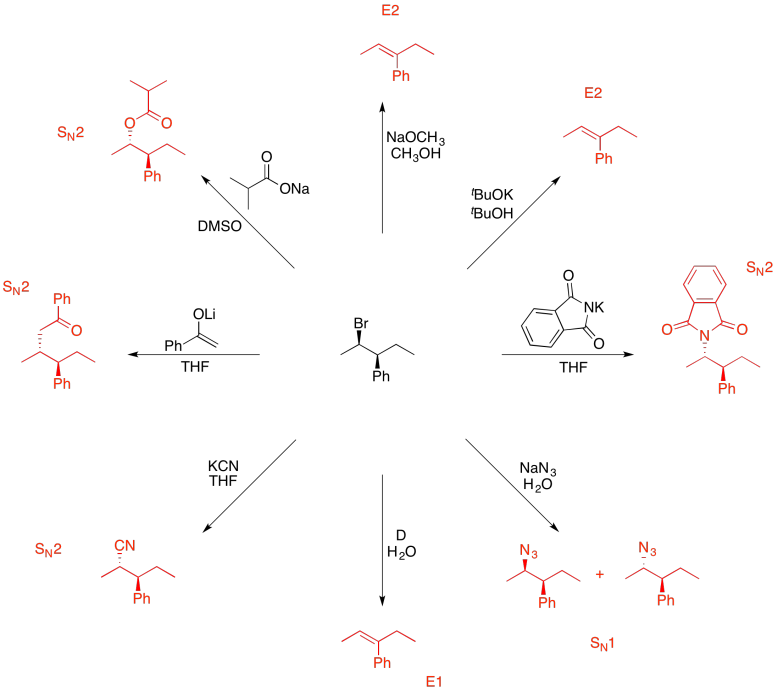
Ejercicio 4.19.10:
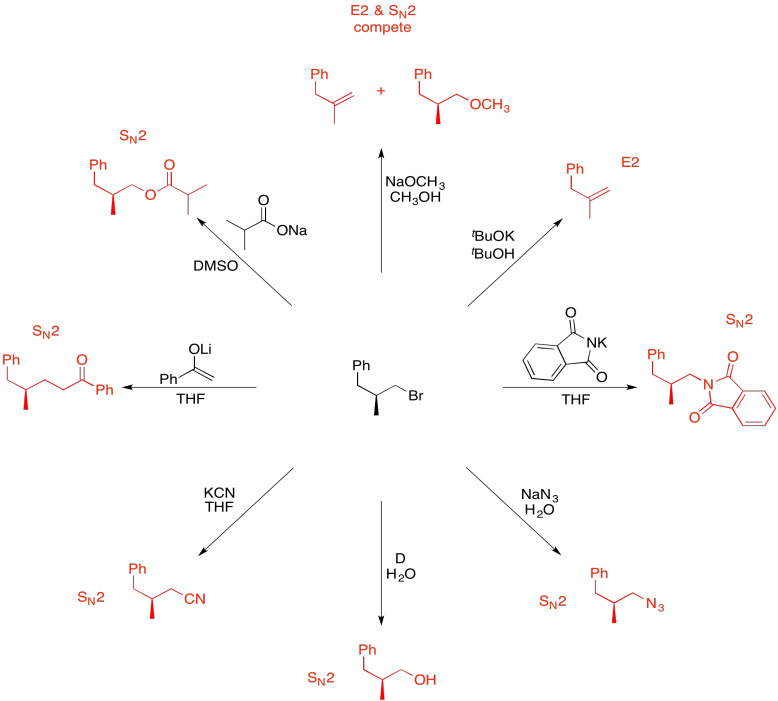
Ejercicio 4.19.11:
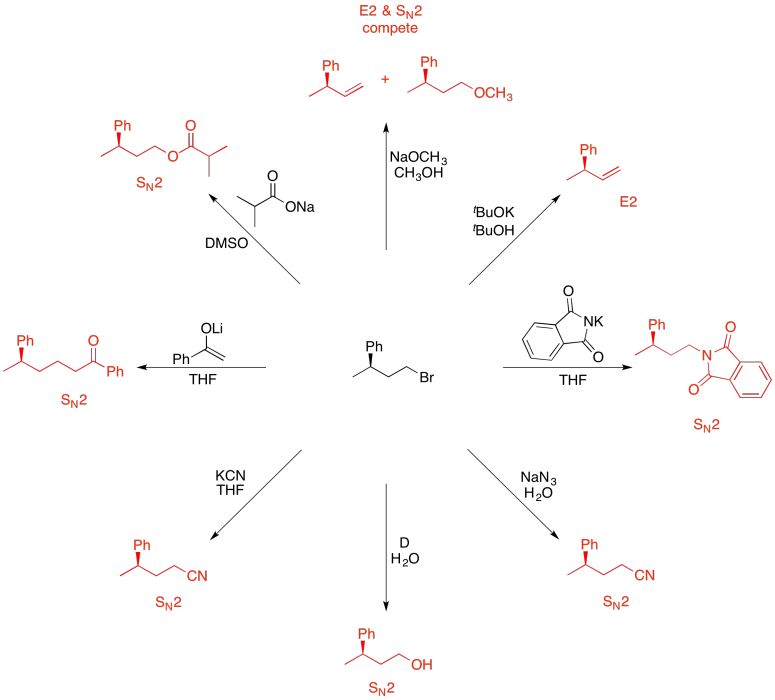
Ejercicio 4.19.12:
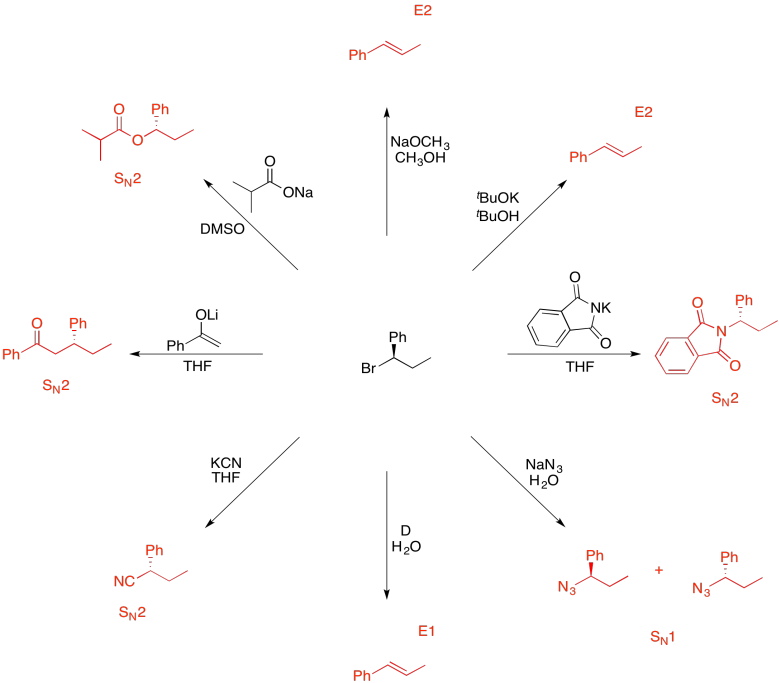
Ejercicio 4.19.13: