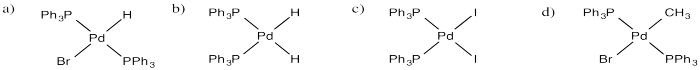5.1: Introducción
- Page ID
- 78580
La adición oxidativa y la eliminación reductiva son pasos clave en la catálisis industrial. La adición oxidativa se utiliza para activar sustratos. Los sustratos que normalmente podrían no reaccionar se preparan para reaccionar con algo. Entonces se sientan en el átomo metálico y esperan que algo más venga y reaccione con ellos.

Figura\(\PageIndex{1}\): Una adición oxidativa generalizada.
Los enlaces se pueden romper mediante la adición oxidativa que no se puede romper fácilmente a través de otras reacciones. Por ejemplo, aunque el enlace H-H es muy fuerte, se puede escindir en presencia de una variedad de átomos e iones metálicos. Los metales de transición poseen las herramientas adecuadas para separar los dos átomos de hidrógeno entre sí.

Figura\(\PageIndex{2}\): Una adición oxidativa generalizada de dihidrógeno.
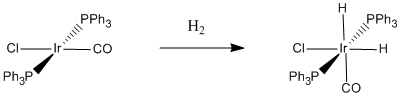
Figura\(\PageIndex{3}\): Un caso específico de adición oxidativa de dihidrógeno. Cuando el hidrógeno se suma al complejo de Vaska, el estado de oxidación del iridio cambia de +1 a +3.
La eliminación reductiva, a su vez, se utiliza para unir diferentes grupos para formar productos útiles. Una vez que dos grupos están sentados uno al lado del otro en un átomo o ion de metal de transición, pueden unirse entre sí en lugar del metal y salir juntos como una nueva molécula.

Figura\(\PageIndex{4}\): Un esquema general para la eliminación reductiva.
Claramente, una eliminación reductiva es solo una adición oxidativa a la inversa. La reacción puede ir en cualquier dirección. Eso significa que puede, posiblemente, ocurrir en equilibrio. En este nivel, no se esperaría que supieras qué dirección se favorecería para una reacción en particular. Sin embargo, es posible que pueda predecir en qué dirección procedería una reacción basándose en factores como el principio de le Chatelier.
- El principio de le Chatelier dice que un cambio en las condiciones de reacción conducirá a un cambio en la relación producto:reactivo que compensa el cambio
Por ejemplo, agregar más reactivo a la reacción desplaza el equilibrio hacia la derecha. Se elabora más producto, y se utiliza parte del reactivo extra, de modo que el sistema pueda volver a su equilibrio natural. Si los productos se eliminan de alguna manera del sistema, la reacción también se desplazará hacia la derecha, utilizando los reactivos y reemplazando el producto faltante. Si la reacción es exotérmica (produce calor) y se agrega más calor al sistema, la reacción se desplazaría hacia la izquierda, agotando algunos productos y haciendo más reactivos para eliminar el exceso de calor.
La reversibilidad de la adición oxidativa/eliminación reductora realmente sirve muy bien en los procesos catalíticos. Por ejemplo, uno de los procesos catalíticos más importantes del mundo es la hidrogenación catalítica, en la que se agregan dos átomos de hidrógeno a través de un doble enlace (generalmente un enlace C=C, pero a veces un enlace C=O o C=N). El proceso requiere la adición oxidativa de hidrógeno a un metal, pero también requiere la eliminación reductora de un alquilo y un hidruro para formar el producto final, formando un hidrocarburo.

Figura\(\PageIndex{5}\): Eliminación reductiva de un metilo y un hidruro para formar metano.
La adición de dihidrógeno al complejo de Vaska y otros metales de transición es una reacción reversible. El hidrógeno se puede liberar de nuevo si la reacción se mueve hacia la izquierda en una eliminación reductora. Esa reversibilidad hace que los compuestos metálicos de transición sean útiles para el almacenamiento de hidrógeno. El gas hidrógeno es voluminoso, inflamable y generalmente peligroso. Al escindir H 2 y unir hidrógeno a átomos metálicos, el hidrógeno puede almacenarse de manera más segura y liberarse nuevamente en las condiciones adecuadas.
En la eliminación reductiva, se pueden hacer enlaces que no se pueden formar a través de otras reacciones. Eso lo convierte en una parte útil de las estrategias para hacer productos químicos básicos y moléculas orgánicas complejas como los farmacéuticos.
Con base en el principio de le Chatelier, proponer condiciones bajo las cuales:
a) El complejo de Vaska podría unir hidrógeno
b) el aducto de dihidruro resultante del complejo de Vaska podría liberar dihidrógeno nuevamente.
- Contestar a
-
bajo una atmósfera de gas hidrógeno.
- Respuesta b
-
bajo una atmósfera de un gas inerte como nitrógeno o argón, especialmente si existe una manera de que el gas hidrógeno escape.
Dibujar productos de adición oxidativa de los siguientes compuestos a (PPh 3) 2 Pd.
a) HBr b) H 2 c) I 2 d) CH 3 -Br
- Contestar
-