5.2: Descripción general de la reacción
- Page ID
- 78610
La adición oxidativa es un término general para la inserción de un metal entre dos átomos que previamente estaban unidos entre sí.

Figura\(\PageIndex{1}\): Nuestro esquema general para una adición oxidativa de hidrógeno a un metal.
La adición oxidativa es un tipo de reacción más que un mecanismo. Son posibles varios mecanismos diferentes, incluyendo reacciones polares, reacciones no polares/concertadas y reacciones radicales. Por ejemplo, la formación de nucleófilos de Grignard por tratamiento de halogenuros de alquilo con magnesio podría describirse como una adición oxidativa.
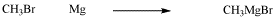
Figura\(\PageIndex{2}\): La formación de un reactivo de Grignard podría describirse como una adición oxidativa, aunque el mecanismo no se parece a los que veremos aquí.
Sin embargo, se cree que la formación de Grignard ocurre a través de una reacción radical, y tiene muy poca relación con la adición de hidrógeno al complejo de Vaska, por ejemplo. En esta sección, veremos las adiciones oxidativas polares y las adiciones oxidativas concertadas. Las adiciones oxidativas radicales se dejarán para un capítulo posterior sobre química radical.
¿De dónde provienen los términos “adición oxidativa” y “eliminación reductiva”? Piense en cómo aprendimos a contar electrones de valencia en complejos de metales de transición. Una de las primeras cosas que hicimos fue eliminar los ligandos del complejo para ver si habría una carga en el metal sin los ligandos.

Figura\(\PageIndex{3}\): Deconstrucción de un complejo metálico para discernir la carga sobre el metal.
Si cada ligando H en la Figura OA2.2 es un hidruro (razonable porque H es más electronegativo que el metal), entonces eliminarlos dejaría el metal con una carga 2+. Eso significa que el metal está en el estado de oxidación (II), aunque formalmente no tenga una carga sobre él en el complejo. La adición de H 2 a un átomo de metal, M, se acompaña de un aumento en el estado de oxidación formal en el metal (en +2).
La eliminación reductora es microscópica inversa de la adición oxidativa.

Figura\(\PageIndex{4}\): Deconstrucción de un complejo metálico para discernir la carga sobre el metal.
Dos átomos que estaban unidos a un átomo de metal se unen entre sí, en cambio. Tenga en cuenta el estado formal de oxidación del metal. Esta eliminación se acompaña de disminución en el estado de oxidación formal en el metal (en -2).
Recuerde, el estado de oxidación a menudo se puede determinar dando a cada ligando el par de electrones que comparte con el metal. Ordena la carga formal sobre el átomo donante en el ligando, y conocerás la carga u estado de oxidación del metal.
Por ejemplo, en el ejemplo de MH 2 en la Figura OA2.3., supongamos que cada enlace entre M y H es un par de electrones que pertenece con el hidrógeno. Un hidrógeno con dos electrones es un anión. Como resultado, el metal debe tener un estado de oxidación de +2 (generalmente escrito con el número romano II).
Determinar el estado de oxidación en el metal antes y después de cada una de las siguientes reacciones.
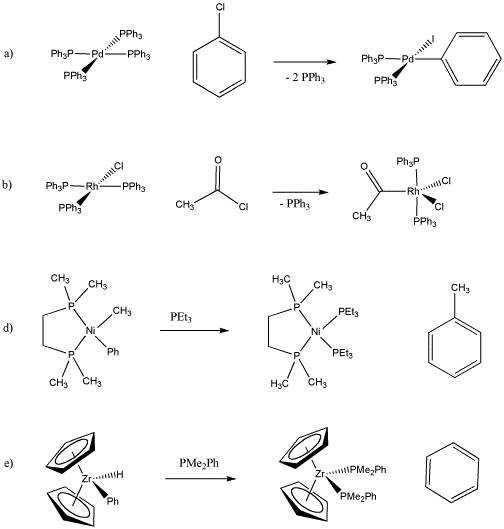
- Contestar a
-
Pd (0) a Pd (II) (I y Ph son negativos)
- Respuesta b
-
Rh (I) a Rh (III) (Cl y acilo son negativos)
- Respuesta d
-
Ni (II) a Ni (0) (Metilo y fenilo son negativos)
- Respuesta e
-
Zr (IV) a Zr (II) (Cp, H y Ph son negativos)
Proponer una razón por la cual la adición de un ligando como una fosfina a veces puede resultar en la eliminación reductiva de un complejo de coordinación.
- Contestar
-
El aumento del hacinamiento estérico en la esfera de coordinación puede obligar a dos gorups a eliminar juntos de manera reductiva.

