2.3: Efecto de la Carga- Efectos Distales, o Efectos del Medio
- Page ID
- 79281
La carga sobre un complejo de coordinación, que se encuentra dentro de una metaloproteína, tiene una fuerte influencia en el potencial de reducción del centro metálico. Otros factores en el medio circundante pueden estabilizar o desestabilizar esa carga. En consecuencia, debemos considerar la interacción del centro metálico con su entorno.
Consideremos un centro metálico en el que la carga local —es decir, la suma de las cargas sobre el ión metálico y sus ligandos coordinados— sea -2. La adición de un electrón resultaría en una carga local de -3.
Pero, ¿por qué estamos hablando de esta “carga local”? ¿No es -3 la carga de toda la molécula? Bueno, no. Recuerden, estamos hablando de una proteína. Se trata de una molécula muy grande. Y lo que es más, tiene muchos otros cargos asociados a ella. Muchos residuos de aminoácidos pueden ser neutros, pero algunos tienen cargas negativas y otros tienen cargas positivas.
Esas cargas están destinadas a interactuar con la carga en el centro metálico. Habría interacciones culombicas entre las cargas. Piense en un caso en el que haya una serie de residuos de aminoácidos cercanos, cargados positivamente.

Esos residuos cargados positivamente tendrían una interacción atractiva con el centro metálico. La energía general se vería disminuida por esta interacción. Si se agregara otro electrón al centro metálico, y se volviera más negativo, la interacción con las cargas positivas vecinas sería aún mayor. Como resultado, se inclina un equilibrio dentro de esta proteína. Los residuos cargados positivamente estabilizan tanto el estado oxidado como el estado reducido del centro metálico, pero estabilizan aún más el estado reducido. El potencial de reducción aumenta en este caso.
¿Qué residuos de aminoácidos se encuentran generalmente con cargas positivas a pH neutro?
Ahora pensemos en el caso contrario. Tomaremos el mismo centro metálico, pero lo rodearemos con algunos residuos de aminoácidos cargados negativamente.
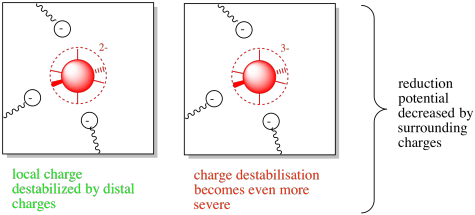
En este caso, los restos de aminoácidos vecinos desestabilizarían la carga en el centro metálico. No obstante, si el metal se reducía, la situación empeoraría aún más. La acumulación de carga negativa conduciría a aumentar las fuerzas repulsivas y desestabilizadoras. Se reduciría el potencial de reducción.
¿Qué residuos de aminoácidos se encuentran generalmente con cargas negativas a pH neutro?
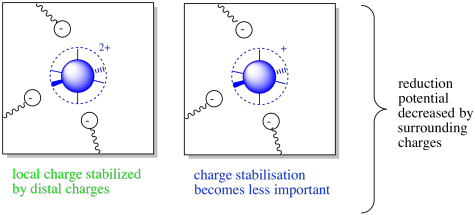
Por supuesto, no todos los complejos proteína-metal tienen una carga negativa alrededor del ion metálico. Si los donantes coordinantes son neutros en lugar de aniónicos, el complejo puede tener una carga positiva general. ¿Cómo va a cambiar eso las cosas?
Bueno, los detalles sí cambian, pero la idea general sigue siendo la misma. Esta vez, los residuos de aminoácidos circundantes estabilizarán el complejo solo si están cargados negativamente. Por supuesto, cuanto más positivamente cobraba el complejo, más importante era esa interacción. Esta situación puede resultar en una disminución del potencial de reducción.
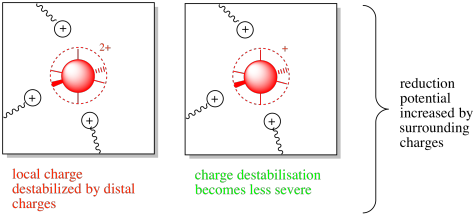
Esa situación se revertiría ante la presencia de restos de aminoácidos cercanos con cargas positivas. En ese caso, la desestabilización del estado oxidado más positivo puede motivar al complejo hacia la aceptación de un electrón. El potencial de reducción puede incrementarse en este caso.
Todos estos ejemplos involucran solo unos pocos residuos de aminoácidos que realmente están cargados a pH neutro o similares. ¿Significa eso que estos factores son raros, solo para ser considerados cuando sucede que hay tales residuos lo suficientemente cerca como para realmente marcar la diferencia?
En realidad no. Recuerda, una proteína tiene muchos aspectos polares. Incluso en ausencia de cargas, hay una serie de residuos de aminoácidos que tendrían momentos dipolares. Estos momentos dipolares tendrían interacciones ión-dipolo con centros metálicos cargados. En general, los dipolos vecinos serían capaces de estabilizar cargas, siempre que los residuos de aminoácidos fueran conformacionalmente lo suficientemente flexibles como para interactuar con la carga de manera estabilizadora.

De los siguientes pares de aminoácidos, ¿cuál es más polar?
a) lisina o leucina b) alanina o glutamina c) histidina o valina
d) Ile o Asp e) Pro o Thr f) Asn o Ala
g) K o M h) Y o F i) R o E
Por supuesto, no tiene que ser un residuo de aminoácido que interactúe con el centro metálico cargado. La columna vertebral de la proteína en sí tiene algunos carbonilos muy polares. Recuerde, estos carbonilos son especialmente polares debido a la donación π-de los nitrógenos de amida. Uno de estos restos podría orientarse de tal manera que interactuara con un centro metálico, influyendo en su potencial de reducción.
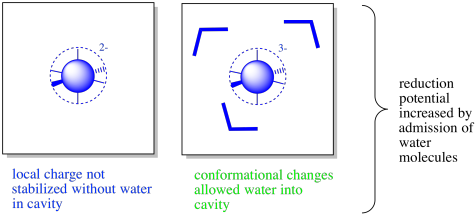
También puede haber moléculas de agua presentes en el interior de la proteína. El complejo de coordinación se puede encontrar en un pliegue o cavidad lo suficientemente grande a lo largo de la proteína para que las moléculas de agua puedan entrar, estabilizando cualquier carga.
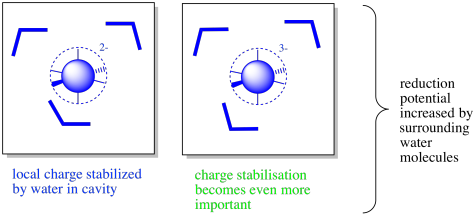
Además, los cambios conformacionales tras la oxidación o reducción pueden conducir a la apertura o cierre de canales en la proteína. Los cambios conformacionales podrían estar vinculados a la actividad redox porque el enlace metal-ligando puede alargarse o contraerse como resultado de reacciones de oxidación-reducción. En consecuencia, es posible que las aguas estén presentes en un estado pero no en otro. Desde un punto de vista predictivo, esto convierte en una situación extremadamente complicada. Sin embargo, desde el punto de vista de la naturaleza, proporciona un mayor nivel de control sobre las propiedades de la metaloproteína.