6.3: Iniciación Radical- Estabilidad Radical
- Page ID
- 79195
La fuerza de unión no se trata solo de la interacción de los dos fragmentos unidos entre sí. También está influenciada por la estabilidad de esas dos especies por su cuenta. Cuando se rompe el vínculo, ¿qué piezas quedan?
La formación de radicales puede ser impulsada por la debilidad de un enlace particular. En términos de formación de radicales a través de la homólisis de enlaces, la reacción es más favorecida por el producto si el enlace que se rompe es débil. En otras palabras, el enlace no es muy bajo en energía, por lo que la reacción general puede llegar a ser más cuesta abajo (o al menos menos cuesta arriba). En ese caso, se favorece la reacción directa debido a la desestabilización de los reactivos.
Sin embargo, una reacción cuesta abajo también podría ocurrir a través de la estabilización del producto. Por ejemplo, ya hemos visto que átomos más grandes, más polarizables forman radicales más estables. Los radicales yodo son más estables que los radicales bromo, y los radicales de azufre son más estables que los radicales de oxígeno.
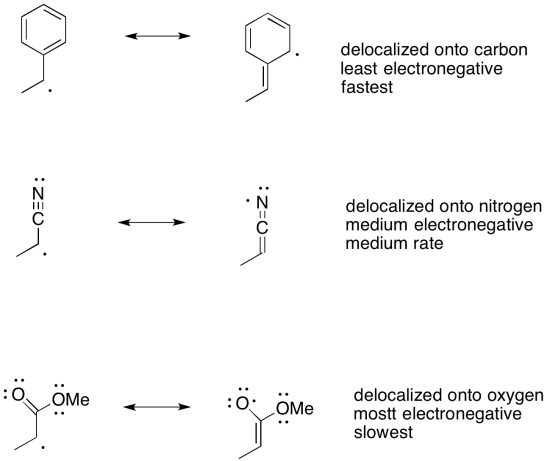
También hay otros factores. Uno de los factores más importantes es la resonancia. Hemos visto que la estabilidad de aniones y cationes está fuertemente influenciada por la deslocalización. Los factores que propagan el exceso de carga en múltiples átomos, en lugar de permitir que la carga se concentre en un átomo, hacen que las especies cargadas sean mucho más estables.
Por ejemplo, los aniones basados en carbono son relativamente inestables, pero un carbanión deslocalizado está dentro del ámbito de la posibilidad. Los iones enolato son particularmente fáciles de obtener porque la carga negativa se deslocaliza parcialmente en un átomo de oxígeno más electronegativo. La deslocalización también estabiliza fuertemente los radicales. Es uno de los factores más importantes en la estabilidad de los radicales basados en carbono.
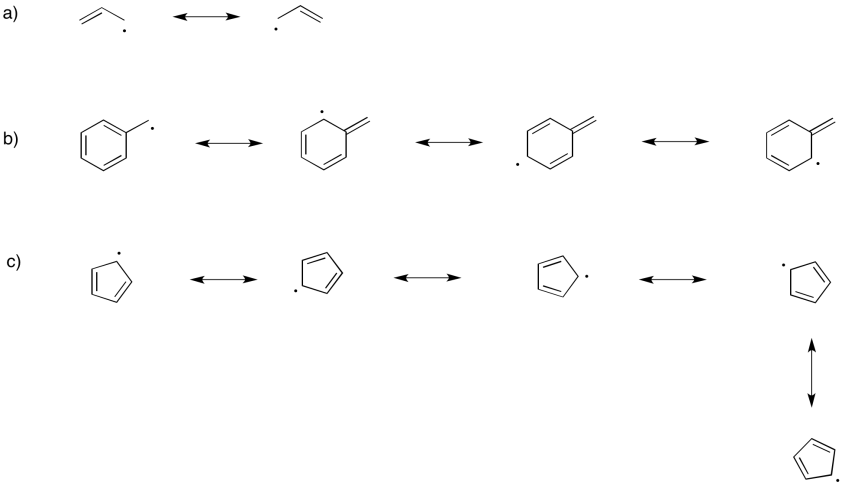
Ilustrar la estabilización de resonancia en los siguientes radicales
a) alilo, CH 2 CHCH 2 b) bencilo, CH 2 C 6 H 5 c) ciclopentadienilo, C 5 H 5
- Contestar
-
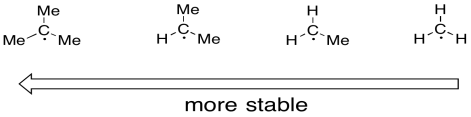
Los radicales en los átomos de carbono también se estabilizan cuando están en posiciones más sustituidas. Así como los carbocationes son más estables si están en posiciones más sustituidas, los radicales de carbono también son más estables en estas posiciones. Un radical terciario es más estable que uno secundario. Un radical secundario es más estable que uno primario.
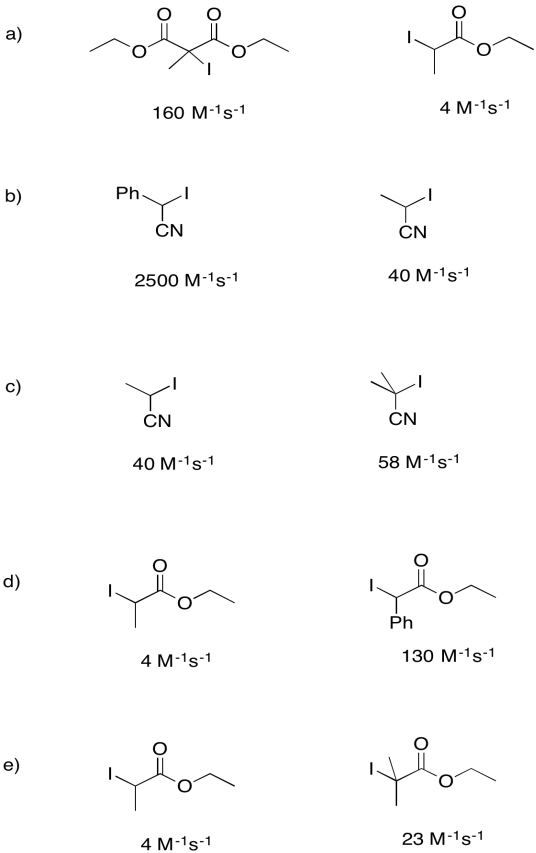
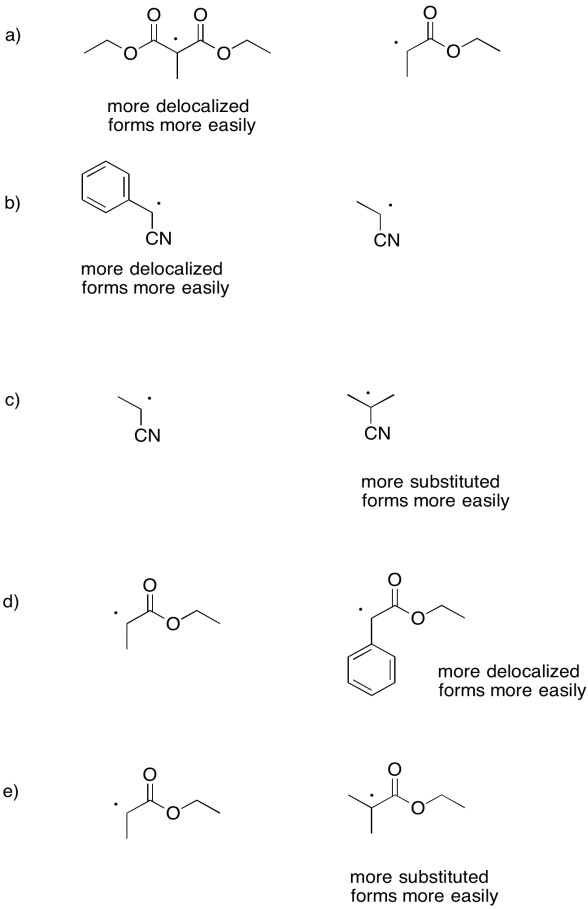
Las constantes de velocidad para la disociación de los siguientes iniciadores para formar un átomo de yodo y un radical se midieron bajo un conjunto específico de condiciones. Para cada par, explique por qué un compuesto se somete a homólisis más rápidamente.
- Contestar
-
Predecir el orden relativo de las tasas de disociación de enlaces para los siguientes iniciadores, que formarían cada uno un radical tellerio y un radical carbono.
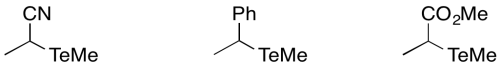
- Contestar
-