6.4: Iniciación Radical - Transferencia de Electrones Únicos
- Page ID
- 79189
Vimos en la sección de reacciones redox que los electrones individuales pueden transferirse de una especie a otra. Debido a que un electrón se transfiere a la vez, los radicales se pueden iniciar de esta manera.
Los metales que son altos en la serie de actividad, como el litio o el sodio, pueden donar fácilmente sus electrones de valencia a compuestos orgánicos. Como resultado, esos compuestos orgánicos se convierten en radicales.
\[\ce{Li -> Li^{+} + e^{-}} \nonumber\]
\[\ce{Na + Na^{+} + e^{-}} \nonumber\]
La posibilidad de esta reacción se ilustra más fácilmente con un ejemplo de química de carbonilo. Los carbonilos son electrófilos. El carbono electrófilo normalmente acepta un par de electrones de un donante nucleofílico. Sin embargo, un solo electrón también podría pensarse como un nucleófilo.
Por ejemplo, si la benzofenona se disuelve en un disolvente no reactivo, como el éter, sobre unos pocos trozos de sodio, el sodio puede transferir un electrón al carbonilo. Lo interesante de esta reacción es que, aunque la benzofenona es un compuesto blanco (o incoloro) y el éter es un líquido incoloro, la solución de éter se vuelve azul profundo después de un par de horas. El anión radical benzofenona es de color azul profundo.
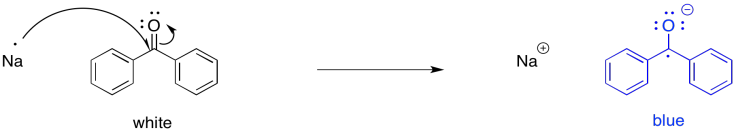
El radical benzofenona ha jugado durante mucho tiempo un papel importante en los laboratorios de investigación. Durante muchos años, el sodio se ha utilizado como agente de secado para solventes orgánicos. Debido a la conocida propensión del sodio a reaccionar con el agua, cualquier rastro de agua en un matraz de éter se destruye. Se convierten en hidróxido de sodio e hidrógeno gaseoso. No obstante, ante la ausencia de agua —es decir, si el sodio ya ha hecho su trabajo— el sodio puede transferir electrones a benzofenona en solución, produciendo un color azul. Por lo tanto, la benzofenona funciona como un indicador para que los investigadores sepan que el solvente está seco.
Después de unas horas más, el color cambia una vez más a un púrpura profundo. Eso es porque un segundo electrón se transfiere al radical benzofenona, formando el dianión de benzofenona. Ahí es cuando sabes que el solvente está realmente, muy seco. Sin embargo, todo esto tiene que hacerse bajo una atmósfera de nitrógeno, o bien el anión radical benzofenona experimenta una reacción adicional con el oxígeno, produciendo schmutz amarillo en todo el matraz en lugar del hermoso color púrpura. Este método de secado también funciona con benceno o tolueno, o con una pequeña modificación, hidrocarburos saturados como el pentano. No funciona con muchos otros solventes, que en cambio podrían reaccionar directamente con el sodio.

Pero, ¿qué pasaría si, en este punto, introdujéramos cuidadosamente algunos protones? Tal vez esté en forma de un ácido, ya sea fuerte (HCl) o muy débil (NH 4 Cl). El dianión de benzofenona seguramente se protonaría, y como es un dianión se protonaría dos veces.
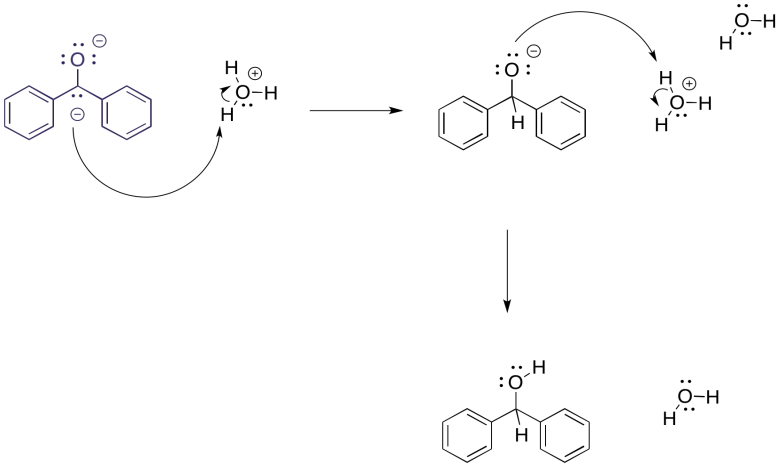
El resultado global es una reducción de la benzofenona al alcohol correspondiente, 1,1-difenilmetanol. Sería como si hubiéramos agregado borohidruro de sodio, una fuente de hidruro nucleofílico (eso es un protón más dos electrones) y luego hicimos un tratamiento ácido (agregando un segundo protón). En este caso, acabamos de sumar los componentes (dos electrones, dos protones) en un orden diferente.
Además, este método de reducir las cosas no se limita realmente a los carbonilos. Los alquinos y los aromáticos también son susceptibles de reducción al radical anión o dianión, aunque la reacción se realiza más comúnmente usando litio.
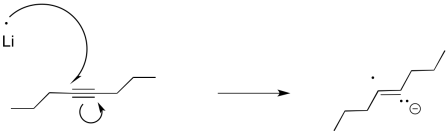
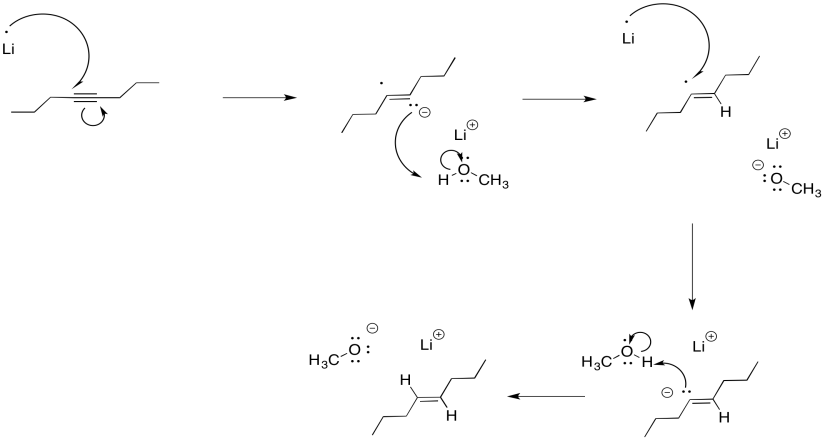
Podemos imaginar un proceso similar de protonación ocurriendo para obtener un alqueno. Se parece un poco a una reducción alquino, pero en lugar de usar H 2 como fuente de átomos de hidrógeno, hemos utilizado un metal alcalino como fuente de los electrones y un alcohol como fuente de protones.
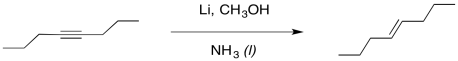
Curiosamente, estas últimas reacciones son estereoespecíficas. Los sitios de los aniones (y las protonaciones posteriores) están lo más separados posible. Eso significa que los aniones se encuentran trans- entre sí en el anión alquenilo. Como resultado, el alqueno trans siempre resulta de la reducción de litio. Esta reacción es complementaria a la hidrogenación con el catalizador de Lindlar, que siempre resulta cis-alquenos.
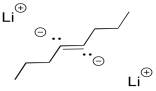
Puede ser sorprendente que el dianión no sea requerido para obtener esta selectividad de “mantener las cargas negativas muy separadas”. Normalmente, estas reducciones se realizan en amoníaco líquido, a menudo con un poco de alcohol agregado. Bajo esas condiciones, el anión radical inicial se protonó antes de la segunda donación de electrones. El dianión nunca se forma realmente, sin embargo, la selectividad sigue siendo la misma. La repulsión entre el par solitario y el radical son suficientes para dar cuenta de la estereoselectividad.
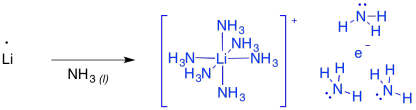
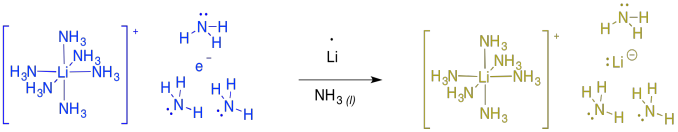
Estas reacciones a veces se llaman “reducciones de metal disolvente” debido a que el metal de litio se disuelve en el amoníaco líquido. En amoníaco y algunas aminas, el metal en realidad se somete a ionización para producir Li + y e -. Esta “sal” se llama “electrido de litio” y produce un color azul brillante. Realmente es un complejo de coordinación, con un catión de litio de hexaamina y un electrón solvatado con amoníaco. Además, la solución es paramegnetica y altamente conductora, debido a todos esos electrones desapareados flotando por su cuenta.
Si sigues agregando más y más litio al amoníaco, en algún momento la solución se vuelve diamagnética y se vuelve de color dorado. En este punto, la evidencia sugiere la formación de “litidio de litio”, o Li + Li -. Lo mismo sucede con otros metales alcalinos, como el sodio o el potasio, que producen sodio de color bronce o potasside potásico.
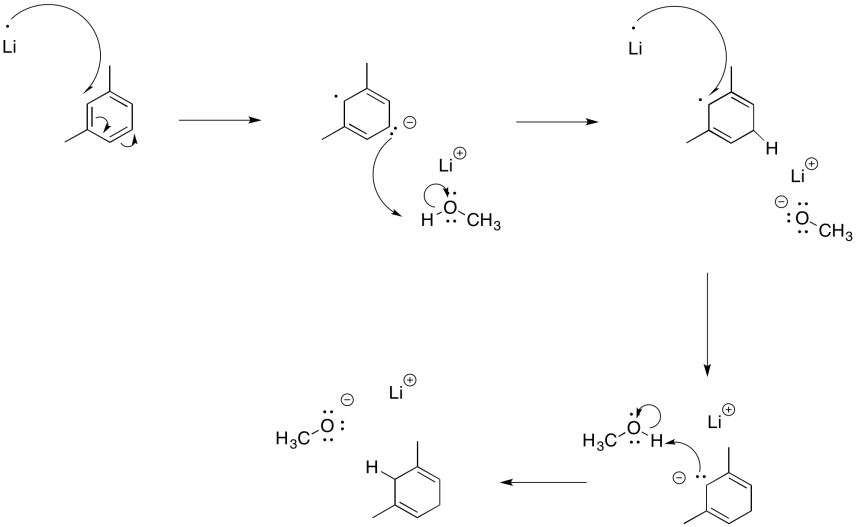
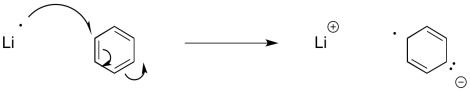
Reacciones similares ocurren con sistemas aromáticos. Estas reacciones se llaman “reducciones de abedul”. Debido al mismo problema de repulsión electrón-electrón encontrado en la reducción de alquinos, las reducciones de Birch siempre dan como resultado que los radicales/aniones se posicionen en las posiciones 1,4-en el anillo de benceno.
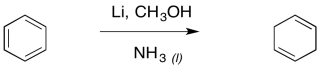
El resultado es un ciclohexa-1,4-dieno. Al igual que con la reducción de alquino, la reducción de abedul generalmente se realiza con una pequeña cantidad de alcohol en solución.
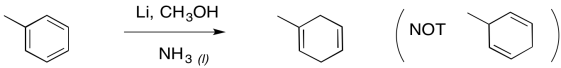
Además, los dobles enlaces restantes de una reducción de Birch están en las posiciones más sustituidas; eso es comprensible en términos de la tendencia de estabilidad alqueno, en la que más dobles enlaces sustituidos son más estables.
Ilustrar los productos de la transferencia de electrones individuales del litio a los siguientes compuestos
a) 2-hexino, CH 3 CC (CH 2) 2 CH 3 b) 2-butanona, CH 3 COC 2 H 5 c) bromuro de alilo, CH 2 CHCH 2 Br
- Contestar
-
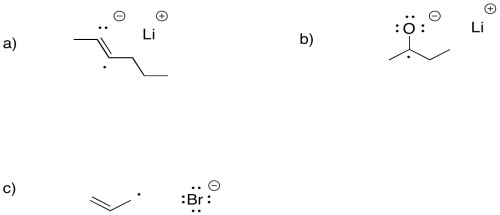
La transferencia de electrones individuales es mucho más difícil a un anión carboxilato que a un aldehído o cetona. Explique por qué.
- Contestar
-
El potencial de reducción del anión carboxilato cargado negativamente sería mucho menos positivo que el potencial de reducción para el aldehído neutro o cetona. Pensamos en un anión carboxilato mucho menos electrófilo que aldehídos y cetonas por la misma razón.
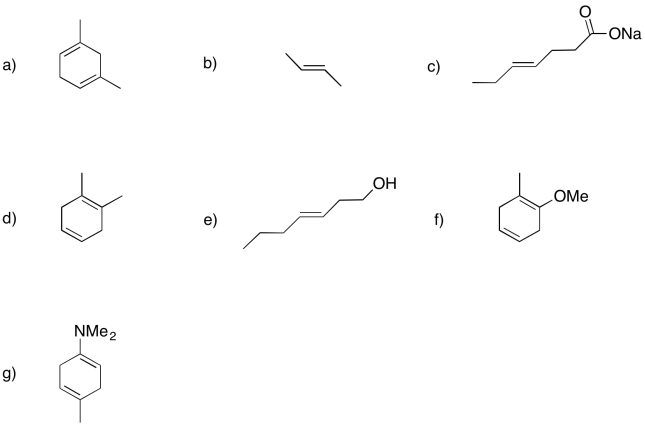
Mostrar los productos de disolución de metal o reducciones de abedul en los siguientes casos.
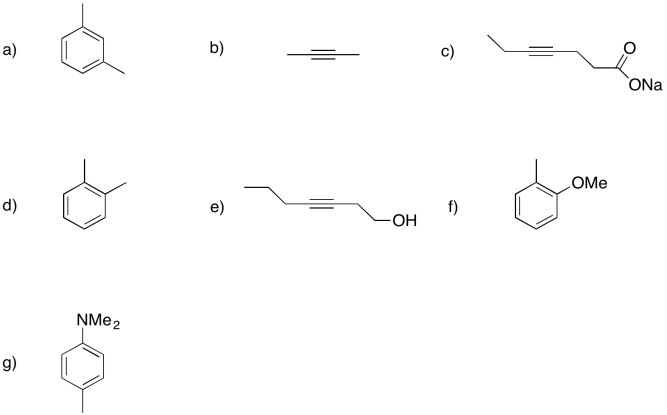
- Contestar
-
Mostrar el mecanismo para la reducción de abedul de m-xileno (m-dimetilbenceno) con litio y metanol en amoníaco líquido.
- Contestar
-