6.5: Propagación Radical
- Page ID
- 79214
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\dsum}{\displaystyle\sum\limits} \)
\( \newcommand{\dint}{\displaystyle\int\limits} \)
\( \newcommand{\dlim}{\displaystyle\lim\limits} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\(\newcommand{\longvect}{\overrightarrow}\)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)Los radicales son conocidos por participar en “reacciones en cadena”. En una reacción en cadena se genera un intermedio reactivo. Cuando reacciona, deja otro intermedio reactivo, muy parecido al primero. Este evento se llama “propagación”.
Hay un par de formas comunes en que se produce la propagación. El radical podría lograr su recuento de electrones estable al arrebatar otro átomo, especialmente un átomo de hidrógeno. Ese evento se llama abstracción de átomos de hidrógeno. Alternativamente, un radical puede enlazarse con uno de los electrones en un enlace pi.
En la abstracción de un átomo, el radical forma un vínculo con ese átomo. Ese enlace vuelve a dar al radical un número par de electrones.
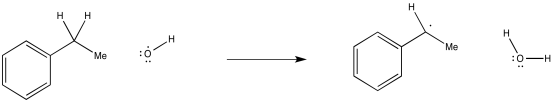
Mostrar, con flechas, el mecanismo de abstracción de un átomo de hidrógeno del etilbenceno por un radical hidroxilo.
- Contestar
-
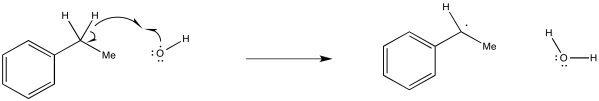
Es importante señalar que en una abstracción de un átomo de hidrógeno, el radical está reaccionando no solo con el protón, sino con todo el átomo de hidrógeno. También está tomando el electrón.
Exactamente qué átomo se abstrae tiene mucho que ver con las fortalezas de los enlaces. Por ejemplo, los enlaces O-H son bastante fuertes (hasta 120 kcal/mol, en agua, por ejemplo). Así, un radical OH con frecuencia abstraerá los átomos de hidrógeno, porque hay un beneficio energético cuando eso sucede.
Por supuesto, un vínculo también tiene que romperse durante una abstracción. Eso cuesta algo de energía. Los bonos C-H también son bastante fuertes, por lo que pueden ser difíciles de romper. Sin embargo, algunos enlaces C-H en particular son más débiles que otros. Por ejemplo, para romper un enlace bencílico C-H, el costo es de sólo unos 88 kcal/mol. En el caso de la abstracción de átomos de hidrógeno del etilbenceno por radical hidroxilo, la compensación vale la pena.
Dibujar un diagrama de progreso de la reacción para la abstracción de un átomo de hidrógeno del etilbenceno por un radical hidroxilo.
No siempre se da el caso de que una reacción esté determinada puramente por la termoquímica de los enlaces involucrados. En ocasiones, hay factores cinéticos que bloquean el camino hacia el producto más estable, o que bajan el camino hacia el producto menos estable. Sin embargo, en muchas abstracciones de átomos, debido a que el viejo enlace se está rompiendo al mismo tiempo que se está formando el nuevo enlace, ambos factores importan en el paso determinante de la velocidad. Para cuando se alcanza el estado de transición, la estabilidad del complejo está influenciada tanto por el vínculo que se está rompiendo como por el vínculo que se está haciendo. Como resultado, la termodinámica de la reacción puede tener una fuerte influencia en el camino hacia los productos.
| Bond | Energía de disociación (kcal/mol) | Bond | Energía de disociación (kcal/mol) |
| F-H | 136 | Br-H | 88 |
| Cl-H | 103 | I-H | 71 |
| Eto-h | 105 | O 2 n-OMe | 42 |
| CH 3 S-H | 87 | CL-OME | 48 |
| Pho-h | 87 | H 3 C-OMe | 85 |
| Me 2 N-H | 91 | H 3 C-NH 2 | 85 |
| Et 3 Si-H | 96 | H 3 C-F | 115 |
| Bu 3 Ge-H | 88 | CH 3 -H 2 C-Cl | 85 |
| Bu 3 Sn-H | 78 | CH 3 -H 2 C-Br | 72 |
| Me 3 Sn-Cl | 100 | CH 3 -H 2 C-I | 57 |
Indicar si es probable que un radical dimetilamina lleve a cabo abstracción de átomos de hidrógeno a partir de cada una de las siguientes moléculas.
a) Et 3 SiH b) PhoH c) EtOH d) Bu 3 SnH e) HF f) HI
- Contestar a
-
a) no; un vínculo más fuerte tendría que romperse y reemplazarse por un vínculo más débil.
- Respuesta b
-
b) sí; se rompería un vínculo más débil y se reemplazaría por uno más fuerte.
- Respuesta c
-
c) no
- Respuesta d
-
d) sí
- Respuesta e
-
e) no
- Respuesta f
-
f) sí
Indicar si es probable que se produzca una abstracción de átomos de cloro en cada uno de los siguientes casos.
- El cloroetano está expuesto al radical metoxi.
- El cloroetano está expuesto al radical trimetilestaño.
- El cloruro de trimetilestaño se expone al radical metoxi.
- Contestar a
-
a) no
- Respuesta b
-
b) sí
- Respuesta c
-
c) no
En ocasiones, la identidad de los dos átomos que forman un vínculo no cuenta toda la historia sobre las fortalezas de los enlaces. En el caso de los enlaces C-H de hidrocarburos, por ejemplo, se ha determinado experimentalmente un rango de resistencias de unión. Hay una diferencia de 40 kcal/mol entre el enlace C-H más débil en un hidrocarburo simple y el más fuerte (es decir, aproximadamente 175 kJ/mol, para los orientados métricamente). Estas fuerzas de unión son notablemente sensitivas a diferencias estructurales sutiles, en gran parte debido a las estabilidades relativas de los radicales resultantes cuando se rompe el enlace.
| Bond | Energía de disociación del enlace (aproximada; kcal/mol) |
| HCC-H (arilo) | 130 |
| Ph H (arilo) | 110 |
| CH 2 =CH-H (vinil) | 106 |
| H 3 C-H | 105 |
| CH 3 CH 2 -H | 98 |
| (CH 3) 2 CH-H | 95 |
| (CH 3) 3 C-H | 92 |
| PhCh 2 -H (bencilo) | 88 |
| CH 2 =CH-CH 2-H (alilo) | 88 |
Proponer razones de las tendencias en las fortalezas de los bonos entre los siguientes grupos.
- H 3 C-H, CH 3 CH 2 -H, (CH 3) 2 CH-H, (CH 3) 3 C-H
- (CH 3) 2 CH-H, PhCH 2 -H, CH 2 =CH-CH 2 -H
- HCC-H, CH 2 =CH-H, CH 3 CH 2 -H
- Contestar a
-
a) El efecto es similar a la estabilidad de los carbocationes. El radical más sustituido es más estable. Así, la tendencia de más a menos estable es terciaria > secundaria > primaria > radical metilo. La tendencia probablemente se origina a partir de un efecto de hiperconjugación, como en los carbocationes.
- Respuesta b
-
b) La tendencia aquí es que si el radical es deslocalizado por resonancia, es más estable. Los radicales alilo y bencilo son más estables que el radical isopropilo. Esta tendencia también se ve en los cationes.
- Respuesta c
-
c) La tendencia aquí tiene que ver con los “efectos de hibridación” o los orbitales atómicos que contribuyen a la formación de orbitales moleculares involucrados en el enlace relevante. En un alquino lineal, el enlace C-H solo puede formarse a partir de alguna combinación que involucra un orbital de hidrógeno 1s, orbital de carbono 2s y uno de los orbitales de carbono 2p. Esta combinación se denomina híbrido “sp” y el orbital que se combina con el hidrógeno puede considerarse 50% 2s, 50% 2p en carácter.
En un alqueno plano, el enlace C-H solo puede formarse a partir de alguna combinación que involucra un orbital de hidrógeno 1s, orbital de carbono 2s y dos de los orbitales de carbono 2p (ya que dos de ellos podrían estar en este plano). Esta combinación se denomina híbrido “sp 2" y el orbital que se combina con el hidrógeno puede considerarse 33% 2s, 66% 2p de carácter.
En un alcano tetraédrico, el enlace C-H se puede formar a partir de alguna combinación que involucra un orbital de hidrógeno 1s, orbital de carbono 2s y los tres orbitales de carbono 2p. Esta combinación se denomina híbrido “sp 3" y el orbital que se combina con el hidrógeno puede considerarse 25% 2s, 75% 2p en carácter.
Debido a que un orbital 2s es menor en energía que un orbital 2p, un enlace que tiene mayor carácter 2s es menor en energía que un enlace con menos carácter 2s. Eso significa que un vínculo con un carácter de 2s mayor es más difícil de romper que un vínculo con menos carácter 2s. Por lo tanto, el enlace alcano C-H es más débil que el enlace alqueno C-H, que es más débil que el enlace alquino C-H.
Explique por qué un radical trialquilestaño (R 3 Sn) no podría eliminar un átomo de hidrógeno del propano, sino que podría abstraer un átomo de cloro del cloroetano.
- Contestar
-
El enlace Sn-H tiene una energía de disociación de aproximadamente 78 kcal/mol, en comparación con aproximadamente 98 kcal/mol para el enlace C-H en etano. La formación del enlace Sn-H no compensaría la energía necesaria para romper el enlace C-H. Por otro lado, los 100 kcal/mol liberados tras la formación de un enlace Sn-Cl constituirían más que los 85 kcal/mol requeridos para formar un enlace C-Cl.
Podríamos intentar racionalizar esas diferencias, aunque las fortalezas de unión siempre son cuestiones muy complicadas y no podremos explicar las cosas satisfactoriamente sin cálculos mecánicos cuánticos. Sin embargo, comencemos con dos factores básicos: la cantidad de covalencia y la cantidad de polaridad.
La diferencia entre los radios covalentes de estaño e hidrógeno (1.39 vs 0.31 Å) es mucho mayor que la diferencia entre estaño y cloro (1.39 vs 1.02 Å), por lo que puede haber menos solapamiento y menos covalencia entre estaño e hidrógeno que entre estaño y cloro. En comparación, el radio covalente del carbono es de aproximadamente 0.76, lo que lo coloca en algún lugar entre el hidrógeno y el cloro.
Además, según se mide en la escala Pauling, los valores de electronegatividad de estos átomos son: cloro, 3.16; carbono, 2.55; hidrógeno, 2.2; estaño, 1.96. El enlace estaño-cloro tendría un gran componente iónico; este componente adicional de unión fortalecería el enlace Sn-Cl.
La adición a un alqueno es otra vía de propagación común en las reacciones radicales. En este caso, se rompe un enlace π (pi) en el alqueno para formar un nuevo enlace con la especie radical. Eso deja al segundo electrón del enlace π para formar una nueva especie radical.

Los enlaces π suelen ser más débiles que los enlaces σ, lo que hace que esta vía sea energéticamente accesible en muchos casos. Quizás lo más importante es que los electrones en los enlaces π se encuentran por encima y por debajo de una parte plana de la molécula, dejándolos abiertos y accesibles para la reacción con los radicales.
| Bond | Energía de disociación del enlace (kcal/mol) | Bond | Energía de disociación del enlace (kcal/mol) |
| H 3 C-CH 3 | 90 | H 2 C=CH 2 | 174 |
| H 3 C-NH 2 | 85 | H 2 C=NH | ? |
| H 3 C-OH | 92 | H 2 C=O | 179 |
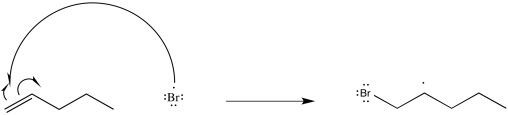
Mostrar un mecanismo, con flechas curvas, para la reacción del penteno con átomo de bromo.
- Contestar
-
Calcular las fortalezas de los siguientes enlaces pi.
- En eteno.
- En metanal.
- Contestar a
-
a) 174 - 90 kcal/mol = 84 kcal/mol para la contribución π solamente
- Respuesta b
-
b) 179 - 92 kcal/mol = 87 kcal/mol para la contribución π solamente
Se ha calculado que el enlace pi en PhCH=NPh tiene una energía de disociación de 77 kcal/mol.
- Estime la energía de disociación del enlace imina C=N que falta en la tabla anterior.
- Explica por qué tu estimación puede no ser confiable.
- Contestar a
-
a) 85 + 77 kcal/mol = 162 kcal/mol para la contribución combinada σ + π
- Respuesta b
-
b) Puede haber diferencias significativas entre el enlace π en la imina metanal (CH 2 =NH) y la imina para la que tenemos datos de fuerza de unión. Por ejemplo, romper el enlace daría como resultado radicales próximos a grupos fenilo, los cuales pueden estabilizarse significativamente. Por otro lado, el propio enlace π puede estabilizarse significativamente por conjugación. Por lo tanto, nuestra estimación probablemente no sea correcta, pero es difícil decir si es demasiado alta o demasiado baja.

