6.6: Terminación Radical
- Page ID
- 79201
Si los pasos de propagación conducen a reacciones en cadena, que conducen continuamente a la formación de nuevos radicales que se involucran en nuevas reacciones de propagación, entonces ¿dónde termina? Ese ciclo autoperpetuante puede ser parte de la belleza de las reacciones radicales, permitiendo que una cantidad muy pequeña de iniciador inicie de manera eficiente un proceso que luego se sostiene. No obstante, es importante que la reacción tenga un punto final, para que no siga sin control.
Hay un par de formas diferentes en las que las reacciones radicales comúnmente llegan a su fin. Estas reacciones elementales se llaman pasos de terminaciones. El evento más simple que podría ocurrir es un paso de recombinación radical. En ese caso, dos radicales se acercan entre sí y se unen, compartiendo sus electrones previamente desapareados.
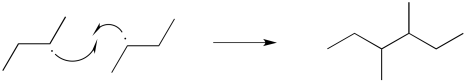
- En los pasos de terminación, dos radicales se unen para no formar radicales.
Energéticamente, pasos de terminación como este deberían ser bastante favorables, porque implican la formación de un nuevo vínculo. Estos pasos están limitados en su mayoría por la baja concentración de radicales en solución. Si dos radicales no se toparan entre sí, entonces no reaccionarán juntos.
Un segundo evento que conduce a la terminación también implica la colisión de dos radicales. Sin embargo, la trayectoria de los dos radicales es ligeramente diferente, de manera que los electrones desapareados no se conectan entre sí. En cambio, el electrón desapareado en una molécula radical encuentra un hidrógeno en la otra molécula. Si el hidrógeno es alfa al radical, se abstrae fácilmente, formando un doble enlace.
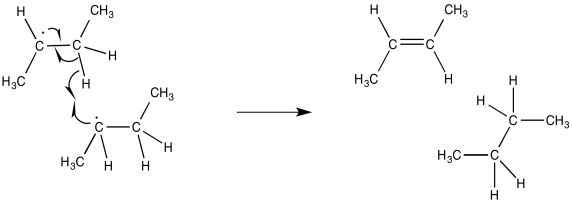
Los investigadores son realmente capaces de medir la fuerza de enlace de tal hidrógeno alfa a un radical. Encuentran que el enlace está considerablemente debilitado en comparación con un átomo de hidrógeno similar en una molécula que no contiene un radical en la misma posición.
Este sitio está escrito y mantenido por Chris P. Schaller, Ph.D., College of Saint Benedict/Saint John's University (con contribuciones de otros autores como se señaló). Está disponible gratuitamente para uso educativo.

