6.7: Sustitución radical
- Page ID
- 79206
Hay un par de reacciones clásicas basadas en la química radical que a menudo se utilizan para ilustrar diferentes consecuencias del mecanismo. Una de estas reacciones es la sustitución radical de un átomo de halógeno por un átomo de hidrógeno.
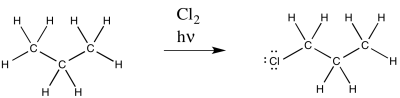
Esta reacción se observa comúnmente con cloro y bromo. Son posibles múltiples productos; solo uno de estos productos se muestra arriba.
Como reacción radical, el primer paso tendría que ser un paso de iniciación. Si la reacción procede como está escrito, mediante la adición de cloro molecular y luz, entonces la iniciación implicaría la homólisis directa del enlace cloro-cloro.
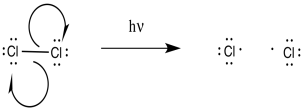
Una vez presentes los radicales cloro, se producirían etapas de propagación. Dado el reemplazo final de un hidrógeno por un átomo de cloro, parece probable la abstracción radical de un átomo de hidrógeno. Ese suceso conduciría a la formación de un radical alquilo.
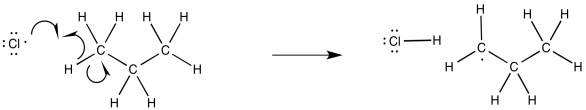
El radical alquilo recién formado también podría participar en reacciones de propagación. Por ejemplo, podría reaccionar con otra molécula de cloro. Se produciría un nuevo radical cloro y el producto de reacción, cloroproano.
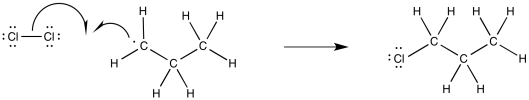
Alternativamente, si quisiéramos imaginar el rango completo de pasos elementales en las reacciones radicales, podríamos imaginar una etapa de terminación, con otro cloro combinándose con ese radical alquilo para formar un producto cloroalcano.
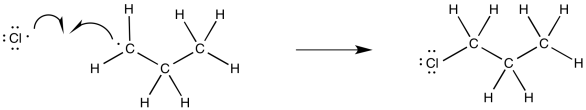
Proponer un mecanismo, con flechas curvas, para la formación de 2-cloropropano vía cloración radical.
- Responder
-
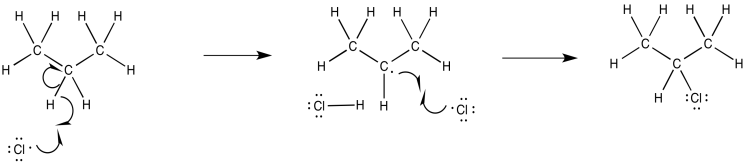
Proponer un mecanismo, con flechas curvas, para la siguiente variación en la cloración radical.
- Responder
-
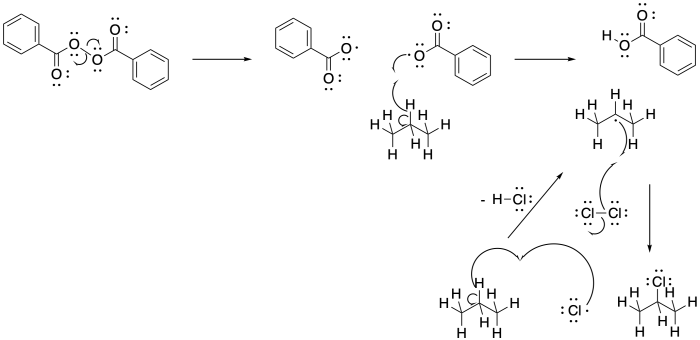
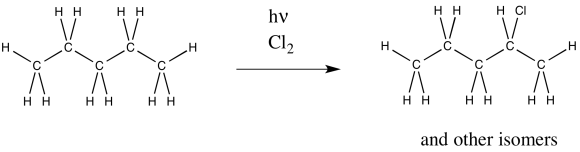
La cloración radical del pentano también da como resultado múltiples productos. A continuación se muestra una de ellas. ¿Qué otros isómeros se forman?
- Responder
-
Se muestra 2-cloropentano; también se formarían 1-cloropentano y 3-cloropentano.
¿Qué producto sería el principal en la cloración radical del propano? ¿Por qué?
- Responder
-
2-bromopropano.
Claramente, la halogenación radical podría resultar en una mezcla de productos. Eso se debe a que hay diferentes átomos de hidrógeno que podrían extraerse en el primer paso de propagación. La abstracción de un átomo de hidrógeno del carbono medio del propano conduciría en última instancia a 2-cloropropano. La abstracción de un átomo de hidrógeno de cualquiera de los carbonos finales del propano conduciría a la formación de 1-cloropropano.

