6.9: Polimerización radical
- Page ID
- 79215
La adición radical a alquenos se puede aplicar a la producción de macromoléculas. Al igual que otras reacciones de polimerización que involucran alquenos, implica la formación de un intermedio reactivo por la acción de un iniciador sobre un alqueno. Una reacción en cadena da como resultado que otros alquenos se engancha en un polímero.
El término “iniciador” aquí se usa de una manera ligeramente diferente a la que lo hemos usado con otras reacciones radicales. El iniciador radical ya ha experimentado su reacción para formar un radical. Ese radical inicia entonces el crecimiento de la cadena. Este paso es realmente un paso de propagación en términos de tipos de reacciones elementales radicales, porque un radical conduce a un nuevo radical.
El poliestireno es un ejemplo de un material que se prepara frecuentemente a través de condiciones radicales. Durante la reacción, un radical se suma al doble enlace del alqueno.
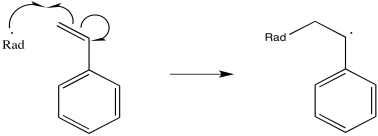
El radical recién formado, en adición regular de alquenos, reaccionaría entonces con algo para abstraer un átomo y lograr una configuración estable y de caparazón cerrado. Sin embargo, en una reacción de polimerización, las moléculas de alqueno se empaquetan intencionalmente estrechamente juntas. O están muy concentrados en solución o bien están limpios (sin ningún disolvente). Como resultado, el radical recién formado simplemente engulle otro alqueno.
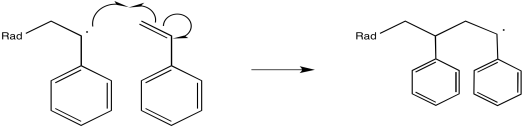
Hay muchas maneras de llevar a cabo esta reacción. Una forma sería tomar un poco de estireno, calentarlo hasta que se derrita y agregar un poco de peróxido de benzoilo.
La polimerización por radicales es un método crítico para preparar polímeros. La siguiente figura muestra una serie de monómeros que comúnmente se polimerizan bajo condiciones radicales.
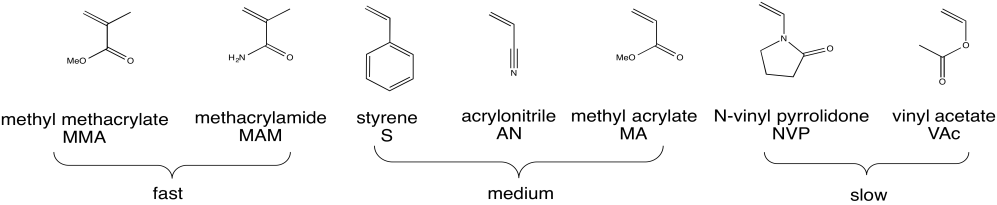
Mira los monómeros enumerados anteriormente.
- Para cada uno de los tres grupos (rápido, medio y lento), identificar qué características estructurales tienen en común los miembros del grupo que los distingue de los otros grupos.
- Proponer una razón por la cual el grupo rápido experimenta una polimerización más rápida que los otros grupos.
- Proponer una razón por la cual el grupo medio experimenta una polimerización más rápida que el grupo lento.
- Contestar a
-
a) Rápido: alquenos conjugados disustituidos
Medio: alquenos conjugados monosustituidos
Lento: alquenos monosustituidos con un heteroátomo
- Respuesta b
-
b) Rápido: el radical formado sería terciario y conjugado. Este radical estable se forma muy rápidamente.
Medio: el radical formado estaría conjugado, pero no terciario. El radical no se forma tan rápido como en el grupo anterior.
- Respuesta c
-
c) Medio: el radical formado estaría ambos conjugados. Este radical estable se forma rápidamente.
Lento: el radical formado no se conjugaría en el sentido habitual (aunque los heteroátomos próximos a los radicales sí proporcionan cierta estabilidad). El radical no se forma muy rápidamente en comparación con los radicales próximos a los dobles enlaces.
Proporcionar un mecanismo para la polimerización del estireno en presencia de peróxido de benzoilo, hasta el primer par de etapas de propagación.
- Contestar
-
El mecanismo comenzaría con la iniciación del peróxido de benzoilo.
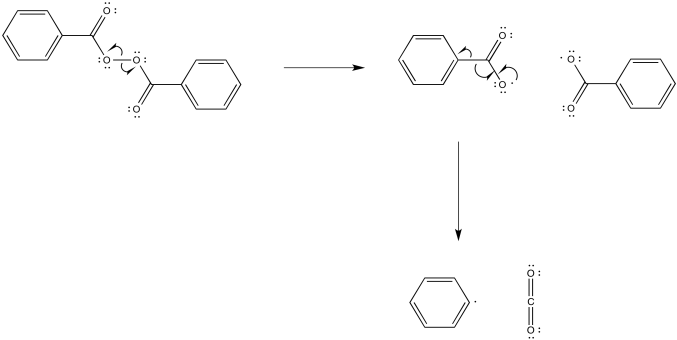
El radical fenilo resultante actúa como iniciador para la polimerización.
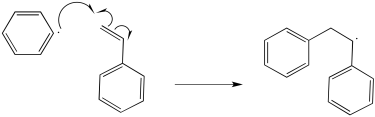
Siguen pasos adicionales de propagación.
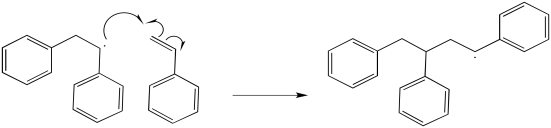
Una polimerización radical, después de que el iniciador se pone en marcha, es solo una serie de etapas de propagación seguidas. ¿Cómo se detiene todo? Debe haber una reacción de terminación. Eso puede suceder de un par de maneras diferentes.
Por ejemplo, dos cadenas en crecimiento podrían encontrarse entre sí, cara a cara. Una colisión podría unir a los electrones desapareados para formar un nuevo enlace. Dos cadenas de polímeros en crecimiento llegarían a su fin a la vez. Al mismo tiempo, la longitud de la cadena y el peso molecular se duplica ya que dos cadenas se combinan en una sola.
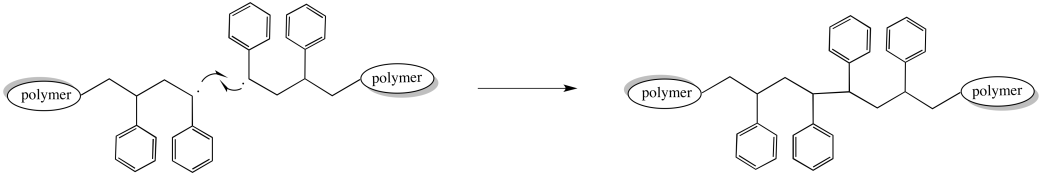
Por supuesto, la mayoría de las otras cadenas en la polimerización continúan creciendo normalmente. Como resultado, la distribución de pesos moleculares se amplía drásticamente. Algunas cadenas son el doble de largas que las otras.
Alternativamente, cuando dos cadenas en crecimiento chocan, una podría llevar a cabo una abstracción de átomos de hidrógeno en la otra. El hidrógeno extraído podría provenir de la cabeza de la cadena, alfa al radical activo. Ese enlace C-H es un poco más débil, ya que los enlaces alfa a los radicales suelen ser. La cadena que recoge el hidrógeno ya no es un radical. La cadena que pierde un hidrógeno ya no es un radical, tampoco. Ambas cadenas dejan de crecer. Debido a que otras cadenas a su alrededor continúan creciendo, estas se quedan atrás, lo que resulta en una distribución más amplia de longitudes de cadena.
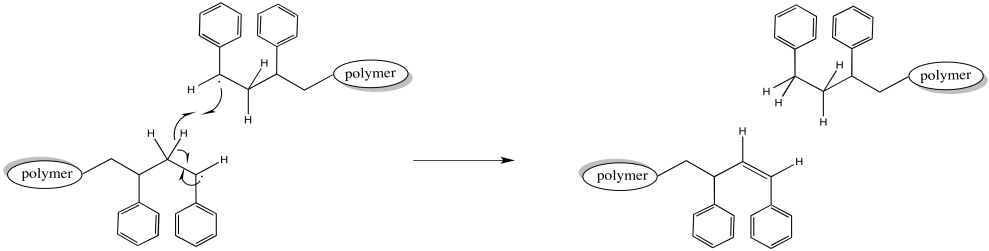
Por supuesto, una abstracción de átomos de hidrógeno podría ocurrir en otra parte de la cadena. En ese caso, la cadena que abstrayó el hidrógeno deja de crecer, como antes. Sin embargo, la cadena que perdió el hidrógeno ahora tiene dos radicales. Eso hace que dos sitios de crecimiento de la cadena. Esta cadena comienza a crecer dos veces más rápido que las demás. Eventualmente, eso va a llevar a una gran diferencia en los pesos moleculares.
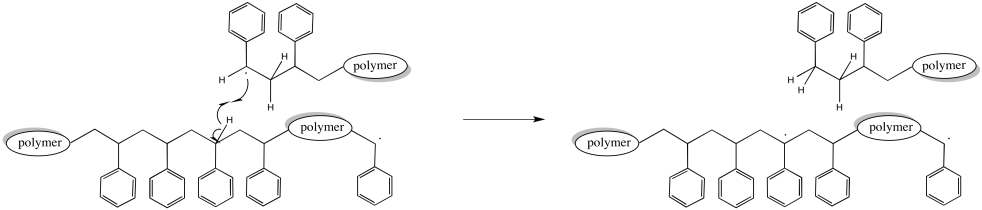
Estos eventos de terminación, todos los cuales son posibles y que ocurren más o menos aleatoriamente, tienen profundas consecuencias sobre el material producido.
Hay un efecto sobre la longitud de la cadena y el peso molecular. Las cadenas que han abstraído átomos de hidrógeno se detienen por completo. Dejan de crecer por completo. Por otro lado, las cadenas a las que se les ha robado un hidrógeno pueden volver a crecer. O tienen un radical adicional introducido, o bien forman un enlace π, que puede reaccionar con otro radical y comenzar a crecer de nuevo. Cuando lo hagan, volverá a ser el caso de que dos cadenas se unan —una activa y una macromonómero— que conduzcan a un trmendous salto en el peso molecular.
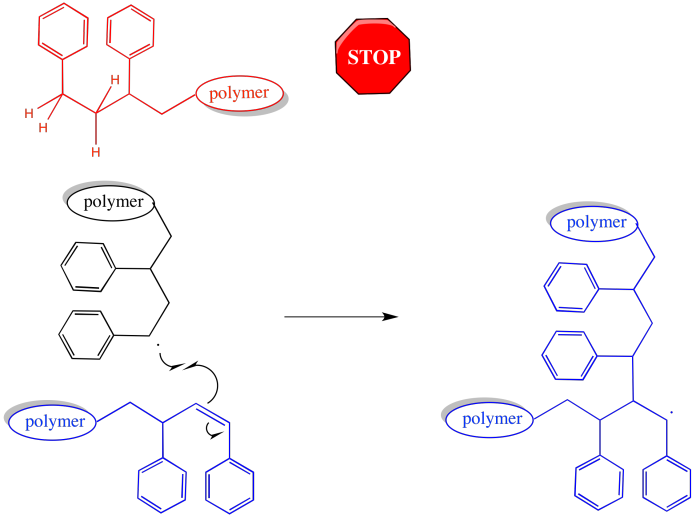
La morfología del polímero se ve claramente alterada por estos eventos. La mayoría de las cadenas en crecimiento son simplemente lineales: consisten en una serie de monómeros encadenados, todos en una fila. Sin embargo, en cualquiera de los casos en los que una cadena en crecimiento ha perdido un átomo de hidrógeno, luego continuó creciendo, la forma se ramificará.
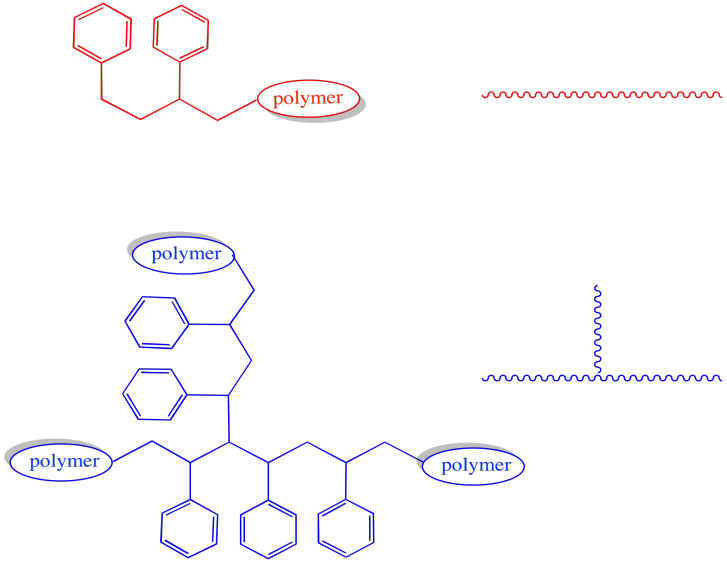
Estas dos arquitecturas tienen propiedades muy diferentes. Por ejemplo, esperaríamos una T g muy diferente en un polímero ramificado que uno lineal, con cadenas fluyendo más libremente a temperaturas más bajas en el lineal.
Se ha encontrado que la polimerización radical de estireno con un iniciador de peróxido de benzoilo sigue la ley de velocidad:
\[Rate = k[styrene][peroxide]^{1/2} \nonumber\]
Explique por qué ocurre esta ley de tasas, con base en el mecanismo.
- Contestar
-
La dependencia del monómero es sencilla: cuanto más monómero hay presente, más rápido puede ser encadenado por la creciente cadena radical.
La dependencia del iniciador es un poco más complicada, pero no mucho. Cuantas más cadenas radicales en crecimiento haya, más rápido se pueden encantar los monómeros. Cuanto más radical fenilo se forme, cada uno iniciando una nueva cadena radical, entonces más cadenas radicales crecerán.
Tasa = k [monómero] [Ph . ]
Cuanto más peróxido de benzoilo haya, más radical fenilo habrá, pero la relación no es lineal, como se explica a continuación.
El peróxido de benzoilo se escinde en dos, produciendo finalmente dos radicales fenilo:
K eq = [Ph . ] 2/[BP]
entonces [Ph . ] 2 = K eq [BP]
y [Ph . ] = K eq 1/2 [BP] 1/2
por lo tanto Tasa = k [monómero] [Ph . ] 1/2
Proporcionar mecanismos para la formación de radicales a partir de los siguientes iniciadores:
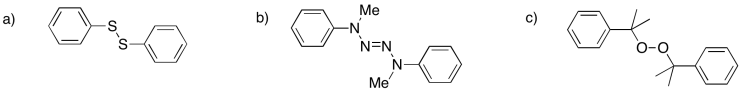
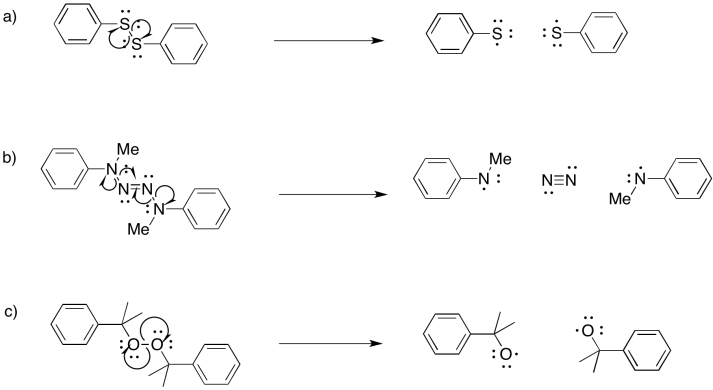
- Contestar
-
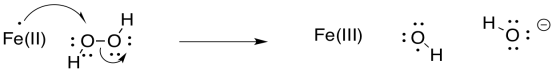
Existe un gran interés en las polimerizaciones acuosas por razones ambientales. El peróxido de hidrógeno es un iniciador soluble en agua obvio; sin embargo, es lento iniciar la polimerización. Mostrar cómo se puede acelerar la iniciación en presencia de iones Fe (II).
- Contestar
-
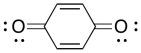
Se pueden usar varios compuestos como inhibidores de la polimerización radical. Por ejemplo, la benzoquinona impedirá que las cadenas radicales crezcan. Mostrar un mecanismo para su reacción con una cadena polimérica en crecimiento y explicar por qué el producto de la reacción es un radical relativamente estable.
- Contestar
-
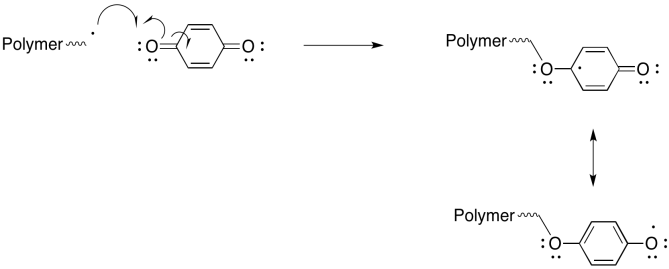
Puede ser sorprendente que uno de los inhibidores más efectivos de la polimerización radical sea el oxígeno molecular; puede ralentizar la velocidad de polimerización por un factor de decenas de miles. El radical que resulta de la adición de O 2 a una cadena en crecimiento se considera estabilizado por resonancia. Mostrar el mecanismo de adición de O 2 y demostrar estabilidad de resonancia en el producto.
- Contestar
-
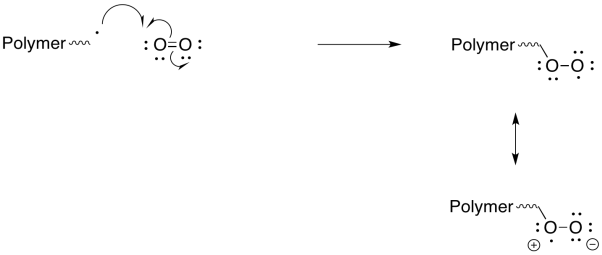
Los radicales peroxi son relativamente estables y reaccionan lentamente. Sin embargo, cuando reaccionan, también experimentan reacciones distintas a la polimerización radical, de manera que son aún más eficaces como inhibidores de la polimerización.

