6.10: Pomerización por radicales vivos
- Page ID
- 79207
Las reacciones de polimerización en cadena dan como resultado la conversión eficiente de monómeros en polímeros de alto peso molecular. Sin embargo, los eventos de terminación de cadena resultan en una ampliación del índice de polidispersidad del material. En otras palabras, en lugar de producir un material compuesto por moléculas que tienen aproximadamente el mismo peso molecular, resulta una amplia gama de tamaños de moléculas. Algunas de las cadenas son muy cortas y otras muy largas. Eso es un problema, porque la longitud de la cadena (y la propiedad asociada, el peso molecular) influyen fuertemente en las propiedades del material. Si no se controla el tamaño de las moléculas, tampoco lo son las propiedades. Si no se controlan las propiedades, el material no se desempeñará de manera confiable en su aplicación prevista.
El grado de polimerización de un polímero es simplemente el número promedio de monómeros incorporados en cada cadena polimérica. Dadas las siguientes “relaciones de alimentación” (relaciones de monómero a iniciador), ¿cuál es el grado esperado de polimerización en cada caso?
- metacrilato de metilo: AIBN 500:1
- estireno: peróxido de benzoilo 1000:1
- acrilonitrilo: peróxido de terc-butilo 600:3
- Contestar a
-
Debido a que cada iniciador se rompe por la mitad, formando dos radicales, un iniciador inicia dos cadenas de crecimiento. Cada iniciador consumirá, en promedio, la mitad de los monómeros, suponiendo que no haya eventos inesperados de terminación de cadena
a) DP = 500 monómeros/2 cadenas de crecimiento = 250
- Respuesta b
-
Debido a que cada iniciador se rompe por la mitad, formando dos radicales, un iniciador inicia dos cadenas de crecimiento. Cada iniciador consumirá, en promedio, la mitad de los monómeros, suponiendo que no haya eventos inesperados de terminación de cadena
b) DP = 1000 monómeros/2 cadenas de crecimiento = 500
- Respuesta c
-
Debido a que cada iniciador se rompe por la mitad, formando dos radicales, un iniciador inicia dos cadenas de crecimiento. Cada iniciador consumirá, en promedio, la mitad de los monómeros, suponiendo que no haya eventos inesperados de terminación de cadena
c) DP = 600 monómeros/3 cadenas de crecimiento = 200
El grado de polimerización medido indica el peso molecular promedio en número del polímero (M n). Calcular M n en cada uno de los siguientes casos.
- poliestireno, con DP = 1250
- polimetacrilamida, con DP = 725
- poli (acrilato de metilo), con DP = 1420
- Contestar a
-
M 0 = peso molecular del monómero en cada caso. 1 D (Dalton) = 1 amu
a) M n = DP x M 0 = 1250 x 104 D = 130,000 D = 130 kD
Tenga en cuenta que los grupos finales fueron descuidados en estos cálculos; pueden aportar un porcentaje significativo del peso molecular total a menor DP. Un cálculo más preciso contabilizaría la identidad de ambos grupos finales.
- Respuesta b
-
M 0 = peso molecular del monómero en cada caso. 1 D (Dalton) = 1 amu
b) M n = DP x M 0 = 725 x 85 D = 61.625 D = aproximadamente 62 kD
Tenga en cuenta que los grupos finales fueron descuidados en estos cálculos; pueden aportar un porcentaje significativo del peso molecular total a menor DP. Un cálculo más preciso contabilizaría la identidad de ambos grupos finales.
- Respuesta c
-
M 0 = peso molecular del monómero en cada caso. 1 D (Dalton) = 1 amu
c) M n = DP x M 0 = 1420 x 86 D = 122,120 D = aproximadamente 122 kD
Tenga en cuenta que los grupos finales fueron descuidados en estos cálculos; pueden aportar un porcentaje significativo del peso molecular total a menor DP. Un cálculo más preciso contabilizaría la identidad de ambos grupos finales.
Alternativamente, si se mide el peso molecular promedio en número del polímero, ese resultado se puede usar para establecer el grado de polimerización. ¿Qué es DP en cada uno de los siguientes casos?
- poliacrilonitrilo, con M n = 11,450 D
- poli (acetato de vinilo), con M n = 24,760 D
- poliestireno, con M n = 927,000 D
- Contestar a
-
a) DP = M n/M 0 = 11,450 D/53 D = 216
- Respuesta b
-
b) DP = M n/M 0 = 24.760 D/86 D = 288
- Respuesta c
-
c) DP = M n/M 0 = 927,000 D/104 D = 8,914
La polimerización viva se refiere a procesos en los que no se produce una terminación inesperada de la cadena. La cadena sigue creciendo y creciendo mientras se suministre más monómero. En casos extremadamente resistentes, a veces se usa el término polimerización “inmortal”.
Típicamente, las estrategias para la polimerización viva implican controlar la reactividad de los intermedios. Frecuentemente, la concentración de las cadenas de cultivo se mantiene baja. Si la concentración de cadenas de crecimiento se mantiene baja, entonces las reacciones secundarias inesperadas que involucran a la cadena de crecimiento reactiva se mantendrán al mínimo.
En la polimerización radical, las cadenas de crecimiento con radicales en sus extremos de crecimiento estarán rodeadas de monómeros. Los radicales devoran y encierran los monómeros a medida que se mueven a través del medio de reacción.
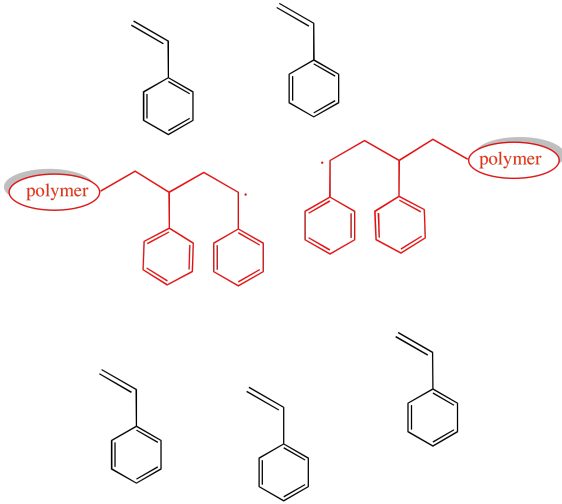
Los eventos típicos de terminación de cadena en la polimerización radical implican la colisión de dos cadenas en crecimiento. Ese evento podría resultar en la recombinación radical cabeza a cabeza, la formación de un doble enlace a través de la abstracción de hidrógeno en la cabeza de una cadena (“mordeduras de cabeza”) o la formación de un nuevo radical a lo largo de la columna vertebral del polímero (“backbiting”).
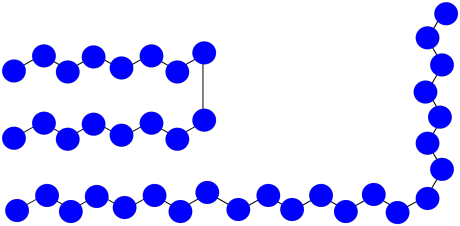
Supongamos que tiene tres cadenas de polímero en crecimiento. Los monómeros tienen peso molecular = 100 D. Cada cadena tiene actualmente 8 unidades repetidas de longitud.
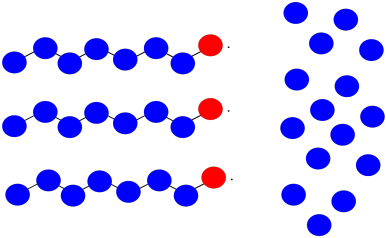
- ¿Cuál es el peso molecular actual de cada cadena?
- Si 15 monómeros permanecen en solución, ¿cuál es el grado esperado de polimerización de cada cadena, suponiendo que todos crezcan a la misma velocidad?
- ¿Cuál es el peso molecular promedio esperado?
- ¿Cuál es el PDI esperado?
- Supongamos que dos de las cadenas se unen en un paso de terminación. ¿Cuál será el peso molecular de la nueva cadena?
- Si la tercera cadena sigue creciendo, ¿qué peso molecular alcanzará?
- ¿Cuál será el peso molecular promedio?
- ¿Cuál será el PDI (supongamos que es solo la relación entre el peso molecular más grande y el más pequeño)?
- Contestar a
-
a) MW = 8 x 100 D = 800 D
- Respuesta b
-
b) 15 monómeros/3 cadenas = 5 nuevos monómeros/cadena
DP = 8 + 5 = 13
- Respuesta c
-
c) MW = 13 x 100 D = 1,300 D
- Respuesta d
-
d) Todas las cadenas tienen la misma longitud; PDI = 1.0
- Respuesta e
-
e) MW = 16 x 100 D = 1,600 D
- Respuesta f
-
f) MW = (8 + 15) x 100 D = 2,300 D
- Respuesta g
-
g) M n = (2,300 + 1,600 D)/2 = 1,950 D
- Respuesta h
-
h) PDI = 2,300 D/1,600 D = 1.44
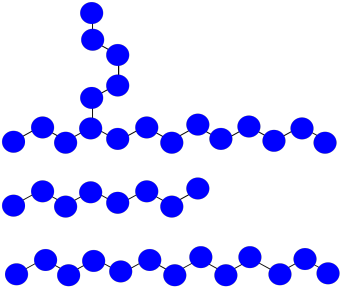
Supongamos que una vez más tienes tres cadenas poliméricas en crecimiento. Los monómeros tienen peso molecular = 100 D. Cada cadena tiene actualmente 8 unidades repetidas de longitud.
Esta vez, una cadena abstrae un átomo de hidrógeno de la cadena principal de otra. La primera cadena está terminada; la segunda tiene ahora dos sitios de crecimiento. Los tres sitios continúan creciendo al mismo ritmo.
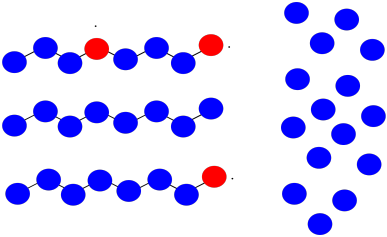
- ¿Cuál será el peso molecular de cada cadena?
- ¿Cuál será el peso molecular promedio?
- ¿Cuál será el PDI (supongamos que es solo la relación entre el peso molecular más grande y el más pequeño)?
- Contestar a
-
a) La cadena que abstrayó el hidrógeno: MW = 8 x 100 D = 800 D
La cadena ramificada: MW = 18 x 100 D = 1,800 D
La cadena normal: MW = 13 x 100 D = 1,300 D
- Respuesta b
-
b) M n = (1,800 + 1,300 + 800 D)/3 = 1,300 D
- Respuesta c
-
c) PDI = 1,800/800 D = 2.25
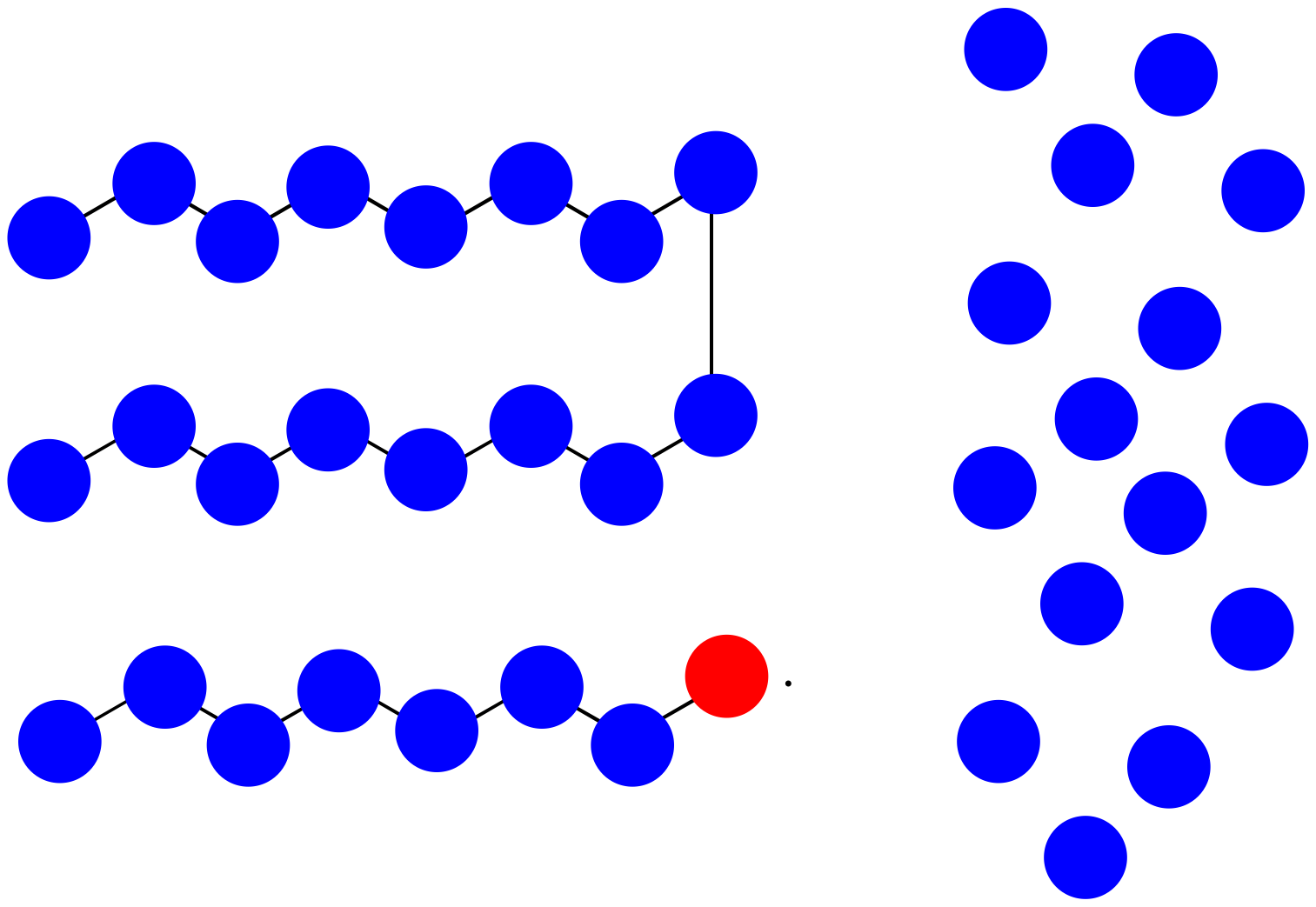
Prácticamente, los polímeros se purifican por precipitación y lavado después de que se preparan. Eso significa que los oligómeros muy cortos son lavados.
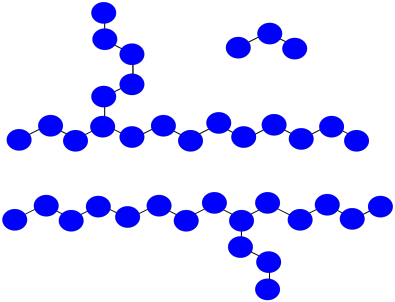
- ¿Cuál es el peso molecular promedio de la mezcla impura mostrada anteriormente, asumiendo que cada monómero tiene un peso molecular = 100 D?
- Después de la precipitación y el lavado, si se lavan los oligómeros pequeños, ¿cuál es el peso molecular promedio del polímero aislado?
- Contestar a
-
a) M n = (1,700 + 1,800 + 300 D)/3 = 3,800 D/3 = 1,267 D
- Respuesta b
-
b) M n = (1,700 + 1,800 D)/2 = 3,500 D/2 = 1,750 D
Si la concentración de las cadenas de crecimiento es limitada, entonces la probabilidad de que ocurra alguno de estos eventos también es limitada.
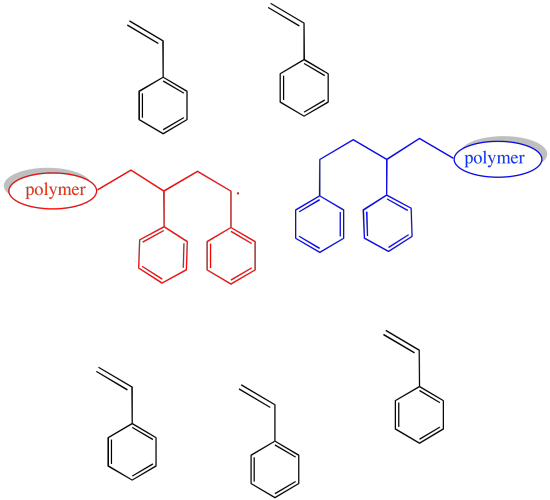
Ciertamente, la tasa de crecimiento de la cadena también se ralentiza cuando se baja la concentración de las cadenas en crecimiento. Ese es el precio a pagar por un funcionamiento sin problemas.
La clave para la polimerización radical viva es detener reversiblemente el crecimiento de la cadena, enviando una cadena polimérica de un estado activo a un estado latente. Mientras que en el estado latente, es menos probable que la cadena de polímero sufra eventos aleatorios de terminación de cadena. Tampoco puede crecer hasta que vuelva a estar en estado activo.
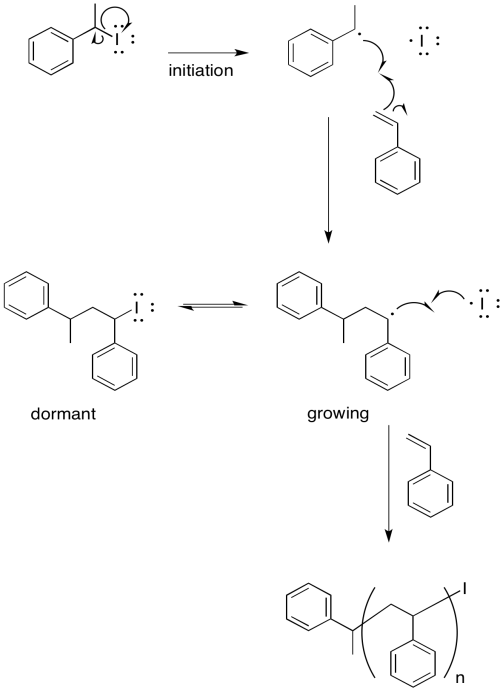
Un intento temprano de polimerización viva empleó un iniciador de yoduro de alquilo. La iniciación térmica (iniciación por calentamiento) resultó en un radical alquilo reactivo y un átomo de yodo.
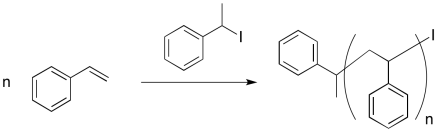
Proporcionar un mecanismo para la polimerización de estireno, asegurándose de mostrar los siguientes puntos:
- iniciación
- propagación
- recombinación con átomo de yodo
- una cadena en crecimiento
- una cadena “latente” que podría reiniciarse y comenzar a crecer de nuevo, pero que actualmente está a salvo de la terminación aleatoria
- Contestar
-
Investigadores de IBM encontraron que la polimerización del poliestireno procedió mucho más suavemente cuando TEMPO, un radical relativamente estable, se añadió a la reacción. La reacción también avanzó más lentamente, dando como resultado un menor peso molecular global del polímero. Sin embargo, la distribución del peso molecular fue mucho más uniforme. Todas las cadenas eran de tamaños similares, relativamente hablando. Como resultado, las propiedades del material fueron mucho más controladas.
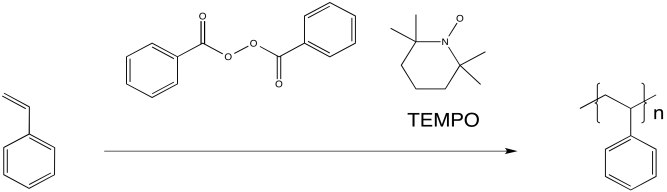
TEMPO ayuda a controlar la polimerización formando un enlace reversible con el extremo creciente de la cadena polimérica. El radical en TEMPO se combina con el radical en la cabeza del polímero para formar un enlace C-O. El enlace puede romperse nuevamente (inusualmente, para un enlace C-O), permitiendo que la cadena polimérica vuelva a crecer periódicamente.
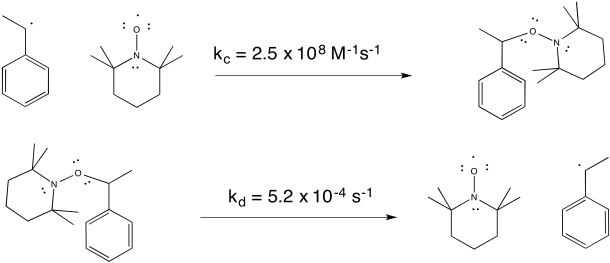
Dos de los métodos más comunes para inducir la polimerización radical viva son RAFT y ATRP. RAFT significa polimerización por fragmentación de átomos radicales. Al igual que la reacción TEMPO, implica una recombinación radical reversible para formar un enlace covalente. RAFT fue desarrollado por un grupo de químicos australianos a fines de la década de 1990, entre ellos Enzio Rizzardo, Graeme Moad y San Thang de la agencia nacional de ciencia de Australia, CSIRO. ATRP significa polimerización radical por transferencia de átomos. Fue desarrollado a mediados de la década de 1990 por Krysztof Matyjaszewski en Carnegie Mellon en Pittsburgh y su asociado postdoctoral, Jin-Shan Wang, ahora en la Universidad Jiao Tong de Shanghai. Un descubrimiento independiente del método fue realizado por Mitsuo Sawamoto en la Universidad de Kyoto en Japón.
RAFT emplea más comúnmente un tioéster (o compuesto similar) como agente de transferencia de cadena. El agente de transferencia de cadena intercepta una cadena de polímero en crecimiento, pero lo hace de manera reversible.
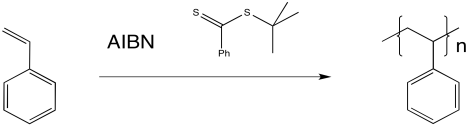
El tioéster puede reaccionar con un radical, colocando la cadena en crecimiento en estado latente. También puede liberar un nuevo radical, que luego puede iniciar la polimerización. Eventualmente, regulará el crecimiento de dos cadenas poliméricas.
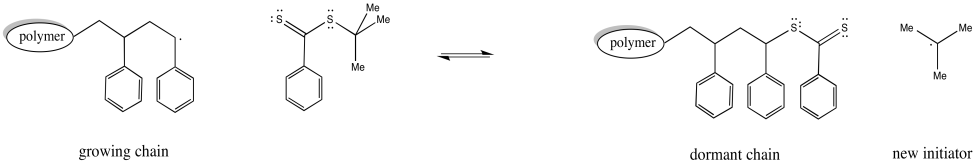
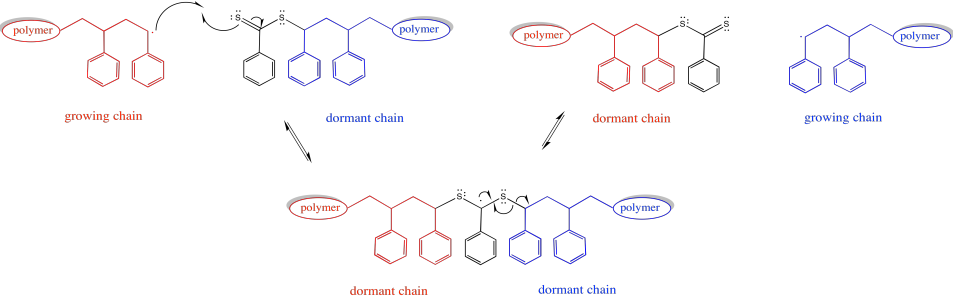
Además, una tercera especie presente en equilibrio mantiene ambas cadenas latentes. El agente de transferencia de cadena puede liberar reversiblemente una de estas cadenas latentes a la vez.
Proporcionar un mecanismo para la conversión de una cadena de crecimiento en una cadena inactiva a través de RAFT.
- Contestar
-
En ATRP, un proceso similar trabaja para mantener una fracción de las cadenas en estado latente. Un componente clave de este método es un complejo de cobre (I).
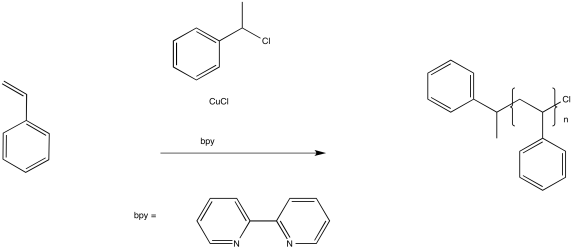
El papel del complejo de cobre (I) es transferir un electrón a una especie inactiva, produciendo una especie de cobre (II) y un radical. Por ejemplo, en el inicio de la reacción anterior, el Cu (I) transfiere un electrón al haluro de alquilo para convertirse en Cu (II). A su vez, el átomo de cloro en el haluro de alquilo se convierte en anión cloruro, Cl -, y la porción alquilo se deja como un radical iniciador.

Una de las razones por las que ATRP es tan importante es que proporciona una manera muy confiable y económica de controlar la polimerización. Además, se puede adaptar a una amplia gama de procesos útiles. Por ejemplo, Matyjaszeski ha desarrollado métodos para controlar electroquímicamente la reacción; la polimerización puede literalmente encenderse y apagarse con un interruptor. Yusuf Yagci y compañeros de trabajo de la Universidad Técnica de Estambul desarrollaron un proceso ATRP fotoinducido, en el que la polimerización comienza cuando se encienden las luces y se detiene cuando oscurece. Otros investigadores, entre ellos el laboratorio Hawker de la UCSB, también han promovido la utilidad de este enfoque.
Proporcionar un mecanismo de iniciación usando ATRP.
- Contestar
-
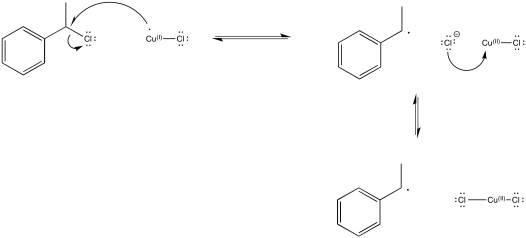
Proporcionar un mecanismo para la conversión de una cadena en crecimiento en una cadena latente usando ATRP.

