7.2: Complejo I
- Page ID
- 79343
El complejo I es una colección de proteínas que sirve como uno de los dos puntos de entrada a la fosforilación oxidativa; el otro es el complejo II. Ambos complejos aceptan electrones de moléculas producidas en el catabolismo de la glucosa. Al trasladar estos electrones de un aceptor de electrones a otro, generalmente moviéndose a un mayor potencial (recuerde, en terminología redox, eso significa menor energía) el ensamblaje de proteínas que participan en la fosforilación oxidativa son capaces de producir ATP. El ATP, a su vez, se utiliza para impulsar otros procesos metabólicos.
Los principales eventos del Complejo I se resumen en la caricatura a continuación. Se pueden ver los electrones entrando desde la matriz en la parte inferior de la imagen (el camino se muestra por las flechas azules). Son entregados por el NADH y entregados a FMN; este paso se discutirá a continuación. Los electrones se transfieren a través de la transferencia de electrones de la esfera externa a través de una serie de agregados de hierro y azufre y finalmente se entregan a la ubiquinona soluble en lípidos (Q).
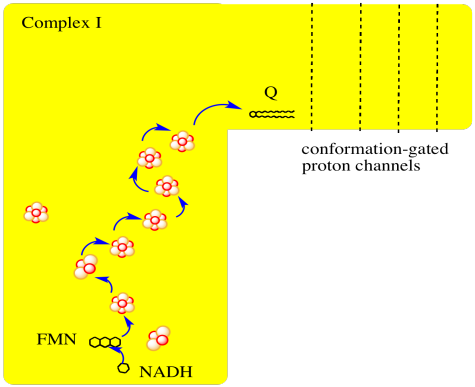
- El complejo I marca el inicio de la cadena de transporte de electrones.
- Los electrones se entregan del NADH, pasan por el Complejo I y finalmente llegan a una ubiquinona.
- La energía liberada durante el transporte de electrones ayuda a bombear protones a través del complejo.
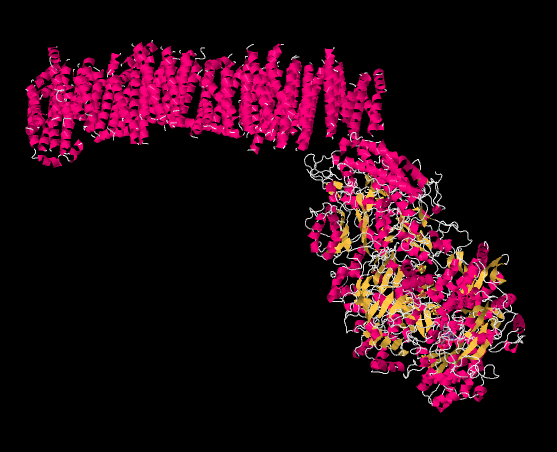
La siguiente imagen es de una estructura cristalina de rayos X del Complejo I (la fuente de los datos se cita al final de esta página). En lugar de mostrar cada átomo, que es el resultado habitual de una estructura cristalina, los datos se muestran en forma de “caricatura”, para que puedas tener una mejor idea de la estructura general. La imagen también está codificada por colores para ayudarte a ver las estructuras con mayor claridad. Las hélices rosadas (espirales) a lo largo de la parte superior son la porción del complejo que se une en la membrana mitocondrial interna. La membrana, también, extendería acorss la parte superior de la imagen de izquierda a derecha. Es fácil imaginar el haz paralelo de hélices α-encajando muy bien en medio de la matriz paralela de fosfolípidos que forman la membrana. La forma en forma de huevo, amarilla y rosa en la parte inferior derecha es la parte del complejo que se extiende hacia la matriz mitocondrial. Las porciones amarillas indican β-hojas, mientras que los hilos blancos indican bucles.
Ejercicio\(\PageIndex{1}\)
Es probable que se encuentren aminoácidos específicos a lo largo de las hélices α-que se unen en la membrana. Indicar diferentes posibilidades a continuación.

- Contestar
-

En el caso del Complejo I, los electrones se introducen en forma de NADH. Los electrones viajan a través del Complejo I y eventualmente son entregados a la ubiquinona; la ubiquinona lleva los electrones a la siguiente etapa del supercomplejo de fosforilación oxidativa, que es el Complejo III. Debido a que el Complejo I toma electrones del NADH y los entrega a la ubiquinona, el Complejo I también se conoce como “NADH:ubiquinona oxidorreductasa”.
El NADH se produce durante la glucólisis y el ciclo de TCA. Recuerde, el NADH es un donante de dos electrones: dona un ion hidruro a un sustrato, convirtiéndose en NAD +. Un ion hidruro, por supuesto, es solo un protón y dos electrones.
- El NADH se produce en la glicólisis y el ciclo de TCA entrega un par de electrones al Complejo I.
- El NADH se entrega al complejo I desde la matriz mitocondrial (en el interior de la mitocondria).
Con mucho, el aceptor de electrones más común en el supercomplejo de fosforilación oxidativa es un átomo de hierro. Por supuesto, los estados de oxidación más comunes para los iones de hierro son Fe 2+ y Fe 3+. Un hierro en el estado de oxidación 3+ es capaz de aceptar un electrón, convirtiéndose en Fe 2+. En contraste, un hierro en el estado de oxidación 2+ podría pasar un electrón, convirtiéndose en Fe 3+ en el proceso.
Imagínese una brigada de cubos, en la que las personas que pasan cubos de agua de una a otra actúan juntas para apagar un incendio. Los átomos de hierro actúan de manera muy similar, cada uno pasando un electrón al siguiente para completar la cadena de transporte de electrones.
- El transporte de electrones se realiza a través de muchos pasos pequeños en lugar de unos pocos pasos grandes.
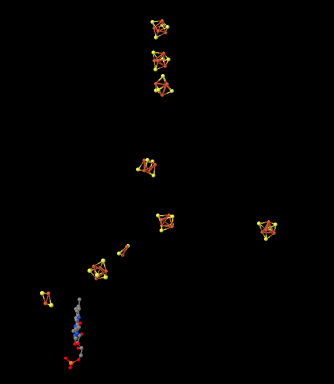
Si quitamos las proteínas del Complejo I, podemos obtener una imagen de algunas de las otras piezas que hay dentro. Al observar los datos de la estructura cristalina de rayos X, podemos simplemente ignorar cada átomo de la proteína, hasta que nos quedemos con los “ligandos”. En bioquímica, ligandos significa la materia unida a las proteínas (a diferencia de en la química inorgánica, donde significa la materia unida a los metales). Eso es lo que vemos a continuación. Las formas rojas y amarillas que ves son complejos de sulfuro de hierro, ensartados para que puedan pasar electrones a lo largo del Complejo I. Las piezas que vemos aquí se encuentran dentro de la parte hidrófila del Complejo I; es decir, se encuentran dentro de la parte amarilla y rosa en forma de huevo vista en la estructura anterior. Esta imagen está orientada en la misma dirección que la anterior; los complejos de hierro se extienden desde la parte inferior del dominio hidrófilo hasta el borde de la porción hidrófoba unida a la membrana del complejo.

Entonces, tenemos un “cable” para llevar los electrones a través del complejo después de que sean entregados por el NADH. Sin embargo, tenemos un problema de desajuste. El NADH es un donador de dos electrones. Un ion Fe 3+ es un aceptor de un electrón. Necesitamos un adaptador para esta conexión eléctrica. El adaptador viene en forma de FMN. FMN es la estructura con algunos átomos coloreados en azul y rojo cerca de la esquina inferior derecha de la imagen.
- El NADH sólo dona dos electrones a la vez.
- Los iones de hierro en la cadena de transporte de electrones pueden alternar entre Fe (III) y Fe (II); pueden aceptar solo un electrón a la vez.
- Se necesita un adaptador para convertir la transferencia de dos electrones en transferencia de un electrón.
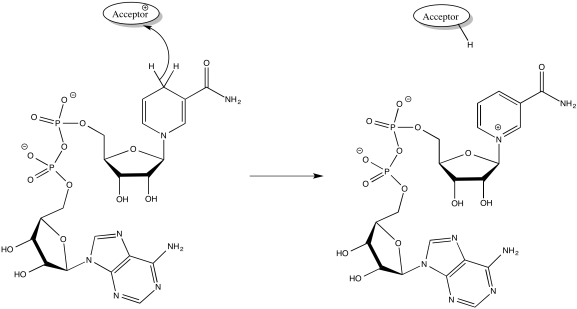
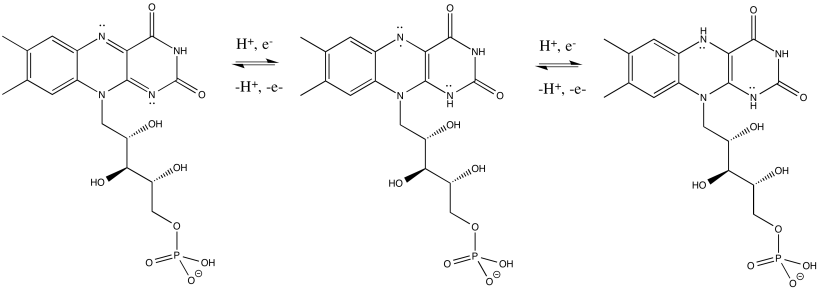
FMNH2 poco a poco similar a NADH. Su forma oxidada, FMN, puede aceptar dos electrones y un protón en forma de ion hidruro, así como un protón adicional. Es decir, FMN acepta H - y H + para convertirse en FMNH2. Sin embargo, una ruta ligeramente diferente está disponible para FMN. También puede sufrir reducción de un electrón a la vez. En realidad, la adición de un electrón estaría poco precedida o seguida poco después de la adición de un protón, con el fin de mantener igual la carga general. Este estado, FMNH, se llama la forma semiquinona.
¿Cuál es la diferencia entre NAD y FMN? ¿Por qué uno es capaz de aceptar solo un par de electrones, mientras que el otro puede aceptar uno a la vez? Cuando FMN acepta un electrón, se convierte en radical. Los radicales son especies inestables y reactivas. Se pueden estabilizar principalmente por deslocalización. La conjugación adicional en FMN en comparación con NAD permite que el electrón impar se deslocalice más extensamente en FMN. Esa estabilidad radical es la diferencia clave.
- La presencia de conjugación extendida estabiliza un radical en FMNH.
- La estabilidad de este radical permite que FMN acepte un electrón a la vez.
Ejercicio\(\PageIndex{2}\)
Proporcionar un mecanismo para la conversión de FMN a FMNH2 en presencia de NADH y una cadena lateral de lisina, a pH 7.
- Contestar
-
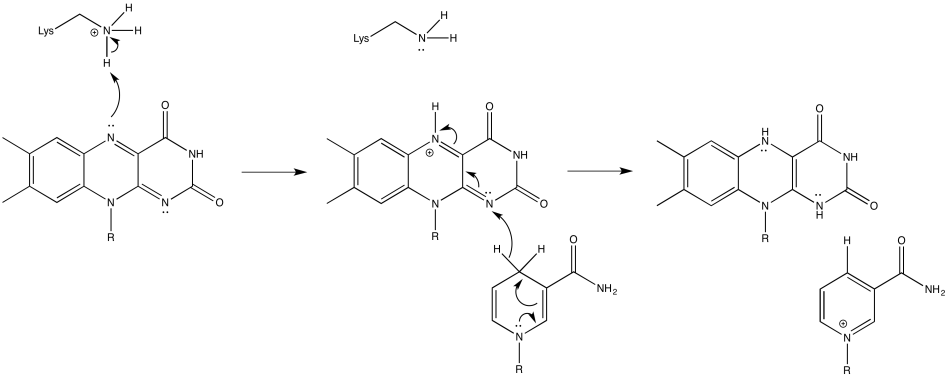
Una vez que FMNH2 se ha formado, lo contrario es cierto, por supuesto. Puede renunciar a un electrón a la vez. Como resultado, FMN puede tomar un par de electrones que vienen del NADH y enviarlos uno a la vez a la cadena de transporte de electrones.
El resto de la cadena de transporte de electrones a través del Complejo I es una serie de conglomerados de hierro-azufre. Como su nombre indica, estos racimos consisten en átomos de hierro y azufre. La variedad más común contiene cuatro átomos de hierro y cuatro átomos de azufre dispuestos en las esquinas de un cubo. Estos racimos a menudo se denominan clústeres 4Fe4S por razones obvias: hay 4 átomos de hierro y 4 átomos de azufre. Los átomos de azufre en las esquinas son realmente iones sulfuro, S 2-. Además de los tres iones azufre, cada uno de los átomos de hierro también está unido a un residuo aniónico de cisteína, de manera que el hierro tiene geometría de coordinación tetraédrica. Los átomos de hierro están presentes como una combinación de iones Fe 2+ y Fe 3+.
- Los conglomerados de hierro y azufre son muy comunes en el transporte biológico de electrones.
- Los iones de hierro pueden ser Fe (II) o Fe (III).
- Los ligandos para los iones hierro incluyen iones sulfuro, S2-.
- Los agregados de sulfuro de hierro generalmente se mantienen en su lugar en la proteína por ligandos de cisteína (CyS -).
Aquí hay otra visión de los ligandos, vista desde un punto de vista diferente esta vez. Consulta si puedes encontrar un grupo de cuatro átomos de hierro (de color rojo) unidos con cuatro átomos de azufre (de color amarillo).
Hay otras variaciones de racimos de FE. Uno muy común es un cúmulo de 2Fe2S, que por supuesto consiste en dos átomos de hierro y dos iones sulfuro en esquinas alternas de un diamante. Hay un par de estos racimos visibles en la imagen de arriba. Nuevamente, los átomos de hierro podrían ser iones Fe 2+ o Fe 3+, o uno de cada uno. Además, cada hierro suele estar unido a dos aniones cisteína adicionales para completar una geometría tetraédrica. Esos grupos no se muestran aquí, sin embargo, porque hemos dejado la proteína fuera de la imagen. (Veremos eventualmente que otros aminoácidos ocasionalmente se unen a los racimos de hierro y azufre en lugar de la cisteína).
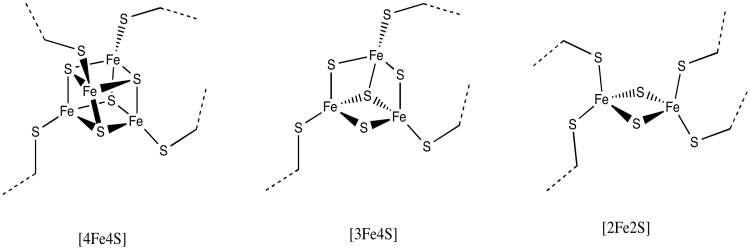
Otra posibilidad es un cúmulo de 3Fe4S, un asunto de lados sueltos en el que uno de los átomos de hierro se deja esencialmente fuera del cubo de FeS.
Ejercicio\(\PageIndex{3}\)
Suponiendo que un hierro esté presente como Fe (III) y el resto como Fe (II), calcule los cargos generales sobre:
a) 2Fe2S b) 3Fe4S c) 4Fe4S
- Contestar a
-
a) Cargas de hierro: Fe (II) + Fe (III) = 5 +
Cargas de ligando: 2 sulfuros = 2 x 2 - = 4 -; 4 cisteínas = 4 x 1 - = 4 -; total = 8 -
En general: 3 -
- Respuesta b
-
b) Cargas de hierro: 2 x Fe (II) + Fe (III) = 4 + + 3 + = 7 +
Cargas de ligando: 4 sulfuros = 4 x 2 - = 8 -; 3 cisteínas = 3 x 1 - = 3 -; total = 11 -
En general: 4 -
- Respuesta c
-
c) Cargas de hierro: 3 x Fe (II) + Fe (III) = 6 + + 3 + = 9 +
Cargas de ligando: 4 sulfuros = 4 x 2 - = 8 -; 4 cisteínas = 4 x 1 - = 4 -; total = 12 -
En general: 3 -
Ejercicio\(\PageIndex{4}\)
El ambiente juega un papel en la modulación de los potenciales de reducción en las proteínas. Supongamos que un cúmulo de 2Fe2S estaba en un estado mixto de oxidación Fe (II)/(III). ¿Cómo se compararía su potencial de reducción cuando está rodeado de residuos de aminoácidos no polares con su potencial de reducción cuando está rodeado de residuos de aminoácidos polares?
- Contestar
-
Al reducirse, la carga en un clúster de 2Fe2S aumentará de 3 - a 4 -, asumiendo que inicia en un estado mixto Fe (II)/(III) (mientras que si inicia en un estado Fe (III)/(III), la carga general aumentará de 2 - a 3 -). Estos aniones serían estabilizados por fuertes interacciones intermoleculares tales como fuerzas ión-dipolo. Ambos estados (oxidado y reducido) serán estabilizados por un ambiente polar, pero el estado reducido más cargado dependerá aún más fuertemente de la estabilización por parte del medio ambiente. Como resultado, podríamos esperar que el potencial de reducción sea menor cuando esté rodeado de residuos de aminoácidos no polares, y mayor si está rodeado de residuos polares.
Hay toda una serie de estos cúmulos en el Complejo I. Los electrones entregados del NADH se envían de uno a otro y luego al siguiente. Hay un par de razones para este arreglo.
Debido a que estos cúmulos están todos unidos en su lugar por la proteína —completamente inmovilizada—, la transferencia de electrones tiene que ocurrir a través de un mecanismo de esfera externa. ¿Por qué hay tantos clusters? Recuerde, las transferencias de electrones de la esfera exterior tienen un rango limitado. El electrón, en la mayoría de las circunstancias, sólo puede saltar hasta el momento. Al proporcionar una serie de grupos de FE conductores, el electrón puede saltar de uno a otro, dispuestos como escalones a través de un río.
No solo eso, sino que la cadena de transporte de electrones toma electrones del NADH y los entrega, en última instancia, al oxígeno molecular en el Complejo IV. El oxígeno molecular se convierte en agua. Ese traslado del NADH al agua es muy exotérmico. La reacción es muy cuesta abajo en energía. Para que esta transferencia sea prácticamente factible, y para aprovechar la enorme cantidad de energía involucrada, se permite que los electrones den un paso cuesta abajo poco a poco.
Ocasionalmente, los electrones pueden incluso saltar ligeramente hacia arriba, recuperando la energía que se ha perdido en los alrededores en transferencias anteriores. Este efecto de amortiguación puede hacer que todo el proceso sea más eficiente. Aún así, los electrones en general están rodando cuesta abajo energéticamente. Un electrón puede saltar cuesta arriba algunas veces, pero eventualmente esos saltos cuesta arriba serán seguidos por una caída cuesta abajo, de modo que en general el electrón se ha movido a una energía más baja.
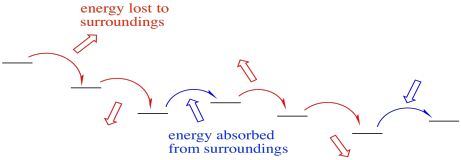
- Una transferencia de electrones cuesta arriba ocasional absorbe energía.
- La reabsorción aumenta la eficiencia al prevenir la pérdida de calor.
En el Complejo I, el destino final para la cadena de transporte de electrones es una ubiquinona, a veces abreviada como Q o UQ. Al igual que FMN, UQ es un aceptor de dos electrones, dos protones, para convertirse en UQH2. También como FMN, UQ puede aceptar un protón y un electrón a la vez, para formar la forma semiquinona, UQH. Una vez más, esta es una especie radical.
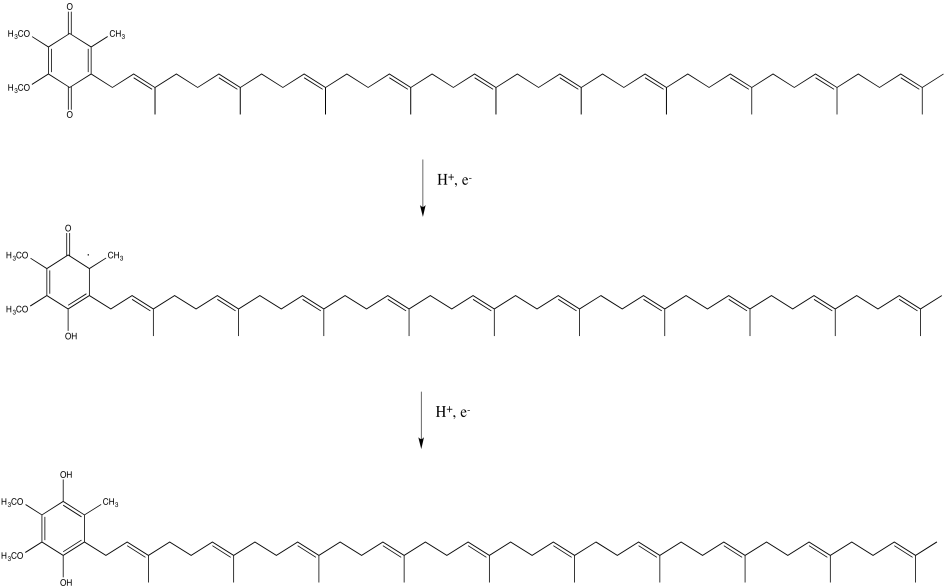
Ejercicio\(\PageIndex{5}\)
Proporcionar un mecanismo para la conversión de UQ a UQH2 en presencia de iones Fe 2+ y cadenas laterales de lisina, a pH 7.
- Contestar
-
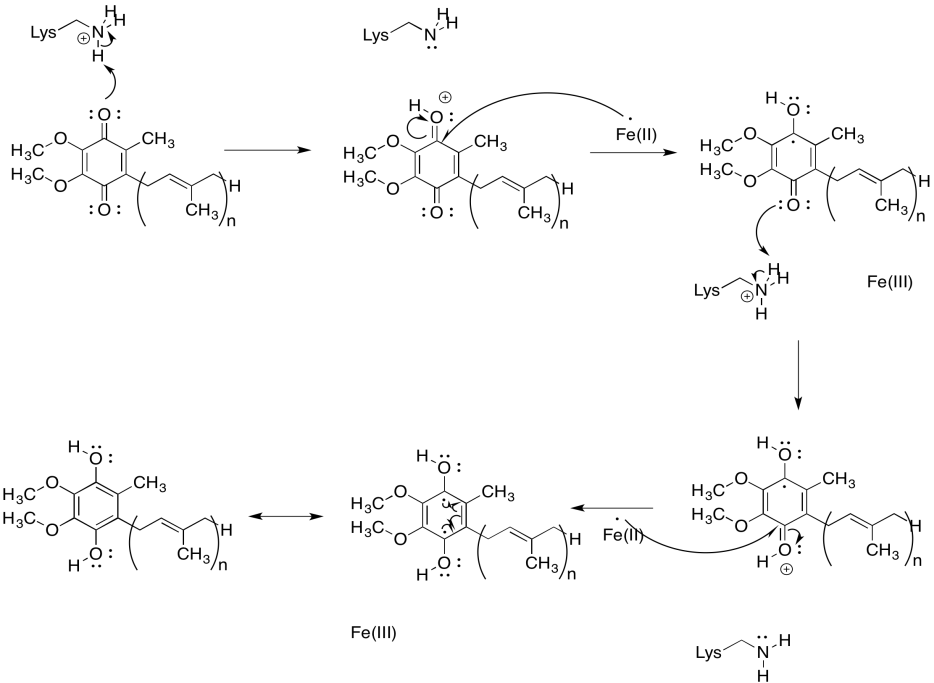
La UQ es muy diferente de los grupos de FeS o de la FMN porque no está unida a una proteína. No está amarrado. Se puede mover por ahí. Eso lo convierte en un portador de electrones móvil. Además de ser un aceptor de electrones de potencial relativamente alto (al menos comparado con otras cosas en el Complejo I), el papel de UQH2 es entregar electrones al Complejo III para que la cadena de transporte de electrones pueda continuar.
El problema es, si UQH2 es móvil, ¿qué hay para evitar que se vaya? ¿Cómo se limita su camino para que sea más probable que llegue a su destino? Recuerde que el supercomplejo de fosforilación oxidativa es un grupo de proteínas unidas a la membrana. Se mantienen en un ambiente rico en lípidos. La estructura de UQH2, con su larga cola, es muy lipófila. Si permanece en la membrana, sus movimientos se limitan a dos dimensiones, en lugar de tres, y es mucho más probable que llegue a su destino del Complejo III.
- La ubiquinona es un portador de electrones móvil soluble en lípidos.
- Su movimiento está restringido a la membrana mitocondrial.
Hay una característica más importante del Complejo I. Al igual que algunos de los otros complejos involucrados en la fosforilación oxidativa (Complejos III y IV), el Complejo I bombea protones a través de la membrana mitocondrial interna. En última instancia, los protones que se han reunido en el borde de la membrana mitocondrial interna se vuelven en cascada, girando una rueda de molino molecular que impulsa la fabricación de ATP. El ATP se utiliza para alimentar procesos en toda la celda.
- Los protones se bombean activamente a través de la membrana mitocondrial.
- Como resultado, se desarrolla una carga a través de la membrana.
- La matriz mitocondrial se vuelve “dopada n” o cargada negativamente.
- El espacio intermembrana se convierte en “dopado p” o cargado positivamente.
Esta bomba de protones es un ejemplo de transporte activo. La energía se gastó para transportar protones a través de la membrana, a pesar de una acumulación de carga positiva en el espacio intermembrana (y una acumulación correspondiente de carga negativa en la matriz). La energía liberada por la cadena de transporte de electrones puede ser responsable de cambios conformacionales en la proteína que ayudan a que se produzca este transporte.
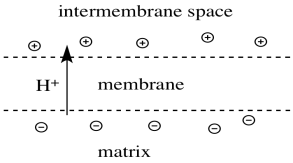
Todavía parece haber alguna discusión sobre cómo, exactamente, funciona la bomba de protones en este sistema. No obstante, algunas cosas están claras. El transporte de proteínas a través de una membrana hidrófoba es probablemente facilitado por la presencia de porciones hidrófilas de la proteína. Se cree que hay canales que se abren en la proteína, permitiendo que las moléculas de agua se muevan a través de la proteína. Debido a que la proteína está incrustada en la membrana, estos protones también están cruzando la membrana al mismo tiempo.

Ejercicio\(\PageIndex{6}\)
Frecuentemente, los aminoácidos específicos pueden desempeñar un papel en ayudar al transporte de protones (u otros iones). Rellene algunas posibilidades diferentes para estos aminoácidos.

- Contestar
-

Ejercicio\(\PageIndex{7}\)
En general, el protón que ingresa al complejo por un lado de la membrana probablemente no sea el mismo protón que emerge del otro lado. Proporcionar un mecanismo con flechas para ilustrar este proceso.

- Contestar
-

La liberación de energía sobre la cadena de transporte de electrones impulsa el transporte de protones a través de la membrana. Hay otro factor que ayuda, también. Al igual que los electrones, los protones viajan desde la matriz hacia el espacio intermembrana. Tanto los chages positivos como los negativos están viajando en la misma dirección. Eso plantea la posibilidad de transporte acoplado, en el que el flujo de electrones a través de la proteína facilita que los protones sigan (o viceversa).
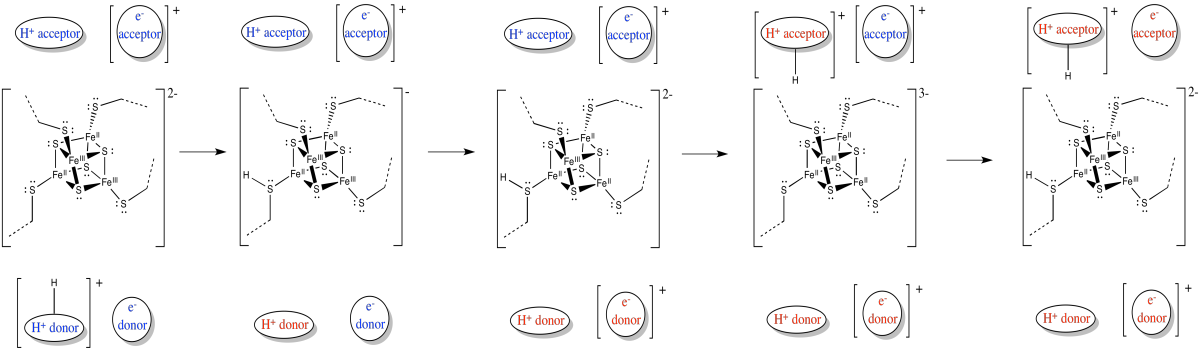
En el transporte acoplado, el movimiento de un protón es seguido rápidamente por la transferencia de un electrón (o viceversa).
- Los electrones y protones viajan en la misma dirección a través del complejo I: desde la matriz hacia el espacio intermembrana.
- Sus cargas opuestas pueden conducir a un mecanismo acoplado en el que el movimiento de uno facilita el seguimiento del otro.
El complejo I no es el único punto de entrada para los electrones en la cadena de transporte de electrones. El complejo II juega un papel similar. Juntos, cosechan energía de la cadena de transporte de electrones; esa energía se usa en última instancia para producir ATP, que puede moverse a través de la célula para liberar energía en otros lugares.
Ejercicio\(\PageIndex{8}\)
Proporcionar un mecanismo para la oxidación de FMNH2 por hierro (III).
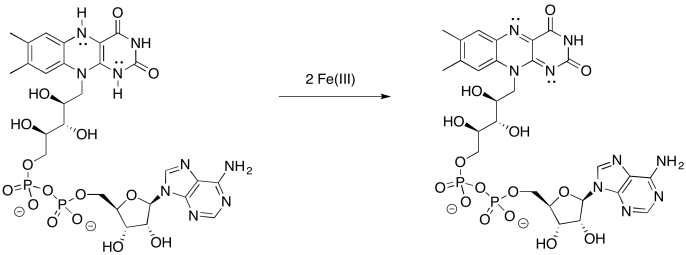
- Contestar
-
Ejercicio\(\PageIndex{9}\)
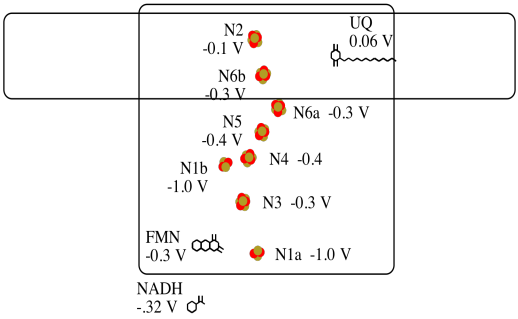
Es difícil medir el potencial de reducción de un sitio individual dentro de una proteína. Sin embargo, los investigadores han podido estimar estos valores midiendo los espectros de EPR bajo diversas condiciones. Por ejemplo, aquí hay una imagen aproximada de los potenciales en el Complejo I.
- Dos de los cúmulos de N probablemente no están directamente involucrados en la cadena de transporte de electrones. ¿Cuáles?
- Utilice los datos del diagrama para construir un diagrama de energía potencial para la transferencia del electrón a lo largo de la ruta.
- Contestar a
-
a) Lo más probable es que N1a y N1b no estén involucrados, debido a que sus potenciales de reducción son demasiado negativos.
- Respuesta b
-
b)
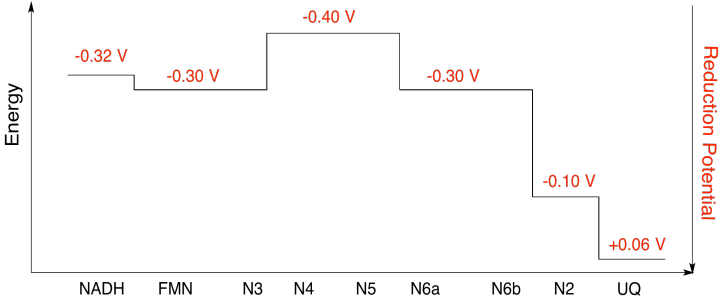
Ejercicio\(\PageIndex{10}\)
Usando los valores de la figura anterior, calcula el cambio de energía cuando se transfiere un electrón del cluster N5 al cluster N6a.
- Contestar
-
Suponiendo que los potenciales de reducción son:
N5 (buey) + e - → N5 (rojo) E o rojo = -0.40 V
N6a (buey) + e - → N6a (rojo) E o rojo = -0.30 V
Entonces la diferencia de potencial para la reacción, ΔE o = -0.30 - (-0.40) V = 0.10 V.
La relación Faraday ΔG = - n F ΔE o da
ΔG = - 1 x 96,485 J V -1 mol -1 x 0.10 V = 9,649 J mol -1 = 9.7 kJ mol -1

