7.3: Complejo II
- Page ID
- 79356
El complejo II es otro grupo de proteínas que sirve como segundo punto de entrada a la cadena de transporte de electrones, la cual está involucrada en la producción adicional de ATP para potenciar los procesos celulares. La cadena de transporte de electrones libera pequeñas cantidades de energía con cada transferencia de electrones, y el transporte se acopla al bombeo de protones a través de la membrana mitocondrial. Eventualmente, los electrones se entregan al oxígeno molecular, el cual se reduce al agua, en el Complejo IV.
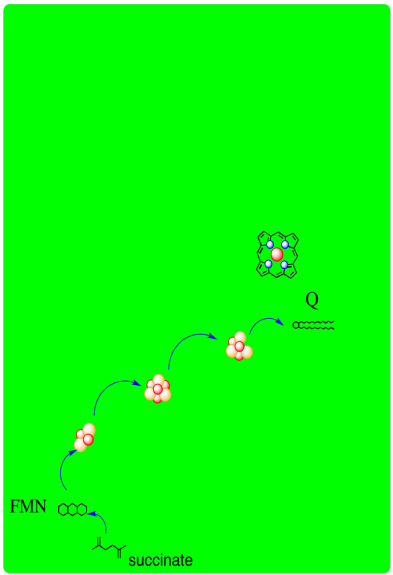
A continuación se proporciona un esquema del Complejo II. Muestra electrones proporcionados por succinato viajando primero al FAD y luego a lo largo de una serie de agregados de azufre de hierro a un aceptor de ubiquinona.
- El Complejo II, al igual que el Complejo I, es un punto de entrada a la cadena de transporte de electrones.
- En el Complejo II, dos electrones son entregados a partir del succinato.
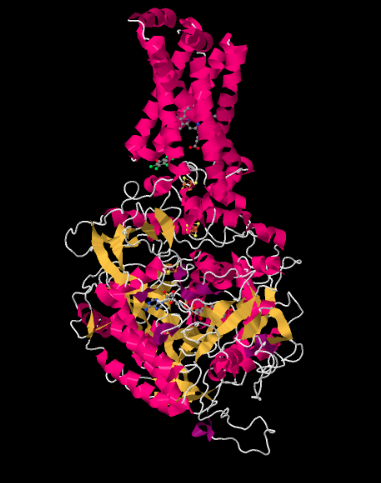
A continuación se muestra la estructura cristalina de rayos X del Complejo II. Se representa en forma de caricatura para resaltar la estructura, con hélices rosadas, hojas amarillas y bucles blancos. Al igual que en la estructura del Complejo I, la estructura aquí se muestra orientada de manera que la membrana mitocondrial interna se extendería por la parte superior de la imagen; si se mostrara, la veríamos en sección transversal, de lado a lado. Una vez más, hay un dominio hidrófobo en la parte superior del complejo que estaría incrustado en esa membrana. Debajo de eso se encuentra un dominio hidrófilo mucho más grande, que se extendería hacia el matirx mitocondrial.
El complejo II realmente juega un papel en otro proceso bioquímico, el ciclo del ácido cítrico. Una de las etapas del ciclo del ácido cítrico es la oxidación del succinato a fumarato. Es durante esta oxidación que se introducen electrones adicionales en la cadena de transporte de electrones a través del Complejo II. Al mismo tiempo, también se entregan dos protones del succinato. La pérdida de dos protones y dos electrones del succinato corresponde a una pérdida formal de H 2 (formal, es decir, una molécula de H 2 no se forma realmente, sino que las piezas son equivalentes a una molécula de H2 completa). Se forma un doble enlace en la nueva molécula de fumarato, que se dice que está “deshidrogenada” con respecto al succinato original. El complejo II es la enzima que lleva a cabo esta transformación en el ciclo del ácido cítrico, por lo que el complejo también se denomina “succinato deshidrogenasa”.
- El complejo II es en realidad una parte integral del ciclo de TCA, que tiene lugar en la matriz mitocondrial.
- La conversión de succinato en fumarato es un proceso de dos electrones y dos protones.
Se muestra a continuación, las proteínas son despojadas de la imagen para revelar algunas de las partes de trabajo en su interior. Habiendo visto ya el Complejo I, probablemente reconocerá algunos racimos de hierro y azufre, mostrados nuevamente en rojo y amarillo. En la parte inferior de la imagen, cerca de la matriz, se puede ver una estructura flavenoidea, un poco como la FMN que viste en el Complejo I. En la parte superior, en realidad enterrada dentro de la porción hidrofóbica (solo puedes ver el borde de la misma si miras entre dos de las hélices rosadas en la imagen de arriba), es un complejo hemo de hierro; es un poco como el sitio activo de la hemoglobina. Se puede ver el átomo de hierro, codificado en rojo, y los cuatro átomos de nitrógeno que lo rodean, de color azul. Sin embargo, no está claro qué papel juega realmente este hemo en el transporte de electrones a través del Complejo II.
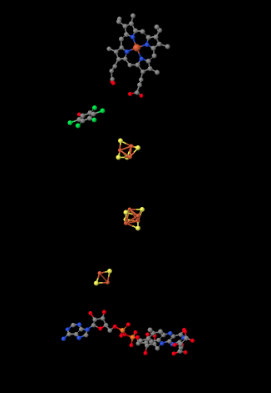
Entre el cúmulo de hierro azufre más alto y el hemo de hierro se encuentra una molécula de pentafluorofenol. Eso no se supone que esté ahí en la celda. Es un inhibidor; los investigadores lo agregaron para mantener el lugar de una ubiquinona mientras cultivaban el cristal que analizarían para obtener esta estructura. En realidad hay un segundo inhibidor en la estructura, un oxaloacetato, que mantiene el lugar de la molécula de succinato que entregaría electrones al complejo. Sin embargo, el oxaloacetato no es claramente visible porque está parcialmente oscurecido por el flavenoide en la parte inferior de la imagen.
- Al igual que en el Complejo I, los electrones eventualmente llegan a ubiquinona en el Complejo II.
- La ubiquinona es un portador móvil, soluble en lípidos, de dos electrones.
El complejo II es único de otra manera importante. A diferencia de los Complejos I, III y IV, participa en la cadena de transporte de electrones pero no bombea activamente protones a través de la membrana mitocondrial interna. En cambio, los electrones que cosecha contribuyen a construir el gradiente de protones una vez que llegan al Complejo III (y posteriormente al Complejo IV).
- El complejo II no bombea protones directamente.
- El Complejo II envía dos protones al Complejo III en forma de ubiquinol reducido.
En cuanto a cómo esos electrones hacen su llegada, la imagen es algo similar al Complejo I. El succinato es un donante de hidruro en esta reacción, por lo que está donando dos electrones. Al igual que en el Complejo I, una serie de clústeres de FeS eventualmente retransmitirán los electrones, por lo que tenemos un problema de coincidencia. Para pasar de un proceso de dos electrones a un proceso de un electrón, otro flavenoide, FAD, actúa como intermediario. Al igual que la FMN relacionada, el FAD puede aceptar uno o dos electrones a la vez, y su forma reducida, FADH2, puede donar uno o dos electrones a la vez.
- Al igual que en el Complejo I, se necesita un adaptador para convertir el proceso de dos electrones de oxidación de succinato en el proceso de reducción de hierro de un electrón.
- El adaptador es otra estructura flavenoide, FAD, que es muy similar a la FMN utilizada en el Complejo I.
Después de que los electrones han llegado y se almacenan en forma de FADH2, se pasan, uno a la vez, a través de una serie de tres clústeres de FeS. Al igual que en el Complejo I, estos portadores están todos unidos a las proteínas, por lo que se mantienen en un solo lugar y no se mueven. El mecanismo de la esfera externa por el cual se transfieren los electrones sólo puede operar a corta distancia, de un portador de electrones al siguiente.
El Complejo II también contiene una estructura que no vimos en el Complejo I: un citocromo. Un citocromos es una proteína que contiene un complejo hemo de hierro. Se parecen un poco a la hemoglobina, con la que sin duda ya estás familiarizado. Al igual que en los conglomerados de FeS, el citocromo puede acceder al estado Fe (II) o Fe (III). Al igual que los cúmulos de FeS, solo aceptan un electrón a la vez. Descubriremos que algunos citocromos son móviles, pero éste no lo es. Se queda donde está y espera a que una ubiquinona se una cerca.
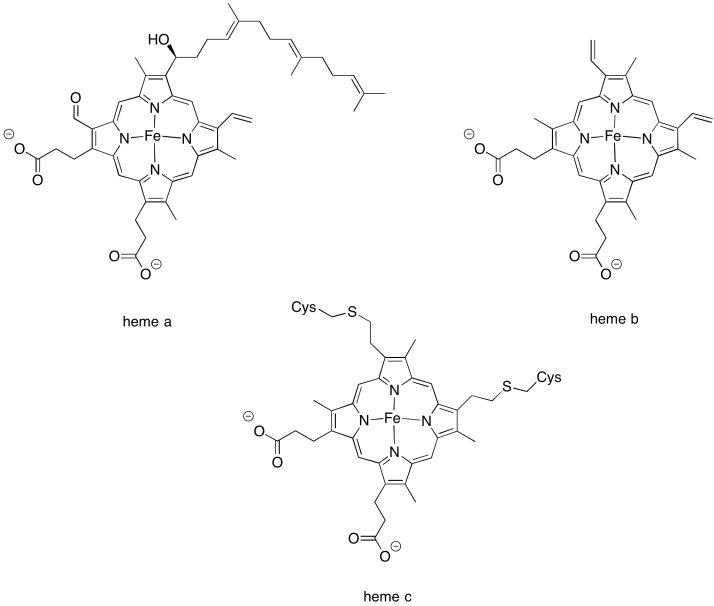
Hay pocas variaciones diferentes en la familia hemo que se encuentran comúnmente en biología. El hemo b es común y tiene la estructura más simple. El hemo a contiene una cola de hidrocarburo así como un grupo formilo (-HC=O) unido a su anillo central de porfirina. El hemo c se une covalentemente a la proteína circundante a través de residuos de cisteína.
Ejercicio\(\PageIndex{1}\)
Vuelva a observar la estructura cristalina de rayos X del ligando en el Complejo II. ¿Qué tipo de hemo está presente?
- Responder
-
Heme b.
Ejercicio\(\PageIndex{2}\)
La estructura básica de porfirina en el centro de todos los hemos es un macrociclo con la fórmula (C 4 H 2 NCH) 4. Dibuja esta estructura.
- Responder
-
Una porfirina contiene cuatro anillos pirrol (anillo aromático de cinco miembros que contiene nitrógeno) dispuestos para formar un macrociclo de 16 miembros.
El papel exacto del citocromo en el Complejo II no está claro. Aunque los citocromos forman parte de la cadena de transporte de electrones en los Complejos III y IV, tal vez no lo hagan en el Complejo II. Otro papel posible es el almacenamiento de un electrón (que sí llega a través de la cadena de transporte de electrones). Cuando la ubiquinona se une cerca, el citocromo puede liberar su electrón a la ubiquinona. Un segundo electrón llegaría directamente del cúmulo de FeS cercano. Ese mecanismo puede permitir una reducción más rápida de ubiquinona a ubiquinol, de manera que pase menos tiempo en la etapa de semiquinona. Como resultado, la especie radical tendría menos probabilidades de alejarse antes de ser completamente reducida. Las especies radicales pueden causar daños, por lo que es importante limitar el movimiento de las especies radicales a través de la célula.
- El papel del grupo hemo en el Complejo I no está claro.
- Se ha sugerido que el grupo hemo puede actuar como un condensador. Puede almacenar uno de los dos electrones necesarios para reducir la ubiquinona a ubiquinol.
- El almacenamiento de un electrón adicional podría resultar en una reducción más rápida de ubiquinona a ubiquinol.
- La reducción rápida de dos electrones limita la vida útil de los intermedios radicales potencialmente dañinos en la célula.
Una vez que dos protones y dos electrones son entregados a la ubiquinona, el ubiquinol resultante viaja al Complejo III para el siguiente paso en la fosforilación oxidativa.
Ejercicio\(\PageIndex{3}\)
Proporcionar un mecanismo para la reducción de FAD por succinato.
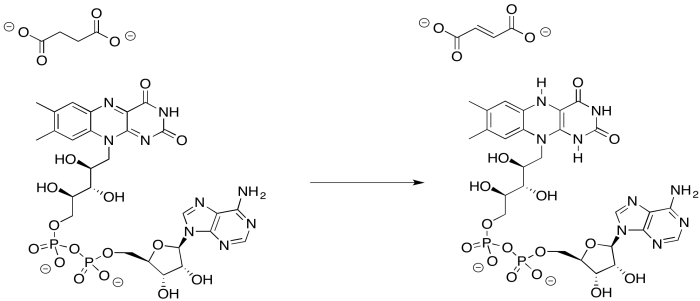
- Responder
-
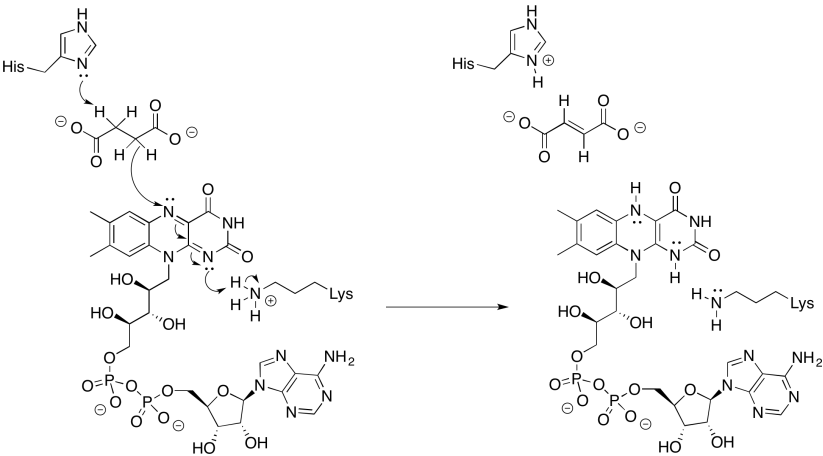
Ejercicio\(\PageIndex{4}\)
Es difícil medir el potencial de reducción de un sitio individual dentro de una proteína. Sin embargo, los investigadores han podido estimar estos valores midiendo los espectros de EPR bajo diversas condiciones. Suponiendo los potenciales de reducción a continuación, dibuje un diagrama de progreso de reacción para el transporte de un electrón desde succinato a ubiquinona.
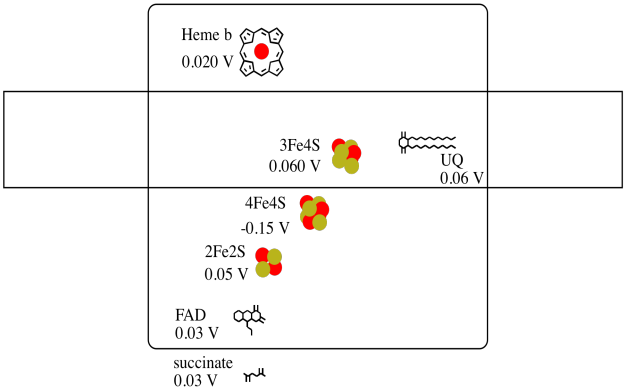
- Responder
-
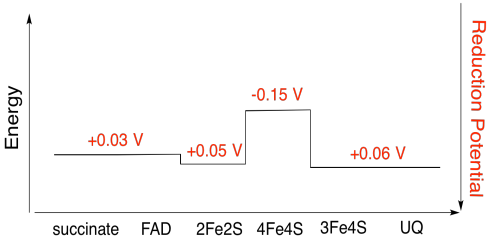
Ejercicio\(\PageIndex{5}\)
Usando los valores de la figura anterior, calcula el cambio de energía cuando se transfiere un electrón desde el cúmulo 4Fe4S al cúmulo 3Fe4S.
- Responder
-
Suponiendo que los potenciales de reducción son:
4Fe4S (buey) + e - → 4Fe4S (rojo) E o rojo = -0.15 V
3Fe4S (buey) + e - → 3Fe4S (rojo) E o rojo = 0.06 V
Entonces la diferencia de potencial para la reacción, ΔE o = 0.06 - (-0.15) V = 0.21 V.
La relación Faraday ΔG = - n F ΔE o da
ΔG = - 1 x 96,485 J V -1 mol -1 x 0.21 V = 20,262 J mol -1 = 20 kJ mol -1
Ejercicio\(\PageIndex{6}\)
Suponiendo que todo el hierro esté presente como Fe (III), calcule los cargos generales sobre:
a) 2Fe2S b) 3Fe4S c) 4Fe4S
- Responder a
-
a) Cargas de hierro: 2 x Fe (III) = 6 +
Cargas de ligando: 2 sulfuros = 2 x 2 - = 4 -; 4 cisteínas = 4 x 1 - = 4 -; total = 8 -
En general: 2 -
- Respuesta b
-
b) Cargas de hierro: 3 x Fe (III) = 9 +
Cargas de ligando: 4 sulfuros = 4 x 2 - = 8 -; 3 cisteínas = 3 x 1 - = 3 -; total = 11 -
En general: 2 -
- Respuesta c
-
c) Cargas de hierro: 4 x Fe (III) = 12 +
Cargas de ligando: 4 sulfuros = 4 x 2 - = 8 -; 4 cisteínas = 4 x 1 - = 4 -; total = 12 -
En general: 0
Estructuras cristalinas de rayos X: Zhou, Q., Zhai, Y., Lou, J., Liu, M., Pang, X., Sun, F. El tiabendazol inhibe la actividad de reducción de ubiquinona del complejo respiratorio mitocondrial II a través de una característica de unión mediada por moléculas de agua. Protein Cell 2011, 2, 531-542. Imágenes obtenidas a través del Banco de Datos de Proteínas RCSB (3SFD).

