7.5: Complejo IV
- Page ID
- 79354
El complejo IV es el destino final en la cadena de transporte de electrones. Aquí, los electrones que han estado viajando a través de los otros miembros del supercomplejo respiratorio finalmente se entregan a O 2, reduciéndolo a agua. Esa es una hazaña impresionante, porque se deben formar varias especies reactivas de oxígeno entre la adición inicial de un electrón y la liberación final de agua, pero la reacción se controla de tal manera que se minimiza la posibilidad de daño celular. Al mismo tiempo, se bombean más protones a través de la membrana mitocondrial interna.
- En el Complejo IV, los electrones son entregados a su destino final, una molécula de O 2.
- El O 2 se reduce a agua.
Ejercicio\(\PageIndex{1}\)
Escriba una media reacción redox equilibrada para mostrar cuántos electrones se necesitan para reducir una molécula de oxígeno a agua.
- Contestar
-
O 2 → H 2 O
O 2 → 2 H 2 O (O balanceado)
O 2 + 4H + → 2 H 2 O (H balanceado)
O 2 + 4e - + 4H + → 2 H 2 O (carga balanceada)
A continuación se muestra la estructura de rayos X del Complejo IV. Nuevamente, la matriz está en el extremo inferior de la imagen y el espacio intermembrana está en la parte superior. Ahí es donde se atraca el citocromo c, en la parte superior.
El portador de electrones móvil, el citocromo c, se une al Complejo IV y entrega un electrón a un sitio binuclear de cobre llamado Cu A. Podemos ver ese sitio binuclear de cobre cuando miramos dentro de la proteína, abajo. Está ligado solo a la proteína y nada más, así que solo vemos los dos iones de cobre por su cuenta en la parte superior de la imagen. Este par de átomos de cobre envía el electrón a un hemo, citocromo a, que se puede ver a continuación y a la izquierda. A partir de ahí, el electrón procede a otro cúmulo binuclear, esta vez constituido por un hierro unido al hemo (citocromo a3) y un cobre cercano (Cu B). Este sitio binuclear lleva a cabo la reducción de dioxígeno a agua. En la estructura, hay una molécula de monóxido de carbono unida en el sitio activo entre el citocromo a3 y el Cu B. Los átomos de carbono están unidos al hierro y el oxígeno está unido al cobre. Ahí es donde se uniría la molécula de oxígeno, esperando ser reducida a agua.
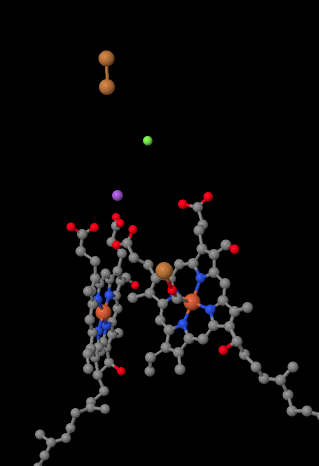
Si piensas en eso, significa que los electrones están viajando en dirección opuesta a lo que vimos en los tres primeros complejos. En los Complejos I y II, los electrones se entregaron desde la matriz mitocondrial y viajaron hacia el espacio intermembrana, deteniéndose en una ubiquinona en la membrana mitocondrial. En el Complejo III, los electrones continuaron en esa dirección “ascendente”, desde la membrana mitocondrial hasta el citocromo c en el espacio intermembranario. En el Complejo IV, los electrones están invirtiendo el curso, viajando de regreso hacia la matriz mitocondrial. Recuerde, la matriz mitocondrial está dopada con n debido al bombeo de protones, por lo que estos electrones están viajando desde el lado positivo de la membrana al lado negativo. Eso debe ser difícil.
- En el Complejo IV, el transporte de electrones es en sentido contrario al de los otros complejos.
- Los electrones viajan desde el lado del espacio intermembrana al lado de la matriz mitocondrial, contra el gradiente de carga.
Echemos otro vistazo a los ligandos importantes para el complejo. A continuación se muestra una caricatura. En la caricatura, se muestra la molécula O 2 uniéndose en esa posición entre el hemo a 3 y el Cu B. Ese sitio metálico dinuclear es donde la molécula de oxígeno se reduce a agua.
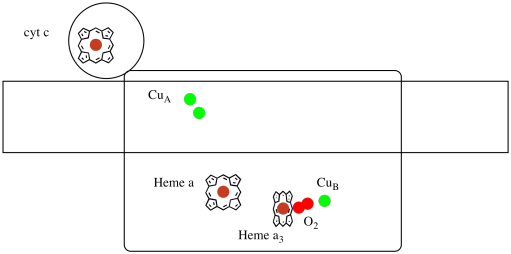
Debido a que se necesitan cuatro electrones para reducir O 2 a H 2 O, cuatro moléculas de citocromo c deben unirse al Complejo IV antes de que pueda continuar esa reducción. Es probable que el ambiente de coordinación de la molécula de oxígeno —entre dos metales, en lugar de limitarse a uno— permita que se reduzca más rápidamente hasta el agua en lugar de formar especies reactivas de oxígeno que persisten en la célula, como los peróxidos.
Ejercicio\(\PageIndex{2}\)
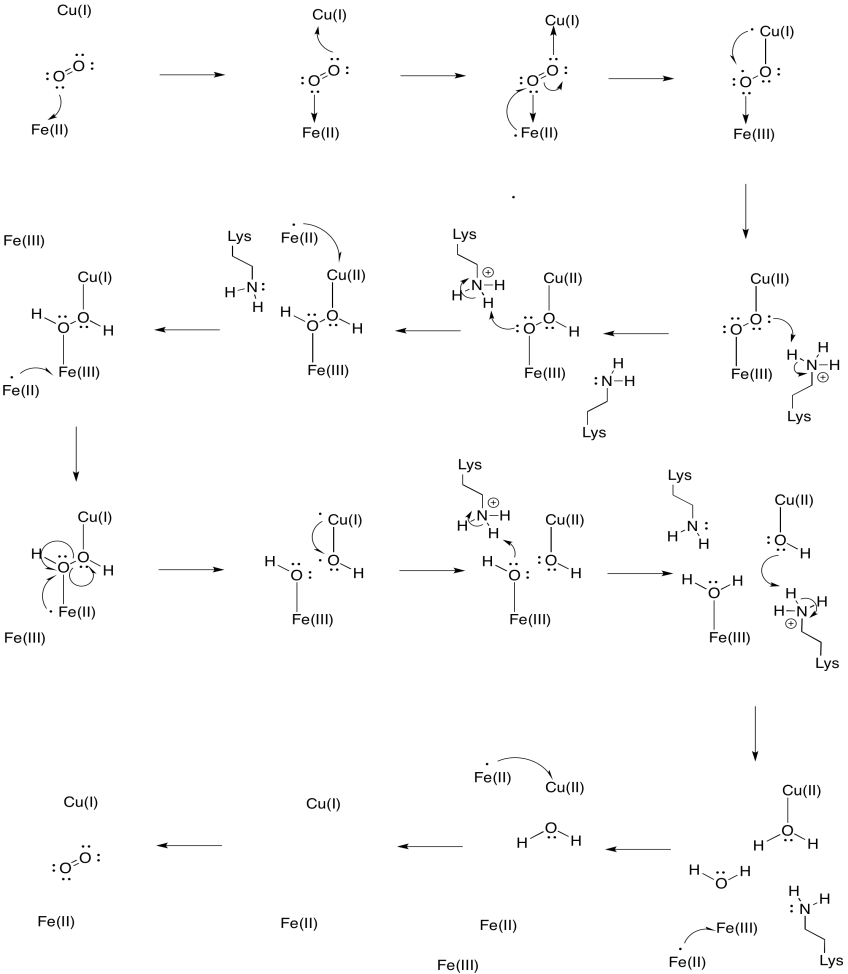
Supongamos que el hierro en hemo a3 comienza en un estado reducido de Fe (II) y el CuB comienza en un estado reducido de Cu (I). Proporcionar un mecanismo para la reducción del oxígeno al agua, con la adición de cuatro electrones y cuatro protones. Usar Fe (II) como donante de electrones y lisina como donante de protones.
- Contestar
-
Además de esos dos metales, también existe un conjugado de histidina-tirosina modificado unido a CuB. Se ha sugerido que esta tirosina proporciona otra fuente de electrones inmediatos que pueden ser utilizados en la reducción.
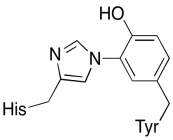
Ejercicio\(\PageIndex{3}\)
Mostrar por qué una tirosina puede ser fuente tanto de un protón como de un electrón en los procesos bioquímicos.
- Contestar
-
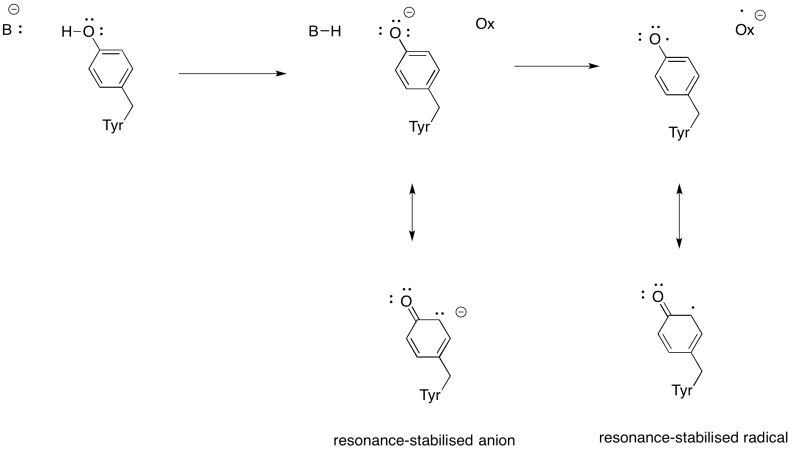
Además de la necesidad de reducir el oxígeno al agua, el Complejo IV también contribuye al gradiente de protones, bombeando protones adicionales a través de la membrana mitocondrial. Esa tarea presenta retos adicionales. Un simple mecanismo de acoplamiento no es posible, porque los electrones se mueven en la dirección opuesta. Sin embargo, el mecanismo implica cambios conformacionales en la proteína que ocurren a medida que los metales cambian los estados de oxidación. Los cambios sutiles en el ambiente de coordinación pueden resultar en el desplazamiento de residuos de aminoácidos cercanos. Es fácil imaginar que si un aminoácido en particular se desplaza hacia arriba hacia el espacio intermembrana, puede tirar de un protón con él.
- El bombeo de protones y el transporte de electrones corren en direcciones opuestas en el Complejo IV y deben estar desacoplados.
- El bombeo de protones en el Complejo IV debe basarse en cambios conformacionales.
Ejercicio\(\PageIndex{4}\)
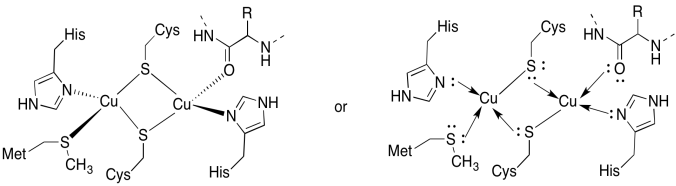
El sitio Cu A contiene dos cobres, agrupados por dos cisteínas puente. Ambos están unidos por histidinas terminales. Además, un cobre está unido por una metionina adicional, mientras que el otro está unido por un carbonilo de la cadena principal de la proteína.
- Dibujar los cobres en sus sitios de unión.
- Describir la geometría de cada cobre.
- Si cada cobre es Cu (I), ¿cuál es el recuento coordinado de electrones de cada cobre en el complejo?
- Si cada cobre es Cu (I), ¿cuál es la carga general en el complejo?
- Contestar a
-
a)
- Respuesta b
-
b) tetraédrico
- Respuesta c
-
c) Cu (I) = d 10
4 donantes = 8 e -
total = 18e -
- Respuesta d
-
d) 2 x Cu (I) = 2 +
2 x Cis-S - = 2 -
Todos los demás neutrales
Total = 0
Ejercicio\(\PageIndex{5}\)
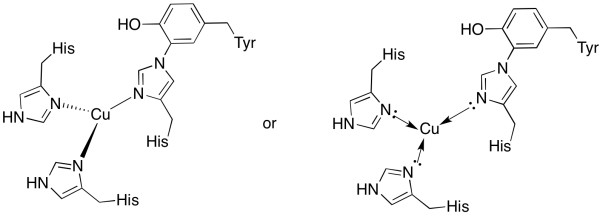
El cobre en el sitio Cu B está unido por dos histidinas y el conjugado histidina-tirosina.
- Dibuja el cobre en el sitio de unión.
- Describir la geometría del cobre.
- Si el cobre es Cu (I), ¿cuál es el recuento coordinado de electrones en el complejo?
- Si el cobre es Cu (I), ¿cuál es la carga general en el complejo?
- Contestar a
-
a)
- Respuesta b
-
b) plano trigonal
- Respuesta c
-
c) Cu (I) = d 10
3 donantes = 6 e -
total = 16 e -
- Respuesta d
-
d) Cu (I) = 1 +
histidinas neutras
Total = 1 +
Ejercicio\(\PageIndex{6}\)
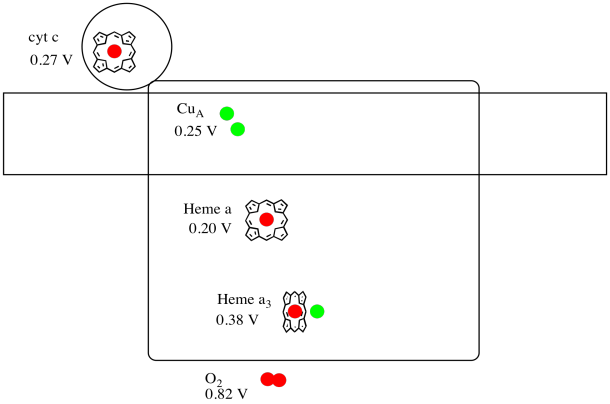
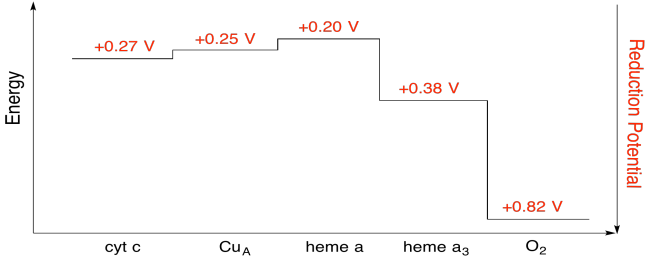
Es difícil medir el potencial de reducción de un sitio individual dentro de una proteína. Sin embargo, los investigadores han podido estimar estos valores midiendo los espectros de EPR bajo diversas condiciones. Suponiendo los potenciales de reducción a continuación, dibuje un diagrama de progreso de reacción para el transporte de un electrón desde el citocromo c hasta el oxígeno molecular.
- Contestar
-
Ejercicio\(\PageIndex{7}\)
Utilizando los valores de la figura anterior, calcula el cambio de energía cuando se transfiere un electrón del hemo a al hemo a 3.
- Contestar
-
Suponiendo que los potenciales de reducción son:
hemo a (buey) + e - → hemo a (rojo) E o rojo = 0.20 V
hemo a 3 (buey) + e - → hemo a 3 (rojo) E o rojo = 0.38 V
Entonces la diferencia de potencial para la reacción, ΔE o = 0.38 - (0.20) V = 0.18 V.
La relación Faraday ΔG = - n F ΔE o da
ΔG = - 1 x 96,485 J V -1 mol -1 x 0.13 V = 17,367 J mol -1 = 17.4 kJ mol -1

