9.3: Fotosistema II- Cosecha de los fotones
- Page ID
- 79339
Todo comienza con Fotosistema II. Fotosistema I viene después; los dos complejos se nombran así porque Fotosistema I fue descubierto antes del Fotosistema II.
La siguiente imagen es una “representación de dibujos animados” de una estructura cristalina de rayos X del fotosistema II. Entonces, los investigadores primero tomaron una solución de proteína y de alguna manera persuadieron a las moléculas de proteína de la solución en forma de un cristal. En un cristal, las moléculas están orientadas en una matriz organizada, por lo que todas están alineadas de manera regular. Los investigadores tomaron el cristal y lo colocaron en un haz de rayos X, luego midieron cómo los rayos X se dispersaron cuando golpeaban el cristal. Ese patrón de dispersión se utilizó para construir un mapa tridimensional de las posiciones atómicas en la proteína. Debido a que eso es una gran cantidad de átomos, los bioquímicos suelen presentar el mapa de diferentes maneras que son menos complicadas.
La representación de dibujos animados no muestra dónde están los átomos individuales, sino que muestra las ubicaciones de las hélices alfa (rosa) y hojas beta (amarillas) así como la cadena formada por el resto de la proteína que no está organizada de ninguna de esas maneras (blanca). Las hélices paralelas son típicas de una proteína unida a la membrana; la parte superior de la estructura puede encajar fácilmente entre las colas paralelas de la bicapa lipídica que forma la membrana tilacoidea.
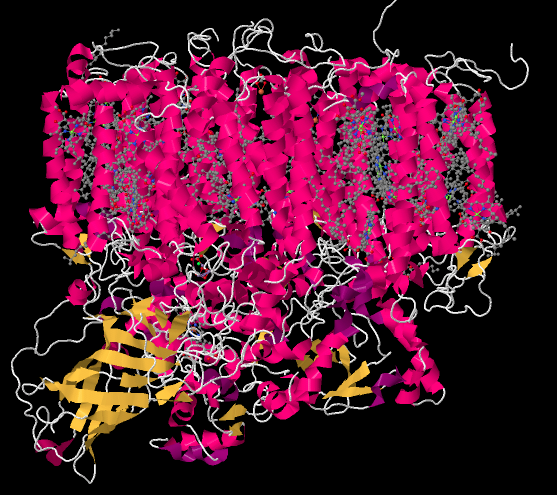
La estructura a continuación se muestra desde el mismo punto de vista, pero con la proteína eliminada. Se puede ver que la proteína sostiene muchas moléculas más pequeñas en su lugar; está llena de ellas. Eso contrasta con los complejos de la vía de fosforilación oxidativa, donde había como máximo media docena de racimos metálicos, que estaban unidos directamente a la proteína, y un par de ubiquinonas, que estaban libres.

Vamos a tomarnos un momento y centrarnos en algo interesante en la parte inferior izquierda de esa imagen. Todo es interesante, claro, pero esto es algo extraordinariamente importante para nosotros como humanos. A medio camino entre la gran masa enredada de moléculas en la parte superior y la única molécula en la parte inferior (un hemo, por si te lo preguntabas) hay una pequeña mancha de átomos. Algunos de los átomos son rojos (oxígeno, en este caso) y otros son morados (manganeso); también hay uno gris (calcio) e incluso uno verde (probablemente un ion cloruro parásito que fotobombardeó la estructura). Este es el complejo evolutivo de oxígeno. Es responsable de producir todo el oxígeno molecular, O 2, en la tierra. Tu vida depende de ello.
Volveremos al complejo de evolución de oxígeno en una unidad posterior. Ahora mismo descubramos qué están haciendo todas esas otras moléculas en ese scrum en la parte superior de la imagen, y por qué son importantes. Este es el complejo de recolección de luz. Su trabajo es recolectar energía de la luz solar y convertir esa energía en formas que la planta pueda usar. Por supuesto, en algún lugar de la línea aprendiste en clase de biología que la clorofila es lo que hace posible la fotosíntesis, y hay varias moléculas de clorofila en el complejo de recolección de luz. Hay muchos miembros diferentes de esta familia de moléculas en la naturaleza, que se encuentran en diferentes organismos que pueden sobrevivir a la luz solar: plantas, algas, algún plancton, algunas bacterias. Las clorofilas que se encuentran comúnmente en las plantas son la clorofila a y la clorofila b, que se muestran a continuación.
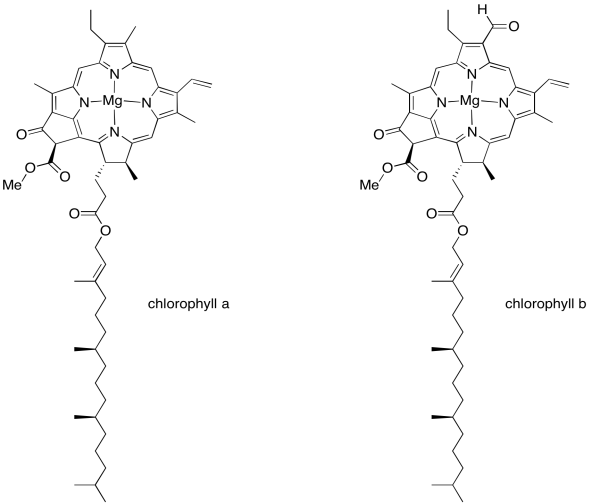
Una clorofila es un ejemplo de una porfirina, como la que forma la unidad hemo en la hemoglobina. Tiene una estructura plana y policíclica compuesta por cuatro anillos de pirrol que contienen nitrógeno. Esos átomos de nitrógeno pueden unirse a iones metálicos como el hierro (en hemoglobina, mioglobina, y diversos citocromos) o, en este caso, magnesio.
Sin embargo, ¿por qué hay dos clorofilas diferentes? Hay aún más si se cuentan las variaciones que son comunes en organismos distintos a las plantas. Se necesita mucha energía para que una célula fabrique diferentes moléculas; ¿no sería más eficiente simplemente hacer un tipo de clorofila?
La ventaja de la diversidad de clorofila se puede observar en los espectros UV-Vis de los diferentes compuestos. La clorofila a tiene un par de máximos de absorción alrededor de 430 y 660 nm; también hay algunas características de absorción más pequeñas cerca de 410 y 600 nm.
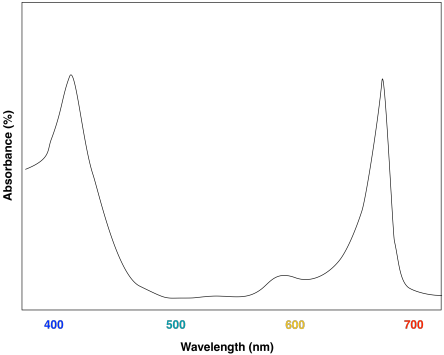
Una mirada al espectro UV-Vis de la clorofila b muestra algunas similitudes fuertes. Todavía hay dos máximos de absorción principales, cerca de los de la clorofila a, pero se han desplazado a aproximadamente 450 y 640 nm.

Probablemente no sea sorprendente que las dos moléculas tengan espectros UV-Vis más o menos similares, ya que tienen estructuras similares. Las diferencias menores en las estructuras son responsables de variaciones sutiles en los niveles de energía de los orbitales donador y aceptor involucrados en la transición electrónica, resultando en máximos de absorción ligeramente diferentes.
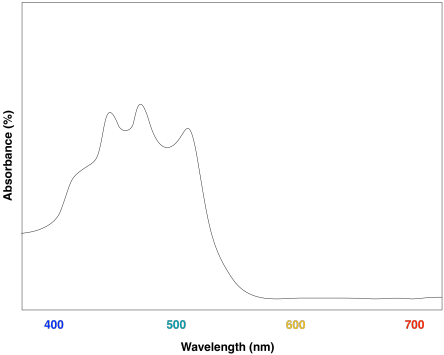
La combinación de las dos clorofilas diferentes conduciría a un espectro UV-Vis que se parece un poco a este:
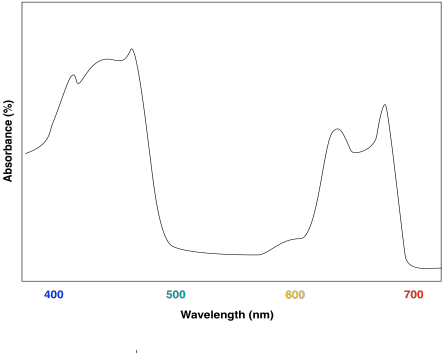
El efecto es cosechar luz de un rango ligeramente más amplio del espectro visible. Eso hace que sea un proceso más eficiente. Debido a que la luz solar contiene longitudes de onda que varían en todo el espectro visible (y más allá), cuantas más longitudes de onda se puedan capturar, más eficiente será la fotosíntesis.
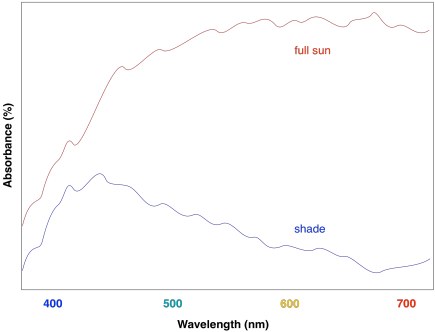
Por esta razón, el complejo de recolección de luz contiene más de un tipo de clorofila, pero también contiene otras moléculas. La clase más importante de estas moléculas no clorofila incluye los carotenoides. Compuestos como licopeno, β-caroteno y zeaxantina son ejemplos de carotenoides.
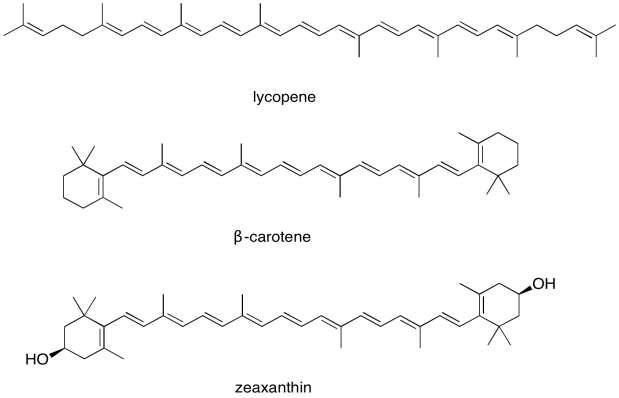
Estos compuestos ayudan a ampliar aún más la absorción por el complejo de recolección de luz. Podemos ver cómo podrían comenzar a llenar el vacío en el espectro anterior que se basaba únicamente en el contenido de clorofila.
En general, el resultado es una colección de moléculas que pueden capturar fotones de gran parte del espectro visible, aunque no todos. Eso es importante, porque la radiación solar que llega a la superficie de la tierra cubre un amplio rango de longitudes de onda. Capturar la mayor cantidad de luz posible aumenta la eficiencia del proceso. El hecho de que las plantas reflejen alguna luz visible da como resultado su color verde.
¿Qué sigue? Toda esa energía luminosa capturada necesita ser convertida en una forma diferente; ese es el objetivo de la fotosíntesis. Sin embargo, no estamos listos para eso. El complejo de recolección de luz solo recoge la luz; el centro de reacción cercano es donde comienza el proceso de conversión. Se puede pensar en el complejo de recolección de luz como una antena o como un embudo que envía energía al centro de reacción, donde comenzará el proceso de convertir la energía en ATP (y, posteriormente, carbohidratos).
¿Cómo llega la energía al centro de reacción? Ocurre a través de un proceso de transferencia de energía sin radiación. Una vez que absorbe la cantidad correcta de energía, el centro de reacción iniciará una cadena de transporte de electrones, muy parecida a la que operó en la fosforilación oxidativa. Sin embargo, un fotón no necesita golpear el centro de reacción en sí, porque puede golpear cualquiera de los cromóforos circundantes en el complejo de recolección de luz. Todas estas moléculas están en estrecho contacto entre sí, por lo que es relativamente fácil que las moléculas colisionen y transfieran toda esa cantidad de energía de una molécula a la siguiente. Durante esa transferencia, la primera molécula se relaja de nuevo al estado fundamental y la siguiente molécula se excita al estado excitado.
Este proceso es muy similar a la fotosensibilización. En la fotosensibilización, una molécula que contiene un cromóforo, que puede absorber un fotón, transfiere su energía a una segunda molécula, que no tiene cromóforo y no puede absorber la luz por sí misma. En el complejo de recolección de luz, todas las moléculas contienen cromóforos y potencialmente podrían absorber un fotón. El punto es que no importa cuál de ellos absorba el fotón; cualquiera de estas absorciones dará como resultado una cascada de transferencias sin radiación hasta que la energía llegue al lugar correcto. Una vez que la energía llegue al centro de reacción, comenzará una cadena de transporte de electrones, y la energía liberada a lo largo de esta cadena será capturada para la fabricación de ATP.
Por el contrario, se ha sugerido que esta matriz de moléculas también brinda protección a la célula. En condiciones en las que la intensidad de la luz es demasiado grande, el centro de reacción puede excitarse sin una salida disponible, ya que los participantes aguas abajo en la ruta pueden no estar listos para recibir electrones. Si eso sucede, un retro-mecanismo puede permitir que el centro de reacción se relaje una vez más, con la energía disipada al entorno a través de la conversión interna.
En general, si un compuesto tiene una absorción principal en el espectro visible, vemos el color complementario. Si un compuesto tiene dos absorciones principales en diferentes partes del espectro, generalmente vemos el color del “canal” o inmersión en el espectro entre estos máximos de absorción.
- ¿Qué color (es) corresponden a los máximos de absorción UV-Vis de la clorofila a? ¿Qué color vemos cuando miramos la clorofila a?
- ¿Qué color (es) corresponden a los máximos de absorción UV-Vis del licopeno? ¿Qué color vemos cuando miramos el licopeno?
- ¿Qué color (es) corresponden a los máximos de absorción UV-Vis del β-caroteno? ¿Qué color vemos cuando miramos el β-caroteno?
- La zeaxantina es un ejemplo de una xantofila; las xantofilas obtienen su nombre de las raíces griegas “phyllon” (hoja) y “xanthos” (amarillo). ¿Qué color probablemente corresponde al máximo de absorción UV-Vis de la zeaxantina?
- Contestar a
-
a) azul y rojo; verde
- Respuesta b
-
b) verde; rojo
- Respuesta c
-
c) azul; naranja
- Respuesta d
-
d) Violeta
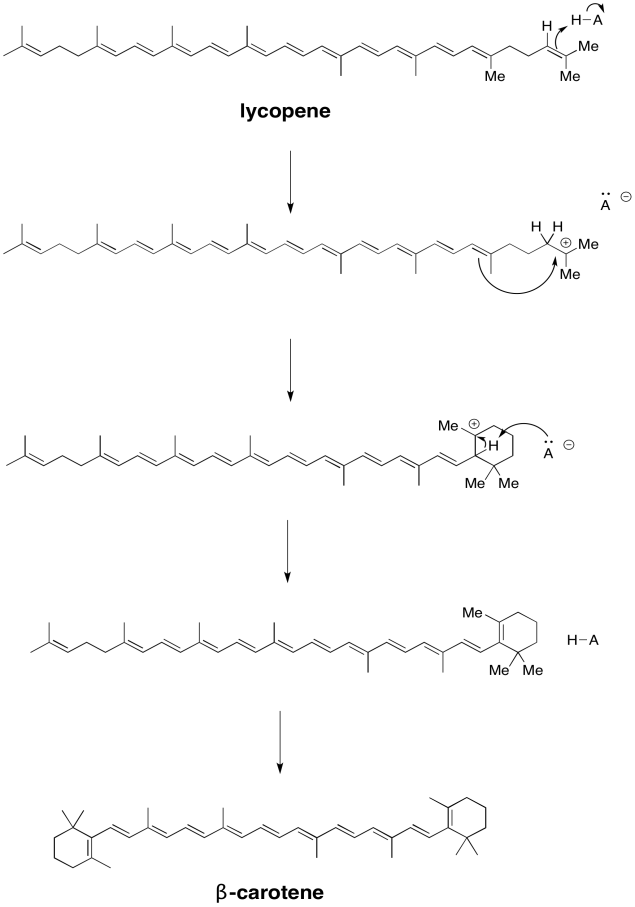
Los carotenoides están biosintéticamente relacionados entre sí. Mostrar cómo, en principio, el licopeno podría convertirse en β-caroteno a través de una simple catálisis ácido/base.
- Contestar
-
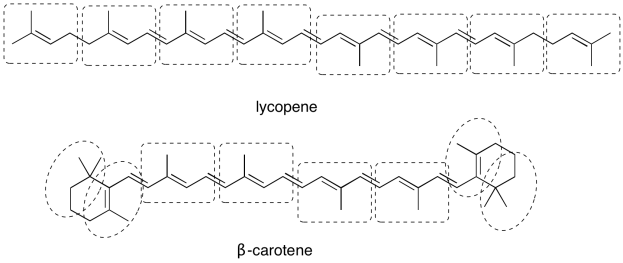
Los carotenoides son ejemplos de una enorme clase de productos naturales llamados terpenos. Los terpenos pueden ser pensados como oligómeros formados a partir de unidades de isopreno de 5 carbonos. Mostrar la ubicación de las unidades de cinco carbonos en licopeno y β-caroteno.
- Contestar
-
Algunas algas marinas contienen ficoeritrina, una proteína que está unida covalentemente a un cromóforo único. A continuación se muestra la estructura cromóforo y la representación del espectro UV por parte de un artista.
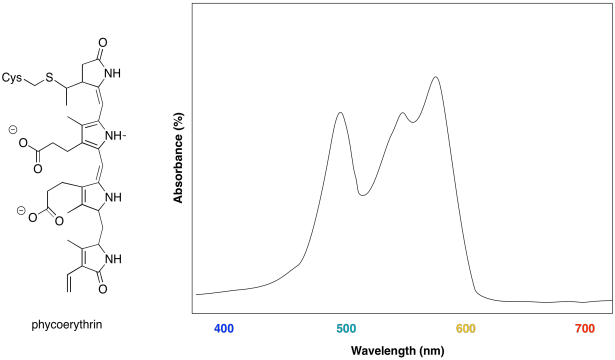
- ¿Qué colores son absorbidos por el cromóforo?
- ¿De qué color aparece el cromóforo?
- ¿Cuál es la ventaja evolutiva que impulsa a las algas a hacer este cromóforo?
1. Estructuras cristalinas de rayos X: Ferreira, K.N.; Iverson, T.M.; Maghlaoui, K.; Barber, J.; Iwata, S. Arquitectura del centro fotosintético de evolución de oxígeno. Ciencia 2004, 303, 1831-1838. Imágenes obtenidas a través del Banco de Datos de Proteínas RCSB (1S5L).

