9.4: Fotosistema II- Transferencia de Electrones
- Page ID
- 79393
El objetivo de la fotosíntesis es capturar la energía luminosa del sol y convertirla en formas que sean útiles para la planta. El proceso comienza en el Fotosistema II, donde el complejo captador de luz absorbe fotones y transmite esa energía al centro de reacción, lo que puede referirse a una proteína específica dentro del fotosistema II o, más específicamente, a un par de clorofilas dentro de esa proteína. ¿Qué pasa ahí?
El primer objetivo de la fotosíntesis es la producción de ATP. Al igual que en la fosforilación oxidativa, esa tarea se logra liberando energía a través de una cadena de transporte de electrones. En general, los electrones necesitan ser transferidos de una posición de alta energía (o bajo potencial) a baja energía (o alto potencial). La fotoexcitación ayuda a ese proceso porque conduce a la formación de un agujero de baja energía así como de un electrón de alta energía.
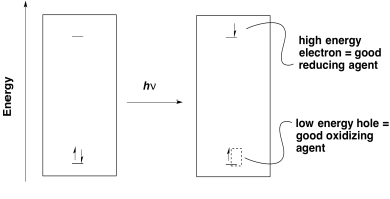
Una vez que un electrón ha sido excitado, se encuentra a un nivel de energía mucho más alto. Puede deslizarse fácilmente cuesta abajo a un orbital aceptor de menor energía. Tenga en cuenta que el nivel de energía de la órbita aceptora podría estar en cualquier lugar por debajo del nivel electrónico superior en el estado excitado. Incluso podría estar por encima del nivel electrónico original en el estado base. Eso significa que una transferencia de electrones que habría sido cuesta arriba si ocurriera desde el estado base ahora sería cuesta abajo desde el estado excitado.
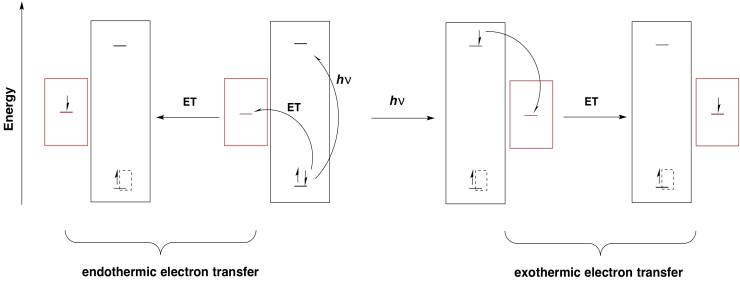
Además, cualquier donante que esté por encima del nivel electrónico original en energía podría dejar caer un electrón en el nuevo agujero. Sin fotoexcitación, la donación de electrones sería mucho más endotérmica.
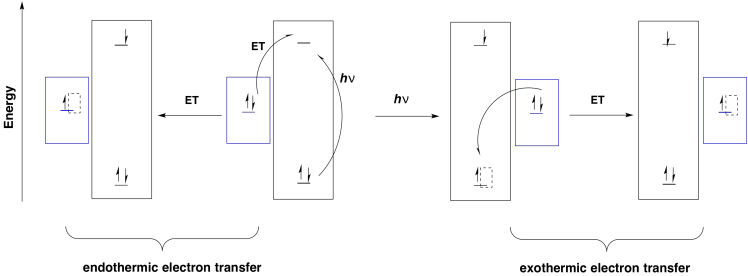
El centro de reacción a veces se conoce como P680, para el pigmento 680, llamado así porque tiene un máximo de absorbancia UV-Vis a 680 nm. Podría absorber la luz visible directamente, pero lo más probable es que se excita por la transferencia de energía de las moléculas de antenas circundantes en el complejo de recolección de luz. El centro de reacción está compuesto en realidad por dos pares de clorofilas. Una de estas parejas se sienta muy cerca la una de la otra; son paralelas entre sí y se superponen tan estrechamente que prácticamente se tocan. Este par especial se llama dímero de clorofila, y a cada clorofila individual dentro del par a veces se le da la abreviatura P D1 o P D2.
Estas dos clorofilas especiales forman un dímero excitónico. Eso significa que las dos moléculas se comportan como si fueran una sola molécula durante un evento fotoquímico. Cuando se absorbe un fotón, o la cantidad equivalente de energía transferida de otra molécula, el dímero excitónico entra en un estado excitado en el que se ha pasado un electrón de una clorofila a otra.
\[P680 \rightarrow P680* \nonumber\]
o
\[P_{D1}P_{D2} \rightarrow P_{D1}^{+}P_{D2}^{-}* \nonumber\]
¿Por qué sucedería eso, desde una perspectiva biológica? Tal vez la separación electrónica simplemente hace que la mitad de un mejor agente reductor (es negativo) y la otra mitad un mejor agente oxidante (es positivo). Alternativamente, esa separación del electrón y el agujero entre dos moléculas diferentes podría conducir a un proceso fotorredox más eficiente al hacer la relajación un poco más difícil. Ciertamente, el electrón excitado podría recombinarse con el agujero a través de la misma vía por la que se formó, con transferencia de energía de regreso a una molécula circundante. Sin embargo, otras vías de relajación son menos probables. Sería poco probable que la mitad P680 - * se relajara a través de una simple cascada a través de estados vibracionales ya que el electrón no encontraría ningún agujero para caer en esa molécula.
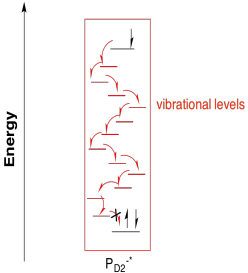
En cambio, el electrón excitado entra en una vía de transporte de electrones. El electrón se transfiere primero a una clorofila a (ChLD1) cercana. A partir de ahí, sigue una transferencia inmediata y rápida a una molécula de feofitina. Una feofitina es realmente solo una clorofila sin un ion magnesio en el medio.
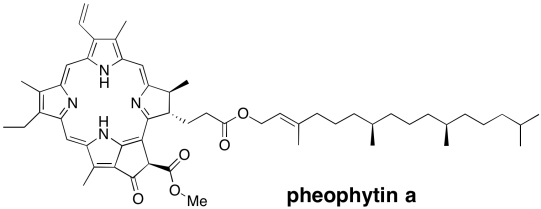
La reducción de la feofitina da como resultado un anión deslocalizado por resonancia. Mostrar una estructura de resonancia del anión radical:
- con un anión centrado en oxígeno.
- con un anión centrado en nitrógeno.
- Contestar a
-
Con base en las estructuras de las análogas clorofila a y clorofila b, que se esperaría que tuvieran un potencial de reducción más positivo: ¿feofitina a o feofitina b?
- Contestar
-
La feofitina b es probablemente más electrófila debido al grupo de formilo extra (-HC=O). A primera vista, se esperaría que tuviera un potencial de reducción más positivo.
El destino posterior en la cadena de transporte de electrones es una plastoquinona. Al igual que las ubiquinonas relacionadas que se encuentran en la fosforilación oxidativa, las plastoquinonas son portadores móviles de dos electrones. Los portadores de electrones móviles son necesarios para transportar electrones de un complejo a otro. Las plastoquinonas también son bastante lipofílicas, por lo que su rango de movimiento está restringido a la membrana tilacoidea. Esa restricción aumenta la eficiencia de la fotosíntesis al hacer poco probable que los electrones transportados se pierdan en otra parte de la célula.
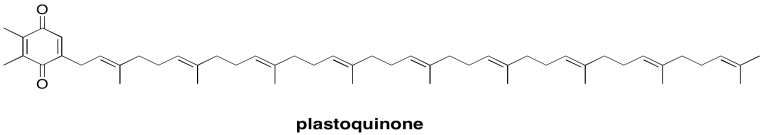
Mostrar el producto de la reducción de dos electrones y dos protones de plastoquinona (plastoquinol).
- Contestar
-
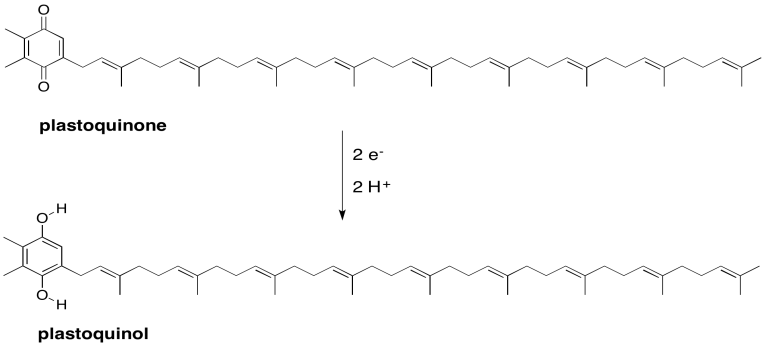
En realidad hay dos plastoquinonas en la cadena de transporte de electrones, sin embargo, y sólo la segunda es móvil. El primero está unido covalentemente a la proteína. Las dos plastoquinonas tienen diferentes potenciales de reducción, probablemente por sus entornos, por lo que la primera plastoquinona no sólo actúa como un escalón hacia la segunda, sino que también permite una pérdida de energía más gradual a medida que los electrones ruedan cuesta abajo. En este punto, el segundo plastoquinol deja atrás el fotosistema II y viaja al complejo b6f, que jugará un papel importante en la producción de ATP a través del bombeo de protones.
Sin embargo, no hemos terminado del todo con Fotosistema II. ¿Qué pasó con ese agujero que quedó atrás en el dímero excitónico? P D2 + * es bastante significativo; ha sido descrito como el agente oxidante más poderoso de la naturaleza. Tiene que ser: su trabajo es en última instancia oxidar el agua a dioxígeno. Recuerde, la reacción opuesta, la reducción del dioxígeno a agua, sirvió como destino final para los electrones durante la fosforilación oxidativa. Esa media reacción exotérmica sirvió como parte de la fuerza impulsora para la cadena de transporte de electrones, el bombeo de protones asociado y la formación de ATP. Para impulsar esa reacción hacia atrás mediante la extracción de electrones del agua requerirá un agente oxidante muy fuerte.
De hecho, el potencial de reducción de P D2 + * se ha estimado en +1.3 V (vs SHE); eso es bastante positivo. A modo de comparación, el potencial de reducción del dioxígeno en condiciones ácidas es de +1.229 V (vs SHE).
¿Cuál es el potencial de reacción para la oxidación del agua por P D2 + *?
- Contestar
-
ΔE = E o (rojo) - E o (buey) = 1.3 - 1.229 V = 0.07 V
En cierto sentido, el centro de reacción no se encuentra en absoluto en el inicio de la cadena de transporte de electrones. Está a mitad de camino; el verdadero inicio de la cadena de transporte de electrones es el agua. Los electrones del agua caen en el agujero en P D2 + *, formando un P680 completo. El P680 absorbe un fotón, enviando el electrón hasta llegar a P D1 - *, y hacia abajo caen de ahí a lo largo del resto de la vía. El centro de reacción es como el motor en un remonte o montaña rusa, tirando de electrones y luego enviándolos pasados a su próximo destino.
En realidad hay un par de intermediarios entre P D2 + * y el agua, sin embargo. El más cercano es un residuo de tirosina. Proporciona el electrón que reemplaza inmediatamente al que ha sido enviado fuera del centro de reacción.
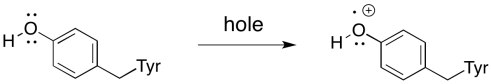
El siguiente intermediario es el complejo evolutivo de oxígeno. El complejo evolutivo de oxígeno es un grupo oxo de manganeso que separa electrones del agua mientras que, al mismo tiempo, los combina para producir dioxígeno.
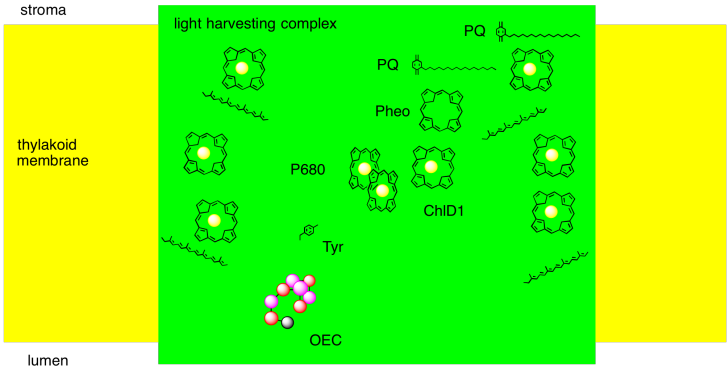
Podemos resumir los eventos del fotosistema II en un par de formas. Una forma es tratar de imaginarse, aproximadamente, cómo los diferentes jugadores involucrados hasta ahora están dispuestos en el complejo proteico. Podemos imaginar cómo se absorbe un fotón y cómo esa energía pasa al centro de reacción. Podemos imaginar un camino para el electrón a través de este sistema, también.
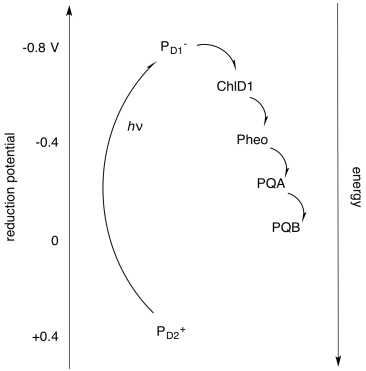
Alternativamente, es útil mostrar estos componentes no en el espacio físico, sino en energía o espacio potencial. Al observar los potenciales de reducción de la especie, podemos comenzar a imaginar cómo funciona la cadena de transporte de electrones, y podemos ver más claramente el papel que juega la absorción de luz. El fotón absorbido eleva el electrón desde un nivel de energía bajo (correspondiente aproximadamente al potencial de reducción de P D2 + *) a uno mucho más alto (correspondiente al potencial de reducción de P D1 - *). Además, podemos entender otra razón por la que el electrón no se relaja simplemente de nuevo al estado fundamental después de que el centro de reacción se excita: el electrón se transporta rápidamente cuesta abajo a través de otra vía, lo que implica la transferencia a otras moléculas.
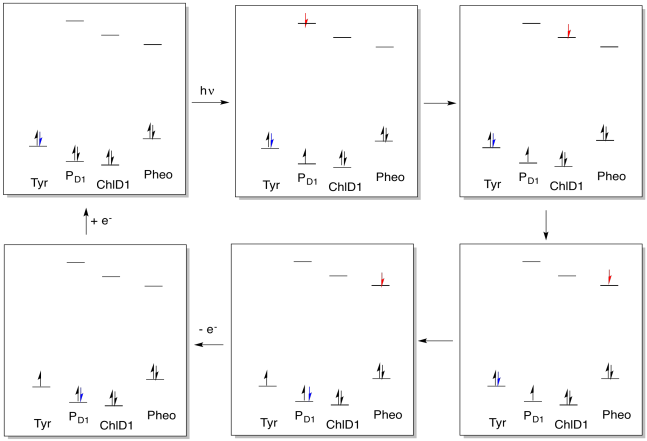
La actividad dentro del fotosistema II puede ser pensada como un ciclo catalítico. Dibujar los cambios en las poblaciones electrónicas de las especies de abajo como resultado de la secuencia de eventos que inicia con la absorción de fotones.
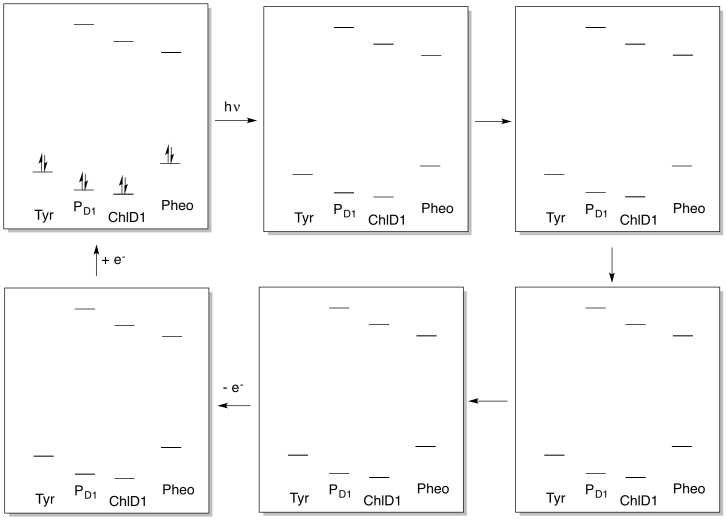
- Contestar
-
1. Estructuras cristalinas de rayos X: Deisenhofer, J., Epp, O., Sinning, I., Michel, H. Refinamiento cristalográfico a 2.3 A de resolución y modelo refinado del centro de reacción fotosintético de Rhodopseudomonas viridis. J. Mol. Biol. 1995, 246, 429-457. Imágenes obtenidas a través del Banco de Datos de Proteínas RCSB (1PRC).

