9.5: Fotosistema II - El Complejo Evolucionador de Oxígeno
- Page ID
- 79365
Puede recordar que el complejo evolutivo de oxígeno se encuentra en lo profundo del Fotosistema II. Se encuentra cerca de ese haz de láminas beta con código amarillo en la parte inferior izquierda de la imagen de abajo; esa parte del complejo se llama proteína estabilizadora de manganeso. Recuerde, el Fotosistema II está incrustado en la membrana tilacoidea. La membrana rodea la porción rosa de las hélices alfa en la mitad superior de la imagen. El estroma, el medio acuoso que rodea al tilacoide, se encuentra en la parte superior de la imagen. En la parte inferior de la imagen, la proteína está sumergiendo sus dedos de los pies en el lumen; ese es el medio acuoso dentro del tilacoide.
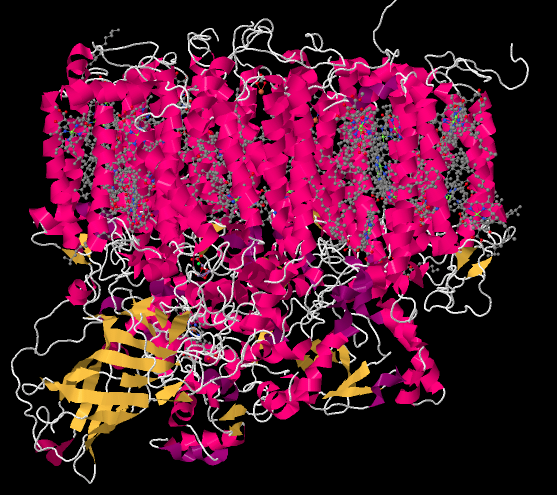
Cuando eliminamos todas las proteínas, nos quedamos con una serie de ligandos que estaban incrustados en su interior. Eso incluye el complejo de recolección de luz que ya hemos visto, así como el pequeño grupo de átomos llamado complejo evolutivo de oxígeno (OEC). El OEC se encuentra un poco más abajo en la imagen, en el borde del lumen. Se pueden ver sus átomos de manganeso, de color púrpura en esta imagen, así como oxígenos rojos y calcio gris, a mitad de camino hacia abajo y un poco a la izquierda.

Vamos a acercarnos para una mirada más cercana. Un par de átomos callejeros son visibles en la imagen, pero se centran en los átomos que están conectados entre sí. Los “radios” significan que el software de cristalografía de rayos X ha decidido que estos átomos están lo suficientemente cerca entre sí como para que estén unidos entre sí. Los átomos de manganeso púrpura podrían no estar realmente unidos entre sí en términos de compartir un par de electrones entre los átomos, pero están acoplados magnéticamente, compartiendo electrones en un sentido diferente. Podemos ver que los átomos casi forman un cubo, aunque tiene una esquina rasgada abierta. No es diferente a un racimo de FeS, solo con manganeso y oxígeno en lugar de hierro y azufre.
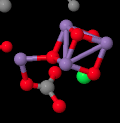
La tarea de este pequeño cubo es llevar a cabo una reacción que es indispensible para nuestra existencia en la tierra. Necesita convertir el agua en oxígeno. Desde un punto de vista evolutivo, existe una clara ventaja en el uso del agua como fuente de electrones. Hay un suministro casi interminable: tenemos océanos llenos de él en este planeta. El problema es que eliminar un electrón del agua da como resultado un radical oxígeno; en bioquímica, esto se llama especie reactiva de oxígeno. Las especies reactivas de oxígeno pueden ser personajes caóticos, malvados dentro de una célula, reaccionando indiscriminadamente con cualquier otra estructura con la que contacten. Por esa razón, sería más seguro oxidar el agua hasta llegar a dioxígeno.
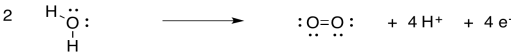
Utilizar las estructuras de Lewis para confirmar el número de electrones involucrados en la oxidación del agua.
- Contestar
-

Esa oxidación de cuatro electrones del agua es una tarea bastante desafiante. El evento opuesto, la reducción de cuatro electrones del dioxígeno al agua, sirvió como sumidero termodinámico para la cadena de transporte de electrones en la fosforilación oxidativa. Sin embargo, también fue bastante desafiante, ya que requirió la rápida introducción de cuatro electrones en el sistema para reducir completamente el dioxígeno al agua, sin la formación de especies de oxígeno reactivo libre que pudieran causar estragos en la célula.
En ese caso, el problema se resolvió a través de una gran cantidad de átomos de hierro y cobre dentro del Complejo IV, sirviendo como reservorio de electrones para una rápida reducción. Además, el sitio real de reducción fue un par de hierro y cobre de fraguado cerrado, permitiendo que el dioxígeno se puenteara entre dos metales para ayudar en esa rápida reducción.
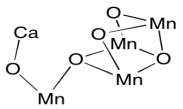
El complejo evolutivo de oxígeno utiliza una estrategia similar, pero con un sesgo inverso. El cúmulo de iones manganes proporciona un reservorio de agujeros en lugar de electrones, lo que permite la rápida oxidación del agua a dioxígeno. El papel del ion calcio no está claro, ya que el calcio no es redox activo; siempre es Ca 2+. Recuerde, los metales en las primeras columnas de la tabla periódica siempre se encuentran en sus estados máximos de oxidaciones, correspondientes a una configuración de gas noble. Sin embargo, puede desempeñar otro papel en la unión del agua o la estabilización del cúmulo.
Puede ser útil saber qué iones metálicos son típicamente redox activos y cuáles no (es decir, aquellos metales que siempre se encuentran en el mismo estado de oxidación). Para los siguientes metales, indique si el metal es redox activo y proporcionar su (s) estado (s) de oxidación más común (s).
a) Fe b) Mg c) Cu d) Li
e) Zn f) Sc g) Co h) Cr
- Contestar a
-
a) Fe (II, III) activo
- Respuesta b
-
b) Mg (II) inactivo
- Respuesta c
-
c) Cu (I, II) activo
- Respuesta d
-
d) Li (I) inactivo
- Respuesta e
-
e) Zn (II) inactivo
- Respuesta f
-
f) Sc (III) inactivo
- Respuesta g
-
g) Co (II, III) activo
- Respuesta h
-
h) Cr (II, III) activo
Recuerde que existe un intermediario entre P680 + * y el complejo evolutivo de oxígeno. Existe un residuo de tirosina, llamado Tyr161 por su posición en la estructura primaria de la proteína, situado entre el complejo evolutivo de oxígeno y P680 + *. Conduce el electrón del manganeso a la clorofila en el centro de reacción. Un electrón se transfiere primero de Tyr161 a P680 + *. Un electrón de manganeso luego reemplaza al electrón faltante en Tyr161.
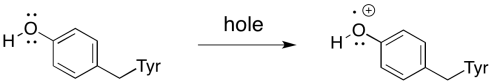
Se necesita la eliminación de cuatro electrones para oxidar el agua a oxígeno, así que todo eso tiene que suceder cuatro veces. Cuatro fotones deben ser absorbidos, excitando P680 cuatro veces. Cada vez, un electrón de Tyr161 reemplaza al electrón que se excitó desde el estado fundamental en P680, dejando atrás un agujero. El electrón en Tyr161 es reemplazado por un electrón de manganeso. Estos eventos se ilustran en un mecanismo general llamado ciclo Kok (ciclo pronunciado de “coque”).

El ciclo Kok ilustra el almacenamiento de agujeros en los átomos de manganeso. Los agujeros son solo los lugares donde solían estar los electrones. Podemos pensar en ellos como una acumulación de carga positiva. El ciclo también muestra uno de los pasos en la oxidación del agua que se evidencia en la ecuación para la reacción: la pérdida de cuatro protones. La pérdida de protones está probablemente ligada directamente a la oxidación de los iones manganeso. Cada vez que un átomo o molécula se carga más positivamente, se vuelve más ácido.
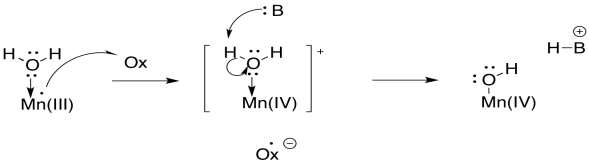
Desde el punto de vista de la molécula de agua, el solo hecho de unirse a un manganeso hace que sea más probable que pierda un protón, porque está donando electrones a otro átomo y con ello asumiendo una carga positiva formal sobre el oxígeno. Entonces, una molécula de agua se vuelve mucho más ácida cuando se une a un átomo metálico. Ese es un evento común en la bioquímica. La acumulación de carga positiva adicional sobre el manganeso hace que esta desprotonación sea aún más probable.
En cuanto a cómo se forma el enlace O-O, son concebibles diferentes vías, pero la posibilidad más simple implica la activación del agua como nucleófilo. La desprotonación da como resultado un ion hidróxido. Aunque el hidróxido está unido al átomo metálico, la polaridad del enlace permite que el hidróxido se comporte como un nucleófilo.
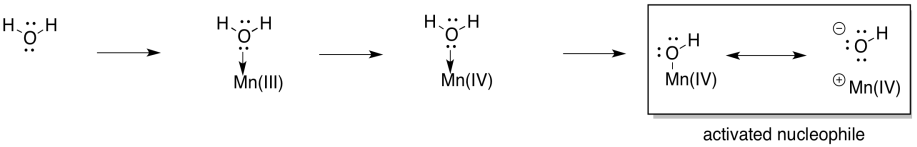
En este punto, también se ha visto que el agua se activa como un ion hidróxido nucleófilo en otras vías bioquímicas, por lo que este desarrollo no debería ser una gran sorpresa. ¿Qué pasa con un electrófilo? Bueno, una forma de proporcionar un electrófilo es desprotonar el hidróxido para hacer un oxo metálico. Esa desprotonación podría estar ligada a otra oxidación al manganeso.
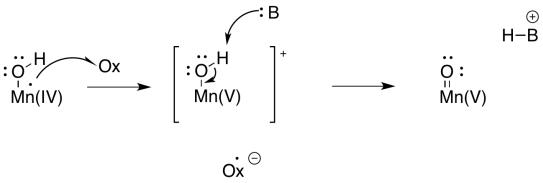
Los compuestos oxo metálicos pueden desarrollar carácter electrofílico al oxígeno debido a la donación π de oxígeno a un ion metálico en un estado de oxidación alta. La donación de un par solitario al metal daría al oxígeno una carga positiva formal. El oxígeno se activaría como electrófilo.
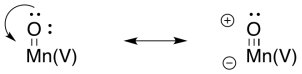
En ese punto, es fácil imaginar cómo un oxígeno (un ligando hidroxi) podría actuar como nucleófilo mientras que un segundo (un ligando oxo) actúa como electrófilo. Se formaría un enlace O-O, acompañado de una reducción de dos electrones en manganeso.

La formación de un segundo enlace O=O resultaría en una segunda reducción de dos electrones en manganeso. En dos sencillos pasos, se ha logrado la reducción completa de cuatro electrones del manganeso, y la oxidación de cuatro electrones del agua. Debido a que hay cuatro iones manganeso dentro del cúmulo, es una cuestión sencilla redistribuir los electrones para que los iones manganeso tengan estados de oxidación similares.

Por supuesto, debido a que estamos tratando con un cúmulo oxo de manganeso en lugar de un ión manganeso individual, los electrones pueden reorganizarse en cualquier momento. Los estados de oxidación en los clusters son complicados, debido a la facilidad de transferir o incluso deslocalizar electrones dentro del sistema.
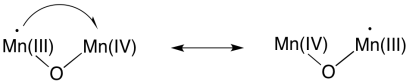
Nuevamente, hay otros mecanismos posibles, y sabes bastante química en este punto como para poder proponer algunas alternativas.
- Proponer un mecanismo alternativo para la evolución del oxígeno mediante pasos mecanicistas organometálicos clásicos (adición oxidativa, eliminación reductiva, inserción, beta-eliminación).
- ¿Qué productos secundarios podrían detectarse si este mecanismo funcionara?
- Proponer un mecanismo alternativo para la evolución del oxígeno mediante pasos mecanicistas radicales.
- ¿Qué productos secundarios podrían detectarse si este mecanismo funcionara?
Un último punto sobre el complejo evolutivo de oxígeno. El objetivo de la fotosíntesis es hacer ATP; ese ATP se utilizará para convertir CO 2 en carbohidratos. La forma de hacer ATP en este caso es usar una cadena de transporte de electrones para liberar suficiente energía para generar un gradiente de protones. El agua es el punto de partida para esa cadena de transporte de electrones. Pero espera, hay un bono: con tan solo oxidar el agua, hemos liberado protones en el lumen. Eso es una ventaja para establecer un gradiente de protones.
1. Estructuras cristalinas de rayos X: Ferreira, K.N.; Iverson, T.M.; Maghlaoui, K.; Barber, J.; Iwata, S. Arquitectura del centro fotosintético de evolución de oxígeno. Ciencia 2004, 303, 1831-1838. Imágenes obtenidas a través del Banco de Datos de Proteínas RCSB (1S5L).

