9.6: Adición de una Bomba de Protones - Complejo Citocromo b6f
- Page ID
- 79364
El objetivo de la fotosíntesis es producir ATP, que a su vez se utiliza para producir carbohidratos a través de la captura de carbono. El ATP se genera mediante un gradiente de protones, el cual a su vez se mantiene a través de una cadena de transporte de electrones. El complejo citocromo b 6 f es muy análogo al complejo III en la fosforilación oxidativa. Desempeña un papel importante en la generación de un gradiente proteico durante la fotosíntesis.
A continuación se muestra una estructura cristalina de rayos X del citocromo b 6 f. Una vez más, es una proteína unida a la membrana. El estroma se encuentra en la parte superior de la imagen y el lumen en la parte inferior.

A continuación se proporciona la vista de ligando-solo de la estructura. Podemos ver una estructura dimérica aquí, con la mitad izquierda reflejando la mitad derecha. Cerca de la parte inferior de cada dímero, hay un hemo. Justo encima de eso, podemos ver un clúster de FeS; en realidad es un clúster 2Fe2S, y específicamente un clúster Rieske. Eso es igual que el clúster de FE en el complejo III. Los clusters de Rieske tienen potenciales de reducción muy positivos debido a su entorno de coordinación único.

Por encima de los clusters Rieske, las cosas se vuelven un poco más abarrotadas. Hay un par de hemos más en cada lado con sus átomos de hierro rojos, así como una clorofila con su magnesio mostrado en amarillo. Además, hay muchas estructuras terpenoides, como los carotenoides. No todos estos ligandos tienen roles que se entienden claramente, y nos centraremos en lo esencial.
El citocromo b 6 f se muestra de forma simplificada en un diagrama a continuación. Onle se muestra una de las dos unidades en el dímero. Cada unidad es en sí misma un complejo relativamente pequeño, que contiene sólo cuatro proteínas: el ciclcromo b 6, el citocromo f, una proteína Rieske y la “subunidad IV”, cuyo papel no se entiende bien.
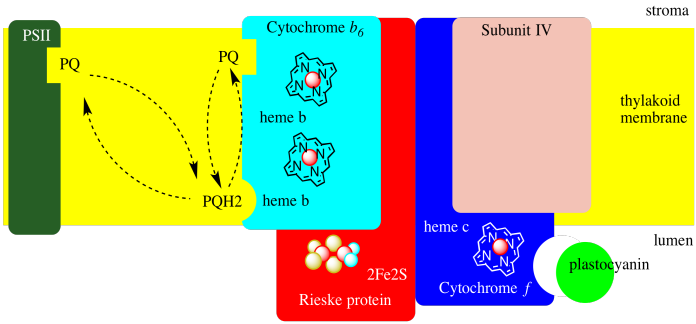
El fotosistema II finalmente produce un plastoquinol móvil que viaja a través de la membrana tilacoidea al citocromo b 6 f, uniéndose cerca del lado del lumen de la membrana. La plastoquinona libera sus dos electrones y sus dos protones y puede regresar al fotosistema II para más. Alternativamente, la plastoquinona podría simplemente viajar a través del lado del estroma de la mebrana, donde puede recoger dos nuevos protones del estroma, así como dos electrones más.
¿De dónde vienen los dos electrones? Se reciclan en el “Q-loop”. Cuando llega al cictocromo b 6 f, en lugar de enviar ambos electrones a lo largo de la cadena de transporte de electrones, la plastoquinona solo envía un electrón en esa dirección. Ese primer electrón viaja al cúmulo Rieske FeS, luego a un citocromo f (que es un citocromo b que se encuentra en las plantas), y finalmente a un portador de electrones móvil soluble, plastocianina.
El otro electrón viaja en la otra dirección, de regreso hacia el estroma, a través de un par de hemes. Después de que dos plastoquinoles hayan entregado sus electrones al citocromo b 6 f, una plastoquinona en espera puede reducirse nuevamente a plastoquinol, recogiendo dos protones más del estroma. Ese plastoquinol puede entonces viajar de regreso a través de la membrana para entregar sus dos protones a la luz. Uno de sus electrones es enviado por la cadena de transporte de electrones, y el otro electrón se recicla (de nuevo).
La ventaja del Q-loop se explica en el siguiente diagrama. En el diagrama, las entradas al citocromo b 6 f se muestran en rojo, las salidas se muestran en azul y los elementos reciclados en verde. Si un plastoquinol simplemente entregara sus electrones y protones y se hiciera, habría dos protones entregados por plastoquinol. Esa es una salida de protones por electrón que fue entrada.
Un segundo plastoquinol haría exactamente lo mismo. Habría cuatro protones de salida para cuatro electrones inicialmente de entrada. Eso sigue siendo una salida de protones por electrón que fue entrada.
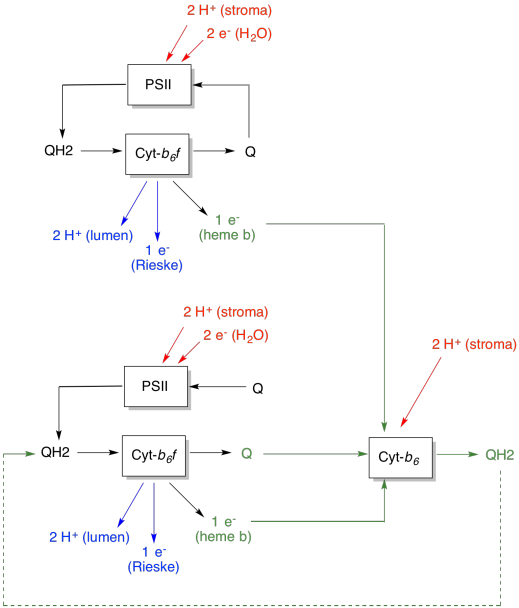
Si, en cambio, se recicla un electrón cada vez, entonces cada segundo plastoquinol conduce a la entrega de un par extra de protones. Eso es porque al recoger los electrones reciclados, una plastoquinona ha tenido que viajar de regreso al lado del estroma de la membrana y recoger dos protones más. En general, eso significa que se entregan seis protones para la entrada de cuatro electrones, o 1.5 protones de salida por entrada de electrones. Dado que el gradiente de protones es lo que está generando el ATP, entonces al aumentar el número de protones bombeados por electrón que entra, se incrementa la eficiencia.
La ventaja de eficiencia es incluso mayor que la descrita anteriormente. Se cree que el bucle Q duplica la cantidad de protones bombeados por el citocromo b6f. Explique por qué.
- Contestar
-
El primer par de plastoquinoles recicla dos electrones entre ellos, bombeando dos protones adicionales a través de un quinol reciclado. La salida de protones es 1.5 veces lo que sería sin el Q-loop (desde 1 protón/electrón + 0.5 protón/electrón). Ahora recuerda que este quinol reciclado también entrega dos electrones, uno de los cuales es reciclado. Para obtener un segundo electrón para generar un nuevo quinol reciclado, tendríamos que pasar de nuevo por todo el ciclo de dos nuevos plastoquinoles. Obtendríamos otros dos protones pero habría requerido ocho electrones para llegar allí, o 0.25 protones de salida por entrada de electrones. La salida de protones aumentaría a 1.75 veces lo que sería sin el bucle Q (desde 1 protón/electrón + 0.5 protón/electrón + 0.25 protón/electrón + 0.25 protón/electrón). Una serie resultará si seguimos adelante. La serie es de 1 + 1/2 + 1/4 + 1/8 + 1/16 +... + 1/2 n, y convergerá a 2. Por lo tanto, el bucle Q duplica el número de protones bombeados a través de la membrana.
La cadena de transporte de electrones a través del citocromo b6f es bastante corta. El electrón se pasa primero a un “cúmulo de FeS de alto potencial”, o clúster Rieske. Se diferencia de la mayoría de los grupos de FeS en que dos de los residuos de aminoácidos que lo unen en la proteína son histidinas, en lugar de las cisteínas habituales. Los clústeres de Rieske suelen tener mayores potenciales de reducción que otros clústeres de FE. Fueron uno de los últimos de una serie de cúmulos de FeS encontrados en la cadena de transporte de electrones en fosforilación oxidativa, y su potencial de reducción más positivo fue necesario para mantener la cadena de transporte de electrones moviéndose en la dirección correcta.

El potencial de reducción de un clúster de FE de Rieske es generalmente más positivo que el de un clúster de FE regular, en el que el núcleo Fe 2 S 2 se mantiene en su lugar por cuatro cisteínas. Explique por qué.
- Contestar
-
El factor principal parece ser la estabilización de carga. Supongamos que ambos átomos de hierro comienzan como Fe (III). Tienen una carga total de 6 +. Los dos sulfuros son cada uno 2 -, para una carga total de núcleo Fe 2 S 2 de 2 +. Si se liga por cuatro cisteínas (Cys-S -), entonces la carga general del compuesto de coordinación es 2 -. La adición de un electrón resultará en un incremento en la carga negativa, a 3 -. Ahora, eso fue a partir del estado totalmente oxidado. Si en cambio comenzamos en un estado mixto de oxidación Fe (II/III), entonces la adición de un electrón da como resultado una carga 4 en el complejo de coordinación. Esa acumulación de carga será energéticamente difícil.
Si están ligadas por dos cisteínas (Cys-S -) y dos histidinas neutras, entonces la carga general del compuesto de coordinación es 0. La adición de un electrón resultará en una carga negativa, 1 -. Si en cambio comenzamos en un estado mixto de oxidación Fe (II/III), entonces la adición de un electrón da como resultado una carga 2 en el complejo de coordinación. Esa menor acumulación de carga requerida en este caso será energéticamente menos difícil.
La parada final para el electrón es una proteína pequeña y soluble, la plastocianina. El portador de electrones en la plastocianina no es un átomo de hierro, sino más bien un átomo de cobre. El ion cobre, que puede alternar entre Cu + y Cu 2+, se mantiene en su lugar por dos histidinas, una metionina y una cisteína. La plastocianina transporta el electrón a través del lumen al siguiente complejo, el fotosistema I.
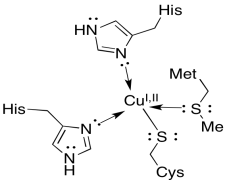
Usar tendencias periódicas para sugerir una razón por la cual un átomo de cobre aparece más tarde en la cadena de transporte de electrones, mientras que varios átomos de hierro aparecieron antes en la cadena.
- Contestar
-
El cobre está más a la derecha en la tabla periódica y, en consecuencia, es más electronegativo que el hierro. Esa es la razón principal por la que el cobre está por debajo del hierro en la serie de actividad o metales. Solo sobre esa base (e ignorando cualquier diferencia en el entorno de coordinación), podríamos esperar un potencial de reducción más positivo en un ion cobre que en un ion hierro. Por lo tanto, el cobre sería un mejor aceptor de electrones, y sería útil para crear una mayor fuerza impulsora para la transferencia de electrones más adelante en la cadena de transporte de electrones.
- ¿Cuál sería la carga general sobre el complejo de coordinación en plastocianina, asumiendo el estado Cu (II)?
- ¿Cuál sería la carga general sobre el complejo de coordinación en plastocianina, asumiendo el estado Cu (I)?
- Solo con base en consideraciones de carga, ¿cómo esperaría que se comparara el potencial de reducción de la plastocianina con el clúster Rieske FeS?
- Contestar a
-
a) Con un solo donante aniónico, la carga del complejo que contiene Cu (II) sería de 1 +.
- Respuesta b
-
b) Con un donante aniónico, la carga del complejo que contiene Cu (I) sería 0.
- Respuesta c
-
c) La reducción de plastocianina da como resultado una disminución de la carga, mientras que la reducción del conglomerado de FE da como resultado un aumento de la carga. Ese factor por sí solo podría hacer que la plastocianina sea más fácil de reducir, con un potencial de reducción más positivo.
1. Estructuras cristalinas de rayos X: Kurisu, G.; Zhang, H.; Smith, J.L.; Cramer, W.A. Estructura del complejo citocromo b6f de fotosíntesis oxigénica: afinación de la cavidad. Ciencia 200 3, 302, 1009-1014. Imágenes obtenidas a través del Banco de Datos de Proteínas RCSB (1VF5).

