9.8: ATP Sintasa
- Page ID
- 79381
Uno de los objetivos de la fotosíntesis es hacer ATP. El ATP se emplea frecuentemente en biología para impulsar reacciones cuesta arriba. La hidrólisis de ATP para dar ADP es una reacción cuesta abajo, por lo que libera energía.

La formación de ATP a partir de ADP requiere la adición de fosfato. Es una reacción cuesta arriba, así que la célula tiene que gastar energía para producir ATP. La ATP sintasa aprovecha un gradiente de protones para impulsar un rotor molecular, al igual que una rueda de molino, con el fin de acercar ADP y fosfato para que puedan formar ATP. Es posible que ya estés familiarizado con la ATP sintasa de la fosforilación oxidativa, donde funciona exactamente de la misma manera.
Se piensa que la ATP sintasa tiene tres estados. En estado “suelto”, el ADP y el fosfato (P i) pueden ingresar fácilmente al sitio de unión. Una vez que estos dos sustratos están en el sitio de unión, la enzima entra en el estado “apretado”, en el que el ADP y el fosfato se constriñen y forman ATP. En ese punto, la enzima pasa por una fase “abierta” en la que el ATP puede salir fácilmente.
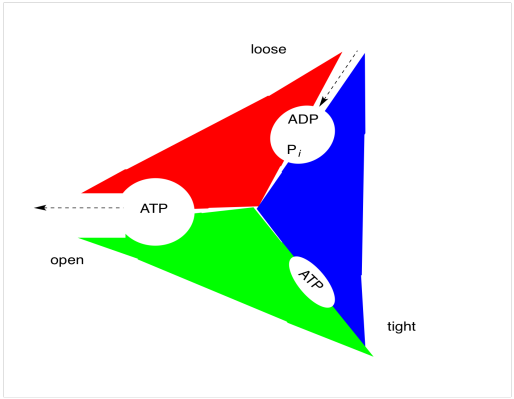
Al igual que en la fosforilación oxidativa, los cambios en los estados se acoplan a la rotación de una parte del complejo multiproteico (el rotor) con respecto a otra (el estator). El principio es similar al de un motor eléctrico. Si el estator está cargado positivamente y ciertas posiciones del rotor están cargadas negativamente, entonces las cargas opuestas se atraerán y el rotor comenzará a girar. Una vez que la parte cargada negativamente del rotor alcanza la parte cargada positivamente del estator, sin embargo, todo debería detenerse. La razón por la que no es porque un protón cae en la posición aniónica del rotor justo cuando se acerca al estator. Ahora neutralizada, esta posición ya no es atraída por el estator, y simplemente navega pasado. En tanto, otra posición aniónica se acerca al estator, manteniendo el rotor girando. Tan pronto como se encuentra a una distancia segura del estator, se abre un agujero debajo del rotor y los protones caen, regenerando una posición aniónica que vuelve a ser atraída hacia el siguiente estator.
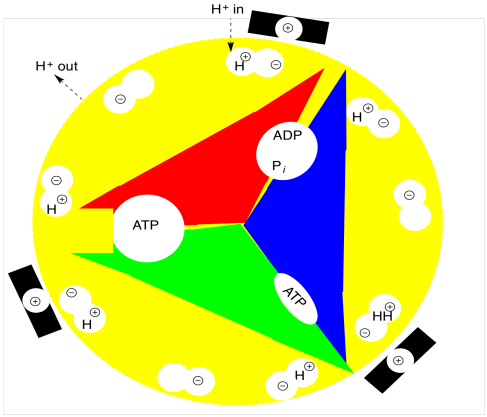
En el caso de la fotosíntesis, el protón está “cayendo” desde el lumen y luego “cayendo” en el estroma; su movimiento en esa dirección es impulsado por el gradiente de protones. De manera que ese gradiente de protones a su vez impulsa el movimiento del rotor. El movimiento del rotor, a su vez, impulsa cambios conformacionales dentro (y entre) las subunidades proteicas de la ATP sintasa. Esos cambios conformacionales promueven la formación de ATP a través de un efecto de aproximación.

