10.3: La reacción del aliso de Diels
- Page ID
- 79268
Como se señaló anteriormente, la reacción de Diels Alder es un ejemplo clásico de una reacción de cicloadición. Una reacción de cicloadición tiene mucho en común con una reacción pericíclica como un reordenamiento de Cope.

A diferencia de los reordenamientos Cope y Claisen, esta reacción suele ocurrir intermolecularmente (entre dos moléculas). Requiere un alqueno en una molécula y un dieno conjugado en la otra molécula. El alqueno es referido como un “dienófilo”; reacciona con el par conjugado de dobles enlaces. En el dibujo siguiente, el eteno y el 1,3-butadieno se etiquetan como dieno y dienófilo, respectivamente.

Dibuja flechas curvas para realizar un seguimiento de los electrones en la reacción de Diels Alder.
- Contestar
-

Dibujar el estado de transición aromática de la reacción de Diels Alder.
- Contestar
-
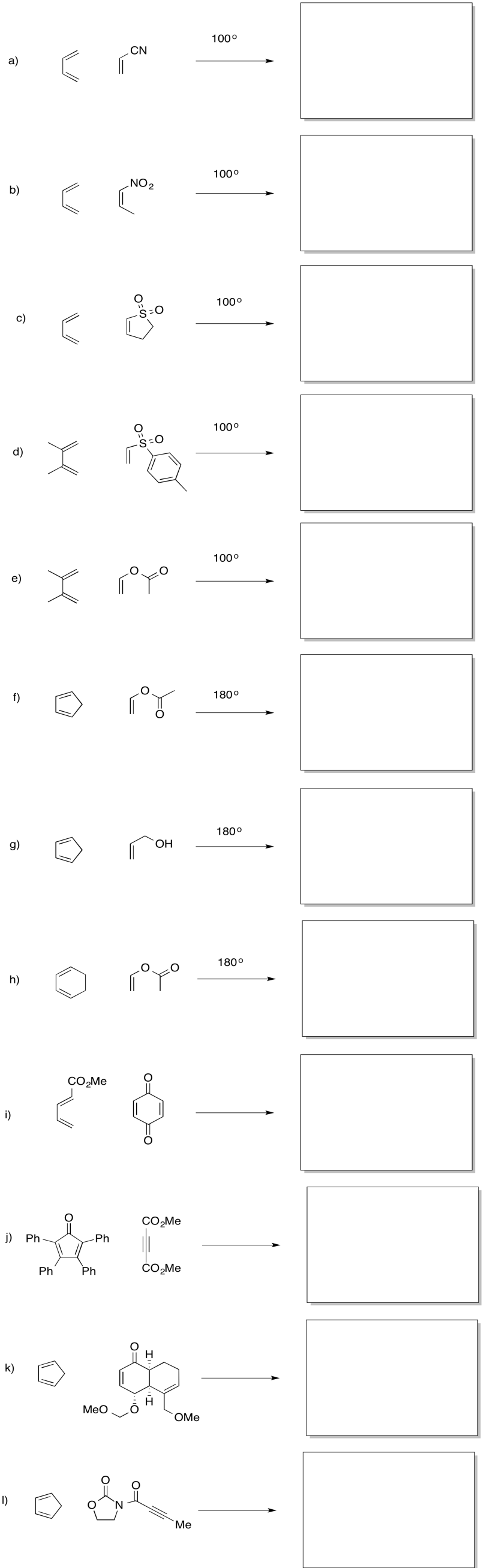
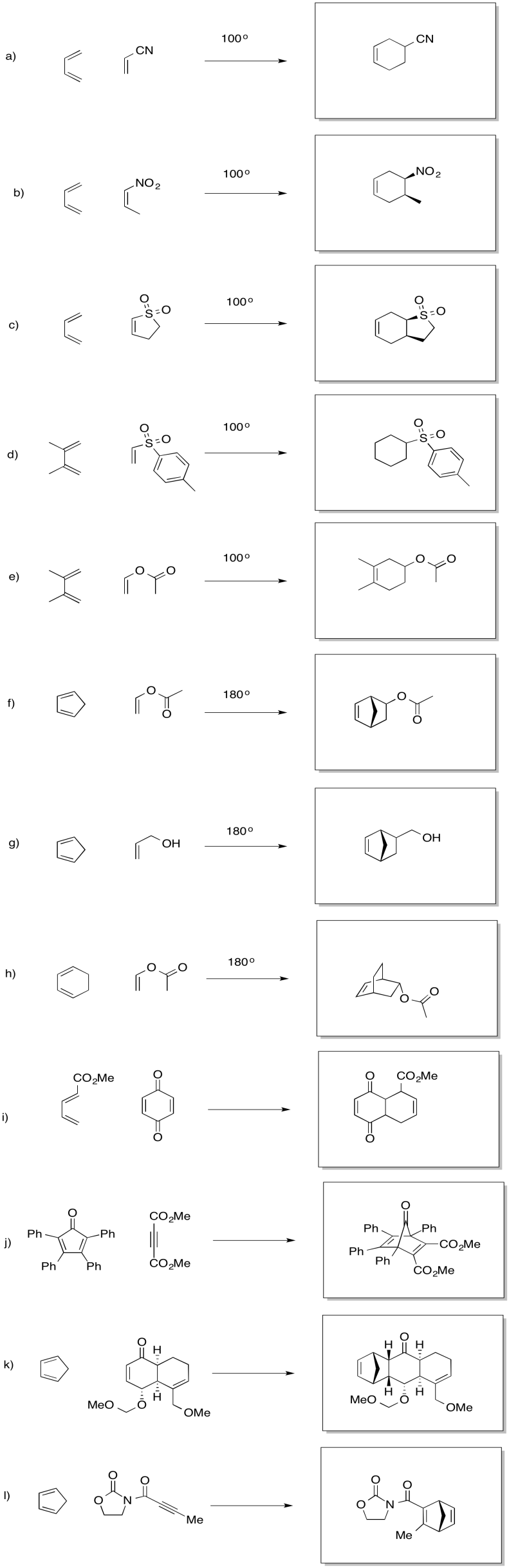
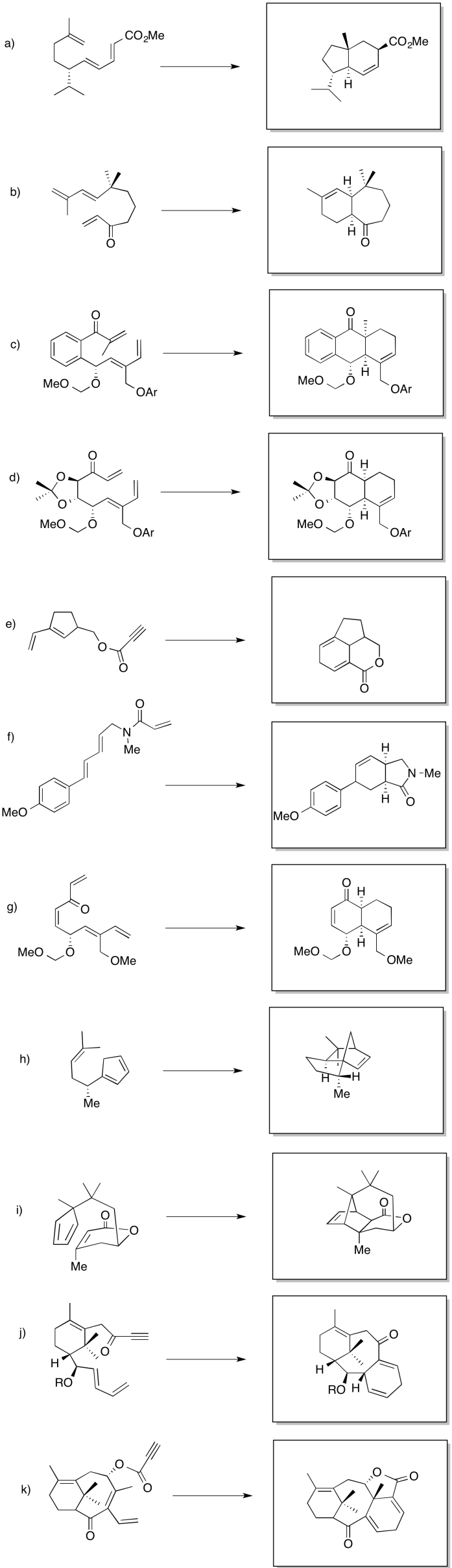
Proporcione productos para las reacciones de Diels Alder a continuación.
- Contestar
-
Aunque las reacciones de Diels Alder ocurren frecuentemente entre dos moléculas, también pueden ocurrir intramolecularmente. En estos casos, debe haber un alqueno en una parte de la molécula que sea capaz de alcanzar e interactuar con un dieno conjugado en otra parte. De alguna manera, las reacciones intramoleculares de Diels Alder pueden ser más fáciles que sus contrapartes intermoleculares por razones de entropía interna. En lugar de unir dos moléculas y combinarlas en una sola, el Diels Alder intramolecular comienza con una molécula para empezar.
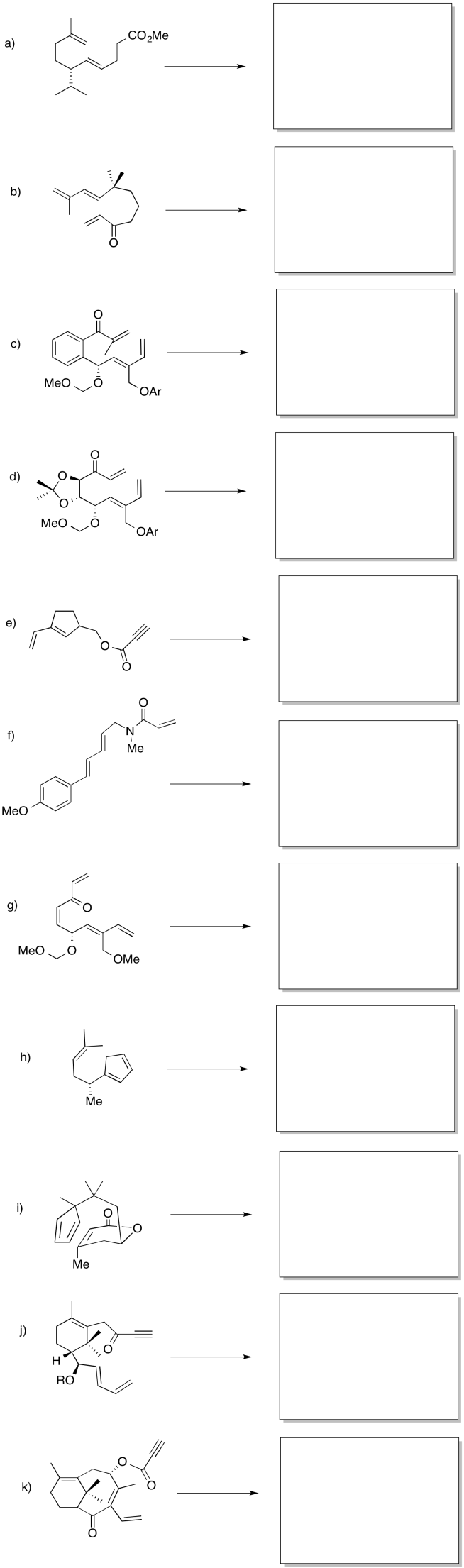
- Contestar
-
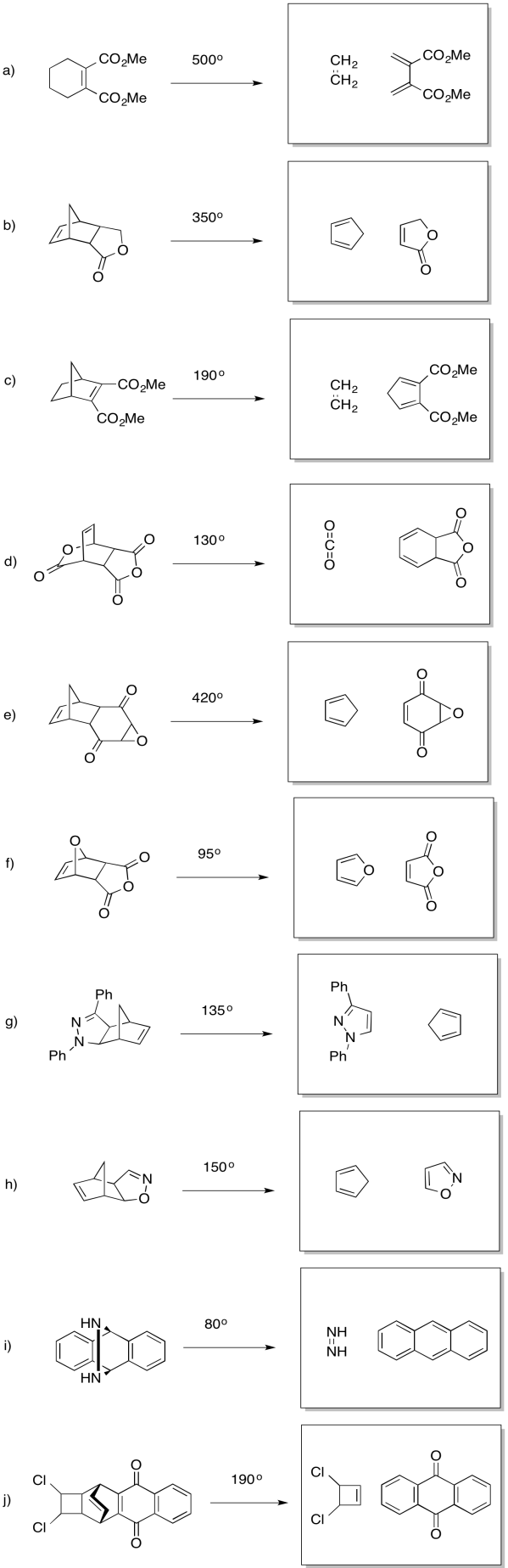
Muchas reacciones pericíclicos son reversibles. El proceso reversible suele denominarse de la misma manera que la reacción hacia adelante, pero con el prefijo “retro”. Por ejemplo, una reacción de Diels Alder y la correspondiente reacción de Retro-Diels Alder se muestran juntas a continuación.
Típicamente, las reacciones de Diels Alder ocurren a temperaturas bajas o moderadas (entre 25 °C y 100 °C es un rango común). En comparación, las reacciones retro Diels Alder requieren temperaturas más elevadas, a menudo superiores a 200 °C; la reacción directa se favorece a baja temperatura, mientras que la retroreacción se favorece a alta temperatura.
Dibuje flechas curvas para la reacción de Retro-Diels Alder para formar eteno y 1,3-butadieno.
Explicar por qué las temperaturas más altas promueven la reacción Retro-diels Alder usando la expresión de energía libre de una reacción,\(\Delta G = \Delta H - T \Delta S\)
- Contestar
-
La reacción de Alder retro-diels se ve favorecida entrópicamente, ya que dos moléculas están hechas de una molécula. En consecuencia, la energía se divide en estados adicionales porque los grados de libertad van en aumento. La entropía interna aumenta durante esta reacción. Matemáticamente, el término entropía es negativo en la expresión de energía libre, por lo que a medida que aumenta la entropía, la energía libre se vuelve más baja. Debido a que ese término es en realidad un producto de entropía y temperatura, un aumento de la temperatura tiene el efecto de amplificar la influencia de la entropía sobre la energía libre de la reacción. De ahí que esta reacción se vea favorecida por factores de entropía interna, que llegan a dominar a temperatura elevada.
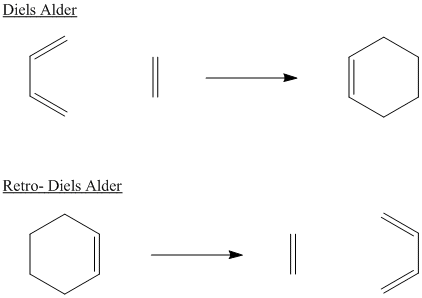
Proporcionar productos para las siguientes reacciones Retro-diels Alder.

- Contestar
-
En ocasiones, hay etapas posteriores que ocurren después de una reacción de cicloadición. Por ejemplo, la siguiente reacción de Diels Alder que implica naftol produce un producto tautomerizado. Mostrar el mecanismo para la secuencia de reacción.
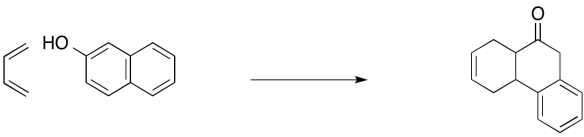
- Contestar
-
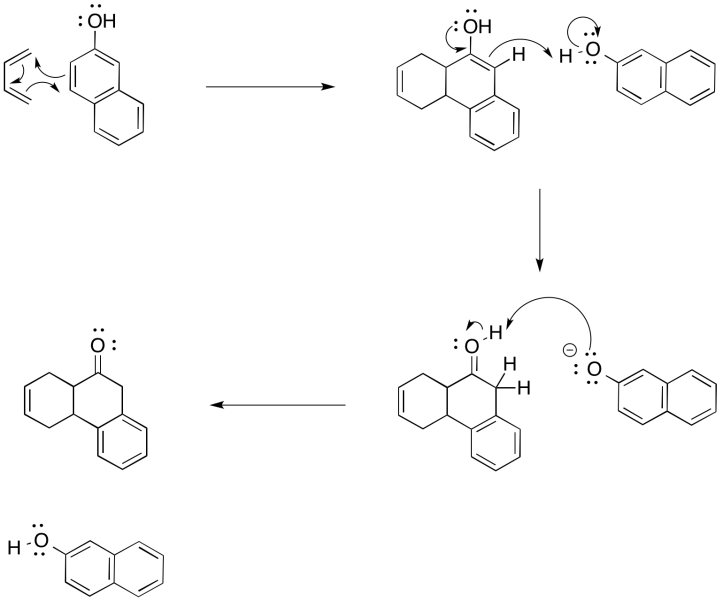
La reacción puede pensarse en términos de una reorganización de electrones entre estas dos moléculas. En la reacción de Diels Alder, podemos pensar en una interacción entre el LUMO en una molécula y el HOMO en la otra. Como sucede, el LUMO en una molécula tiene la simetría correcta de tal manera que puede superponerse y formar una interacción de unión con el HOMO en la otra molécula.
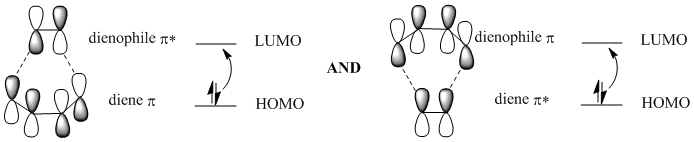
Preste atención a los dibujos orbitales p sobre los carbonos que se unirán entre sí para formar el anillo de seis miembros. Es importante que esos orbitales sean capaces de superponerse entre sí para formar una interacción en fase. De esa manera, estos átomos de carbono en los extremos del dieno y el dienófilo son capaces de unirse entre sí.
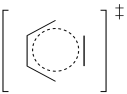
Una reacción de Diels Alder a veces se denomina reacción de adición [2+4]. Una unidad de 2 carbonos en una molécula interactúa con una unidad de 4 carbonos en otra molécula.
En contraste, la adición de un alqueno regular a otro alqueno regular se llamaría reacción de adición [2+2]. Si esta reacción ocurriera, dos alquenos se unirían para formar un anillo de cuatro miembros.

Sin embargo, las reacciones de adición [2+2] no ocurren sin circunstancias especiales. Más adelante veremos los requisitos para esa reacción.

