10.4: Regioquímica en las reacciones de Diels Alder
- Page ID
- 79254
La reacción de Diels Alder es la reacción de cicloadición más común. Permite la construcción de anillos de seis miembros, Estos anillos son muy comunes en pequeñas moléculas biológicas. Estos compuestos suelen ser de interés en la química medicinal y otras áreas de la biología química. Como resultado, con frecuencia son blanco en estudios sintéticos. Poder elaborar estos compuestos, así como compuestos que están estructuralmente relacionados, es una parte clave para llevar a cabo estudios que nos ayudarán a entender cómo funcionan en la naturaleza.
Cuando dos compuestos se combinan en una reacción de Diels Alder, se forma un nuevo anillo. Cada reactivo tiene dos extremos: hay dos extremos en el doble enlace en los dienófilos, y dos extremos en el dieno, también. ¿Qué extremo del dieno conecta con qué extremo del dienófilo? Esa es una cuestión de regioquímica, porque nos estamos preguntando dónde ocurre la reacción, o dónde se forman los nuevos enlaces.
Hemos pensado que las reacciones pericílicas son muy diferentes de las reacciones polares que involucran electrófilos y nucleófilos. Ese no siempre es el caso. De hecho, puede haber un componente polar pronunciado a estas reacciones. La cicloadición de moléculas polares suele ser mucho más rápida que las no polares, y puede acelerarse en presencia de ácidos de Lewis. Los ácidos de Lewis pueden actuar como catalizadores que activan los reactivos, haciéndolos aún más polares para que la atracción entre los dos componentes sea mayor.
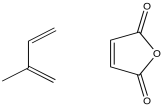
El anhídrido maleico se utiliza frecuentemente como dienófilo en las reacciones de Diels Alder. Explique cómo este componente potenciaría la interacción entre el dieno y el dienófilo en el siguiente caso.
- Contestar
-
El anhídrido maleico está polarizado, con densidad electrónica atraída hacia el grupo funcional anhídrido en un lado del anillo. Como resultado, el otro lado del anillo queda más positivo, y atraerá la densidad de electrones polarizables del dieno.

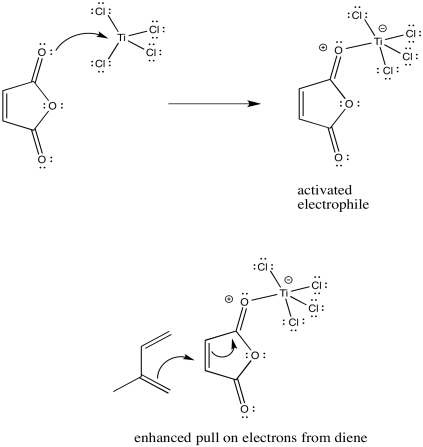
Mostrar cómo, en la pregunta anterior, se potenciaría la interacción entre las moléculas mediante la adición de un ácido de Lewis, como el tetrahloride de titanio, TiCl 4.
- Contestar
-
Los ácidos de Lewis frecuentemente activan compuestos carbonílicos hacia la interacción con nucleófilos. Lo hacen uniéndose a los pares solitarios en el oxígeno carbonilo, alejando la densidad electrónica del oxígeno y, inductivamente, lejos de la porción vecina de la molécula.
Si los reactivos son polares, pueden no ser muy simétricos. Puede haber un grupo polar unido a un doble enlace, haciendo que el doble enlace se vuelva más reactivo pero también haciendo que la molécula sea más complicada.
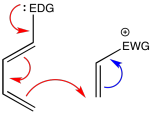
En consecuencia, la regioquímica importa. Si cada componente, el dieno y el dienófilo, tienen dos extremos muy distintivos, entonces importa qué extremo se conecta a cuál, porque potencialmente podríamos tener dos productos diferentes con propiedades completamente diferentes.
Generalmente, una comprensión de las estructuras de resonancia puede ayudarnos a predecir cómo dos compuestos se van a combinar en una reacción de Diels Alder.
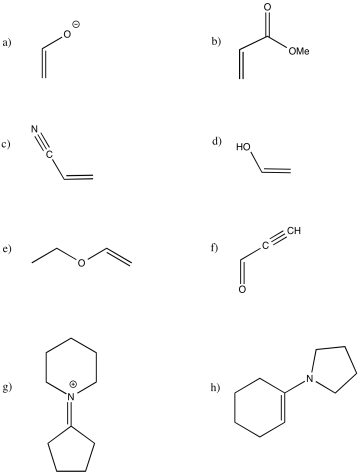
Identificar cada uno de los siguientes compuestos como electrófilos o nucleófilos al carbono. En cada caso, incluya una estructura de resonancia adicional para justificar su elección.
- Contestar
-

Si un dieno y un dienófilo van a reaccionar juntos, su interacción puede potenciarse si uno de los reactivos es un electrófilo y uno es un nucleófilo. Típicamente, en estos casos el dieno está diseñado para actuar como nucleófilo y el dienófilo se elige para actuar como electrófilo. No obstante, no hay ninguna razón particular por la que tenga que ser así, aparte de la idea de que los dos dobles enlaces del dieno ya parecen ser más ricos en electrones que el doble enlace sencillo del dienófilo, y así parece que solo necesitamos darles un pequeño empujón en esa dirección.
En general, se instala un grupo aceptor de electrones en el dienófilo. Recuerde, un grupo aceptor de electrones normalmente contiene un enlace múltiple a un átomo electronegativo. Si piensas en sustituciones aromáticas electrofílicas, estos fueron los grupos que típicamente actuaron como grupos desactivadores y meta-directores en esa situación. Carbonilos, nitrilos y grupos nitro son ejemplos de grupos aceptores de electrones.
De manera complementaria, se instala un grupo donador de electrones sobre el dieno. Recuerde, los donadores π son buenos ejemplos de grupos donadores de electrones. En las sustituciones aromáticas electrofílicas, los grupos donadores de electrones actuaban típicamente como directores orto-para, y generalmente eran grupos activadores en esa situación. Los grupos alcóxilo y las aminas son buenos ejemplos.
Ilustrar esta interacción electrófilo/nucleófilo usando el dieno, CH 3 OCH=CHCH=CH 2 y el dienófilo, CH 2 =CHNO 2.
- Contestar
-

Una interacción similar es posible usando un isómero del dieno en la pregunta anterior, CH 2 =C (OCH 3) CH=CH 2. Ilustrar la interacción electrófilo/nucleófilo entre este dieno y el dienófilo, CH 2 =CHNO 2.
- Contestar
-

Proporcionar los productos de las reacciones de Diels Alder entre los reactivos a continuación.
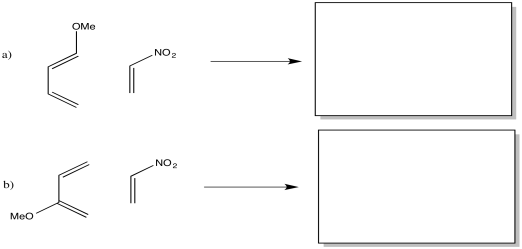
- Contestar
-

Quizás el dieno polar más utilizado es el dieno de Danishefsky, desarrollado en el laboratorio de Samuel Danishefsky de la Universidad de Columbia y el Memorial Sloan-Kettering Cancer Center. La Universidad de Columbia es líder mundial en investigación en el campo de la química orgánica. El laboratorio de Danishefsky se especializa en la síntesis de moléculas complejas que pueden ser de interés medicinal.
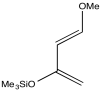
El dieno de Danishefsky, y otros similares, permiten una regioquímica controlada en las reacciones de Diels Alder porque la donación de π de los grupos alcoxi y siloxi empujan la densidad de electrones hacia la misma ubicación en el dieno. Entonces es capaz de reaccionar más fácilmente con un dienófilo. Si el dienófilo es asimétrico, lo que en este caso significa que un extremo es más positivo que el otro, entonces la reacción ocurre de manera predecible.
Proporcionar un mecanismo para la formación del dieno de Danishefsky bajo las siguientes condiciones.

- Contestar
-

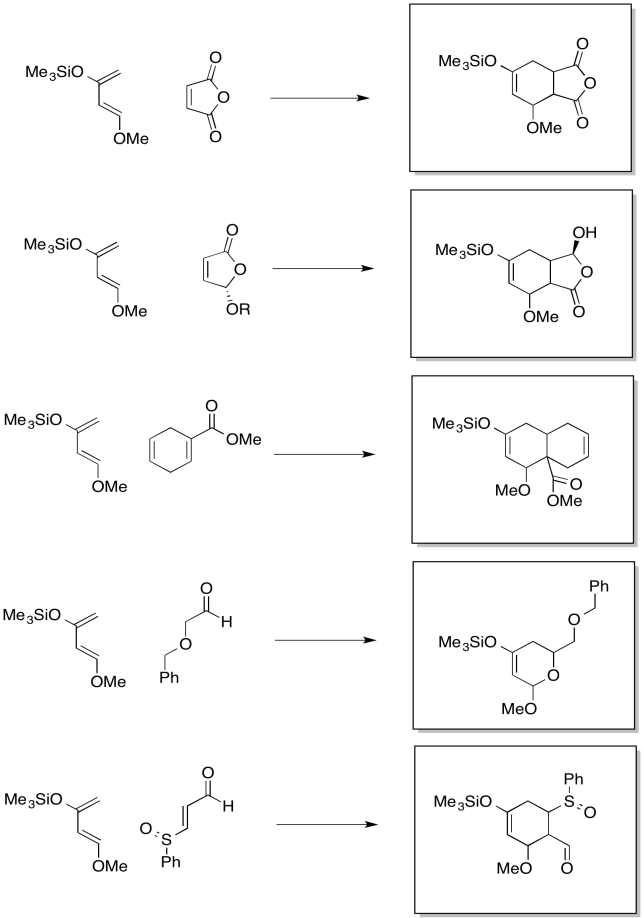
Mostrar los productos de las siguientes reacciones, incluyendo regioquímica preferida.
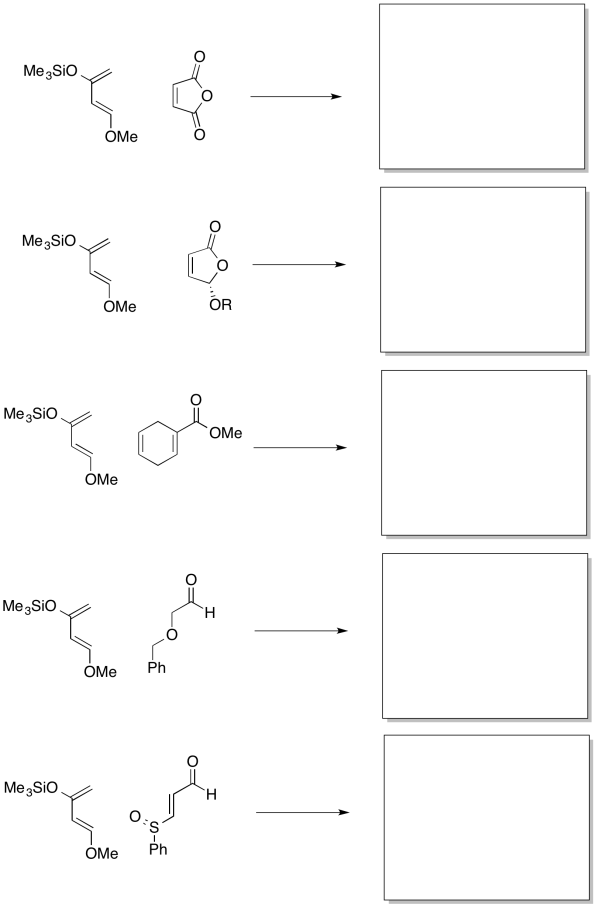
- Contestar
-
Una de las razones por las que Danishefsky es útil es que el silil éter se puede convertir fácilmente en una cetona. Proporcionar mecanismos para la siguiente secuencia.
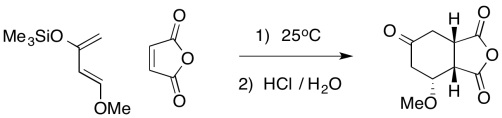
- Contestar
-

En ocasiones, la reacción de Diels Alder puede funcionar igualmente bien con compuestos distintos a los alquenos. Por supuesto, trabajan con alquinos en lugar de alquenos en el dienófilo; la única diferencia en ese caso es que queda un doble enlace extra en el producto. En ocasiones, los alquinos pueden reaccionar en presencia de alquenos, probablemente porque el alquino tiene menos impedimento estérico.
Los carbonilos y las iminas también tienen dobles enlaces. Como tal, también pueden reaccionar a veces. Debido a que son electrofílicos por naturaleza, reaccionarán mejor con una pareja más nucleofílica. También pueden necesitar ser activados.
Mostrar el producto de la siguiente reacción.

- Contestar
-

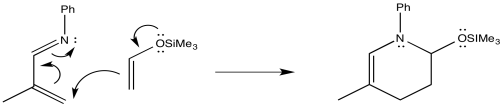
Tenga en cuenta que, hasta el momento, hemos analizado las reacciones de Diels Alder asistidas por polaridad en las que el dieno toma el papel de nucleófilo (para empezar es más rico en electrones) y el dienófilo toma el papel de eletrófilo. No tiene que ser así. Al colocar un grupo aceptor de electrones en el dieno y un grupo donador de electrones en el dienófilo, aún obtendríamos reactividad complementaria. Este tipo de enfoque se denomina reacción de “demanda inversa de electrones” de DIELs Alder, porque es lo opuesto al método habitual.
Mostrar un mecanismo con flechas curvas para hacer una predicción sobre regioquímica en la siguiente reacción.
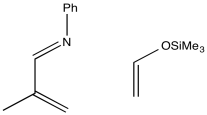
- Contestar
-
Mostrar los productos de las siguientes reacciones, incluyendo regioquímica preferida.
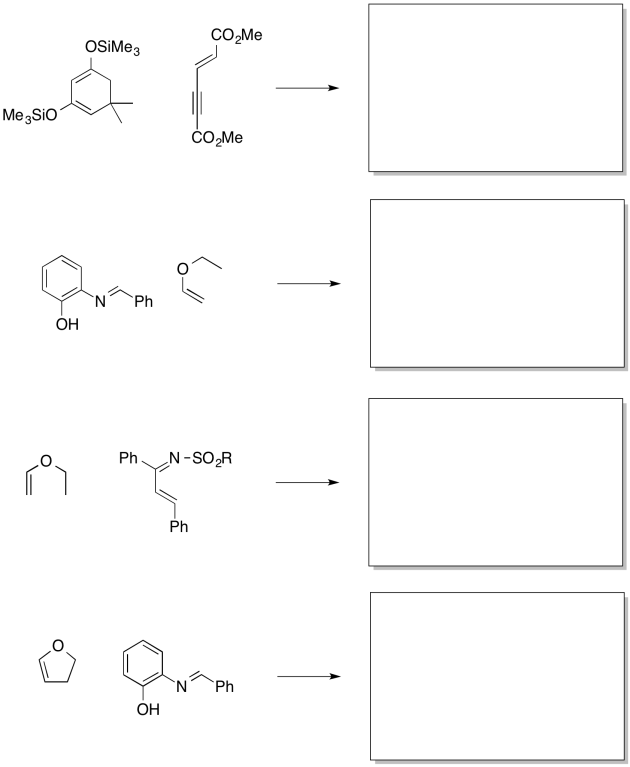
- Contestar
-

Mostrar por qué el dienófilo, 1,2-dimetoxibuta-1,3-dieno, tendría menos éxito como nucleófilo regioselectivo.
- Contestar
-
Los dibujos indican que los dos grupos donadores de electrones están operando con propósitos cruzados. Uno dirige la densidad de electrones hacia un extremo del dieno, mientras que el otro dirige la desnidad electrónica hacia el otro extremo.


