1.1: Introducción a la Química
- Page ID
- 70701
- Distinguir entre química y física;
- Sugerir formas en que los campos de la ingeniería, la economía y la geología se relacionan con la Química;
- Definir los siguientes términos, y clasificarlos como conceptos principalmente microscópicos o macroscópicos: elemento, átomo, compuesto, molécula, fórmula, estructura.
- Los dos conceptos subyacentes que rigen el cambio químico son la energética y la dinámica. ¿Qué aspectos del cambio químico describe cada una de estas áreas?
La química es un tema muy universal y dinámico que se limita a una definición fija; podría ser mejor pensar en la química más como un punto de vista que pone su foco principal en la estructura y propiedades de sustancias, tipos particulares de materia, y especialmente en los cambios a los que se someten.
La verdadera importancia de la Química es que sirve de interfaz a prácticamente todas las demás ciencias, así como a muchas otras áreas del esfuerzo humano. Por esta razón, a menudo se dice Química (¡al menos por los químicos!) para ser la “ciencia central”. La química puede ser “central” de una manera mucho más personal: con una sólida formación en Química, te resultará mucho más fácil migrar a otros campos a medida que tus intereses se desarrollen.
¿Investigación o docencia no para ti? La química está tan profundamente arraigada en tantas áreas de negocios, gobierno y gestión ambiental que algunos antecedentes en el tema pueden ser útiles (y capaces de darle una ventaja profesional como miembro del equipo que tiene habilidades especiales) en campos tan variados como el desarrollo de productos, marketing, administración, computación ciencia, redacción técnica e incluso derecho.
Entonces, ¿qué es la química?
¿Recuerdas la historia del grupo de ciegos que se encontraron con un elefante? Cada uno movió sus manos sobre una parte diferente del cuerpo del elefante —el tronco, una oreja o una pierna— y se le ocurrió una descripción completamente diferente de la bestia. De manera similar, la química puede abordarse de diferentes maneras, cada una dando una visión diferente, válida y sin embargo irremediablemente incompleta del tema. Así podemos ver la química desde múltiples puntos de vista que van desde lo teórico hasta lo eminentemente práctico:
| Principalmente teórica | Principalmente práctico |
|---|---|
| ¿Por qué las combinaciones particulares de átomos se mantienen unidas, pero no otras? | ¿Cuáles son las propiedades de un determinado compuesto? |
| ¿Cómo puedo predecir la forma de una molécula? | ¿Cómo puedo preparar un determinado compuesto? |
| ¿Por qué algunas reacciones son lentas, mientras que otras ocurren rápidamente? | ¿Una cierta reacción procede a su finalización? |
| ¿Es posible una cierta reacción? | ¿Cómo puedo determinar la composición de una sustancia desconocida? |
Hervirlo a lo básico
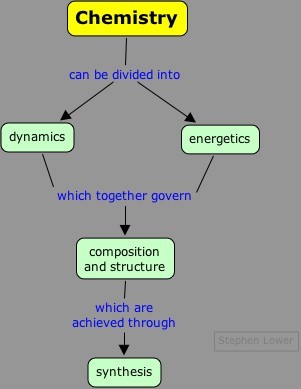
En el nivel más fundamental, la química puede organizarse siguiendo las líneas que aquí se muestran.
- La dinámica se refiere a los detalles de esos reordenamientos de átomos que ocurren durante el cambio químico, y que afectan fuertemente la velocidad a la que se produce el cambio.
- Energética se refiere a la termodinámica del cambio químico, relacionada con la captación o liberación de calor. Este aspecto de la química controla la dirección en la que se produce el cambio, y la mezcla de sustancias que se producen como resultado.
- La composición y estructura definen las sustancias que se producen debido a un cambio químico. La estructura se refiere específicamente a las disposiciones relativas de los átomos en el espacio. La medida en que una estructura dada puede persistir está determinada por la energía y la dinámica.
- La síntesis se refiere a la formación de sustancias nuevas (y generalmente más complejas) a partir de sustancias más simples, pero en el presente contexto la usamos en el sentido más general para denotar las operaciones requeridas para provocar el cambio químico y aislar los productos deseados.
Esta visión de la Química es bastante rigurosa que probablemente sea más apreciada por las personas que ya conocen el tema que por quienes están a punto de aprenderlo, por lo que utilizaremos un esquema algo ampliado para organizar los conceptos fundamentales de la ciencia química. Pero si necesitas una “definición” de Química de una sola oración, esta la envuelve bastante bien:
La química es el estudio de las sustancias; sus propiedades, estructura y los cambios que sufren.
Micro-macro: el bosque o los árboles
La química, como todas las ciencias naturales, comienza con la observación directa de la naturaleza —en este caso, de la materia—. Pero cuando miramos la materia a granel, solo vemos el “bosque”, no los “árboles” —los átomos y moléculas de los que está compuesta la materia— cuyas propiedades determinan en última instancia la naturaleza y el comportamiento de la materia que estamos viendo. Esta dicotomía entre lo que podemos y no podemos ver directamente constituye dos visiones contrastantes que recorren toda la química, a la que llamamos macroscópica y microscópica.
En el contexto de la Química, “microscópico” implica los niveles atómicos o subatómicos que no se pueden ver directamente (¡ni siquiera con un microscopio!) mientras que “macroscópico” implica cosas que podemos conocer por observaciones directas de propiedades físicas como masa, volumen, etc. La siguiente tabla proporciona una visión conceptual de la ciencia química de acuerdo con la dicotomía macroscópica/microscópica que hemos discutido anteriormente. Por supuesto, es solo una de las muchas formas de ver el tema, pero puede resultarle útil para organizar los muchos hechos e ideas que encontrará en su estudio de Química. Organizaremos la discusión en esta lección siguiendo líneas similares.
|
reino |
vista macroscópica |
vista microscópica |
|---|---|---|
| composición | fórmulas, mezclas | estructuras de sólidos, moléculas y átomos |
| propiedades | propiedades intensivas de la materia a granel | tamaños de partículas, masas e interacciones |
| cambio (energética) | Energética y Equilibrio | estadísticas de distribución de energía |
| cambio (dinámica) | cinética (tasas de reacciones) | mecanismos |
Composición química
¿Mezcla o “sustancia pura”?
En la ciencia es necesario saber de qué estamos hablando, así que antes de que podamos comenzar a considerar la materia desde un punto de vista químico, necesitamos conocer su composición; ¿si es una sola sustancia, o una mezcla? (Entraremos en los detalles de las definiciones más adelante, pero por el momento probablemente tenga una comprensión justa de la distinción; piense en una muestra de sal (cloruro de sodio) en lugar de una solución de sal en agua, una mezcla de sal y agua).
Elementos y compuestos
Se sabe desde hace al menos mil años que algunas sustancias pueden descomponerse por calentamiento o tratamiento químico en otras “más simples”, pero siempre hay un límite; eventualmente obtenemos sustancias conocidas como elementos que no pueden reducirse a formas más simples por medios químicos o físicos ordinarios . ¿Cuál es nuestro criterio para “más simple”? La propiedad más observable (y por lo tanto macroscópica) es el peso.
La idea de una unidad mínima de identidad química que llamamos un elemento desarrollado a partir de observaciones experimentales de los pesos relativos de sustancias involucradas en reacciones químicas. Por ejemplo, el compuesto óxido mercúrico se puede descomponer calentando en otras dos sustancias:
\[\ce{2 HgO \rightarrow 2 Hg + O_2}\]
... pero los dos productos, mercurio metálico y dioxígeno, no pueden descomponerse en sustancias más simples, por lo que deben ser elementos.
Elementos y átomos
La definición de un elemento dada anteriormente es operacional; un determinado resultado (¡o en este caso, un no resultado!) de un procedimiento que pudiera conducir a la descomposición de una sustancia en unidades más ligeras colocará tentativamente esa sustancia en una de las categorías: elemento o compuesto. Debido a que esta operación se realiza sobre materia a granel, el concepto del elemento también es macroscópico. El átomo, por el contrario, es un concepto microscópico que en la química moderna relaciona el carácter único de cada elemento químico con una partícula física real.
La idea del átomo como la partícula más pequeña de la materia tuvo su origen en la filosofía griega alrededor del 400 a. C. pero fue polémica desde el inicio (tanto Platón como Aristóteles sostuvieron que la materia era infinitamente divisible). No fue hasta 1803 que John Dalton propuso una teoría atómica racional para explicar los hechos de la combinación química como entonces se los conocía, siendo así el primero en emplear evidencia macroscópica para iluminar el mundo microscópico. No fue hasta la década de 1900 cuando la teoría atómica llegó a ser universalmente aceptada. En la década de 1920 se hizo posible medir los tamaños y masas de los átomos, y en la década de 1970 se desarrollaron técnicas que producían imágenes de átomos individuales.

Fórmula y estructura
La fórmula de una sustancia expresa el número relativo de átomos de cada elemento que contiene. Debido a que la fórmula puede ser determinada por experimentos sobre materia a granel, es un concepto macroscópico a pesar de que se expresa en términos de átomos.
Lo que la fórmula química ordinaria no nos dice es el orden en que se conectan los átomos componentes, ya sea que estén agrupados en unidades discretas (moléculas) o sean estructuras extendidas bidimensionales o tridimensionales, como es el caso de sólidos como la sal ordinaria. El aspecto microscópico de la composición es la estructura, que da localizaciones relativas detalladas (en espacios bidimensionales o tridimensionales) de cada átomo dentro de la colección mínima necesaria para definir la estructura de la sustancia.
|
Macroscópica |
Microscópicos |
|
|---|---|---|
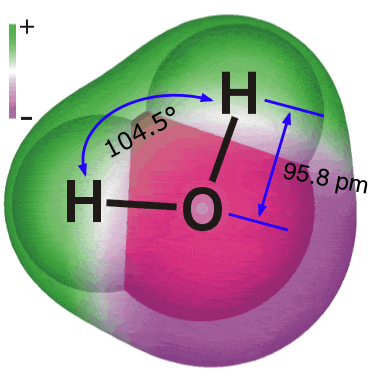
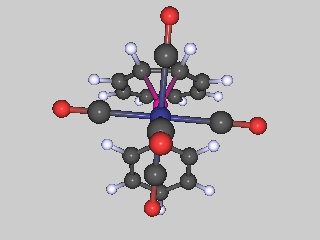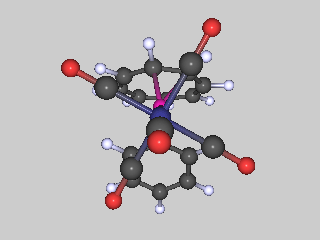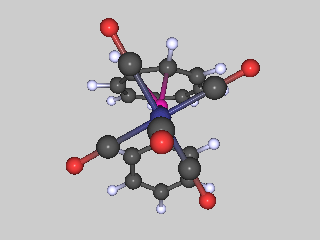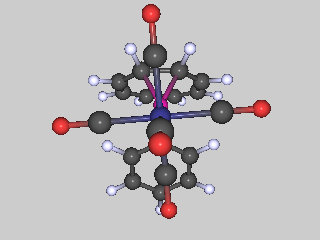
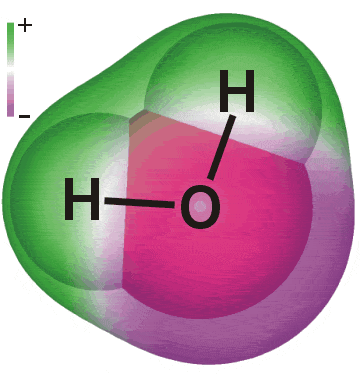
| Las sustancias se definen a nivel macroscópico por sus fórmulas o composiciones, y a nivel microscópico por sus estructuras. | Los elementos hidrógeno y oxígeno se combinan para formar un compuesto cuya composición se expresa por la fórmula H 2 O. |
La molécula de agua tiene la estructura que se muestra aquí. |
| Las sustancias químicas que no se pueden descomponer en otras más simples se conocen como elementos. Las partículas físicas reales de las que están compuestos los elementos son átomos o moléculas. |
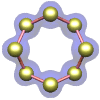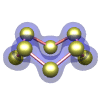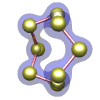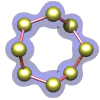
Azufre — el elemento en su forma cristalina ortorrómbica.
|
molécula es un anillo octogonal de átomos de azufre. El cristal que se muestra a la izquierda está compuesto por una matriz ordenada de estas moléculas.
(No, en realidad no se mueven así, aunque están en un estado constante de movimiento vibratorio).
|
Compuestos y moléculas
Como señalamos anteriormente, un compuesto es una sustancia que contiene más de un elemento. Dado que el concepto de un elemento es macroscópico y la distinción entre elementos y compuestos fue reconocida mucho antes de que se aceptara la existencia de átomos físicos, el concepto de compuesto también debe ser uno macroscópico que no haga suposiciones sobre la naturaleza de lo último. Así, cuando el carbono se quema en presencia de oxígeno, el producto dióxido de carbono puede mostrarse mediante mediciones de peso (macroscópicas) para contener ambos elementos originales:
\[\ce{C + O2 -> CO2}\]
10.0 g + 26.7 g = 36.7 g
Una de las características importantes de un compuesto es que las proporciones en peso de cada elemento en un compuesto dado son constantes. Por ejemplo, no importa qué peso de dióxido de carbono tengamos, el porcentaje de carbono que contiene es (10.0/36.7) = 0.27, o 27%.
Moléculas
Una molécula es un conjunto de átomos que tienen una composición fija, estructura y propiedades distintivas y medibles.
“Molécula” se refiere a una especie de partícula, y por lo tanto es un concepto microscópico. Incluso a finales del siglo XIX, cuando los compuestos y sus fórmulas habían estado en uso durante mucho tiempo, algunos químicos destacados dudaban de que las moléculas (o átomos) fueran más que un modelo conveniente.
Las moléculas de repente se hicieron realidad en 1905, cuando Albert Einstein demostró que el movimiento browniano, los movimientos microscópicos irregulares de pequeños granos de polen que flotan en el agua, podrían atribuirse directamente a colisiones con partículas del tamaño de una molécula.
Por último, ¡llegamos a ver uno!
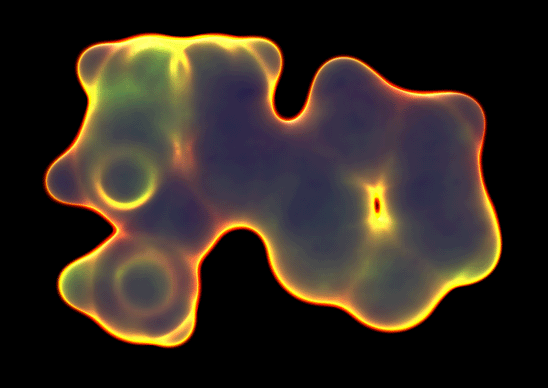
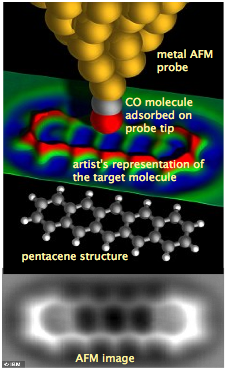
En 2009, científicos de IBM en Suiza lograron obtener imágenes de una molécula real, utilizando una técnica conocida como microscopía de fuerza atómica en la que una sonda metálica delgada de átomos se dibuja ligeramente por encima de la superficie de una molécula de pentaceno inmovilizada enfriada a casi cero absoluto. Para mejorar la calidad de la imagen, se colocó una molécula de monóxido de carbono en el extremo de la sonda.
La imagen producida por la sonda AFM se muestra en la parte inferior. Lo que realmente se está imaginando es la superficie de las nubes de electrones de la molécula, que consiste en seis anillos hexagonales de átomos de carbono con hidrógeno en su periferia. Las pequeñas protuberancias que corresponden a estos átomos de hidrógeno dan fe de la notable resolución de este experimento.
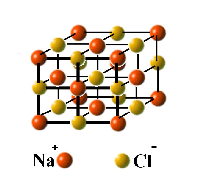
La composición atómica de una molécula viene dada por su fórmula. Así, las fórmulas CO, CH 4 y O 2 representan las moléculas monóxido de carbono, metano y dioxígeno. Sin embargo, el hecho de que podamos escribir una fórmula para un compuesto no implica la existencia de moléculas que tengan esa composición. Los gases y la mayoría de los líquidos consisten en moléculas, pero muchos sólidos existen como redes extendidas de átomos o iones (átomos o moléculas cargadas eléctricamente). Por ejemplo, no existe tal cosa como una “molécula” de sal ordinaria, NaCl (ver abajo.)
¿Confundido acerca de la distinción entre moléculas y compuestos?
Tal vez lo siguiente ayude:
 |
  |
 |
| Una molécula pero no un compuesto - El ozono, O 3, no es un compuesto porque contiene sólo un solo elemento. | Esta conocida molécula es un compuesto porque contiene más de un elemento. | La sal sólida ordinaria es un compuesto pero no una molécula. Se construye a partir de redes interpenetrantes de iones de sodio y cloruro que se extienden indefinidamente. |
Estructura y propiedades
La composición y la estructura se encuentran en el núcleo de la Química, pero abarcan sólo una parte muy pequeña de la misma. Son en gran parte las propiedades de las sustancias químicas las que nos interesan; es a través de estas que experimentamos y encontramos usos para las sustancias, y gran parte de la química como ciencia se dedica a comprender la relación entre estructura y propiedades. Para algunos propósitos es conveniente distinguir entre propiedades químicas y propiedades físicas, pero como ocurre con la mayoría de las dicotomías construidas por humanos, la distinción se vuelve más borrosa a medida que se mira más de cerca.
Cambio químico
El cambio químico se define macroscópicamente como un proceso en el que se forman nuevas sustancias. Sobre una base microscópica se puede considerar como un reordenamiento de átomos. Un cambio químico dado se conoce comúnmente como una reacción química y se describe mediante una ecuación química que tiene la forma
reactantes → productos
En los cursos elementales se acostumbra distinguir entre cambio “químico” y “físico”, este último generalmente relacionado con cambios en el estado físico como fusión y vaporización. Como ocurre con la mayoría de las dicotomías creadas por el ser humano, ésta comienza a romperse cuando se examina de cerca Esto se debe en gran parte a cierta ambigüedad en lo que consideramos como una “sustancia” distinta.
El cloro elemental existe como molécula diatómica\(\ce{Cl2}\) en los estados gas, líquido y sólido; la mayor diferencia entre ellos radica en el grado de organización. En el gas las moléculas se mueven aleatoriamente, mientras que en el sólido están restringidas a ubicaciones en una red tridimensional. En el líquido, esta organización apretada se relaja, permitiendo que las moléculas se deslicen y se deslicen una alrededor de la otra.
Dado que las unidades moleculares básicas siguen siendo las mismas en los tres estados, los procesos de fusión, congelación, condensación y vaporización suelen considerarse como cambios físicos más que químicos.
La sal sólida consiste en una matriz tridimensional extendida indefinidamente de iones Na + y Cl — (átomos cargados eléctricamente).
Cuando se calienta por encima de 801°C, el sólido se funde para formar un líquido que consiste en estos mismos iones. Este líquido hierve a 1430° para formar un vapor compuesto por moléculas discretas que tienen la fórmula\(\ce{Na2Cl2 (aq)}\).. Debido a que los iones en el sólido, los iones hidratados en la solución y la molécula\(\ce{Na2Cl2}\) son especies químicas realmente diferentes, por lo que la distinción entre cambio físico y químico se vuelve un poco borrosa.
Energética y Equilibrio
Probablemente hayas visto ecuaciones de reacción química como la “genérica” que se muestra a continuación:
\[\ce{A + B → C + D}\]
Una ecuación de este tipo no implica que los reactivos A y B cambien por completo en los productos C y D, aunque en muchos casos esto será lo que parece suceder. La mayoría de las reacciones químicas proceden a algún punto intermedio que produce una mezcla de reactivos y productos.
Por ejemplo, si los dos gases tricloruro de fósforo y cloro se mezclan a temperatura ambiente, se combinarán hasta que aproximadamente la mitad de ellos hayan cambiado a pentacloruro de fósforo:
\[\ce{PCl_3 + Cl_2 \rightarrow PCl_5}\]
A otras temperaturas el grado de reacción será menor o mayor. El resultado, en cualquier caso, será una mezcla de equilibrio de reactivos y productos.
La pregunta más importante que podemos hacer sobre cualquier reacción es “¿cuál es la composición de equilibrio”?
- Si la respuesta es “todos los productos y cantidades insignificantes de reactivos”, entonces decimos que la reacción puede tiene lugar y que “va a su finalización”.
- Si la respuesta es “cantidades insignificantes de productos”, entonces decimos que la reacción no puede tener lugar en la dirección hacia adelante, sino que puede ocurrir la reacción inversa.
- Si la respuesta es que “cantidades significativas de todos los componentes” (tanto reactivos como productos) están presentes en la mezcla de equilibrio, entonces decimos que la reacción es “reversible” o “incompleta”.
El aspecto del “cambio” que estamos viendo aquí es una propiedad de una reacción química, más que de una sola sustancia. Pero si te paras a pensar en la enorme cantidad de posibles reacciones entre los más de 15 millones de sustancias conocidas, puedes ver que sería una tarea imposible medir y registrar las composiciones de equilibrio de cada combinación posible.
Se pueden combinar una o dos propiedades directamente medibles de los reactivos y productos individuales para dar un número a partir del cual se puede calcular fácilmente la composición de equilibrio a cualquier temperatura. ¡No hay necesidad de hacer un experimento!
Esto es en gran medida una visión macroscópica porque las propiedades que necesitamos preocuparnos directamente son las de los reactivos y productos. De igual manera, la composición de equilibrio —la medida del grado en que tiene lugar una reacción— se expresa en términos de las cantidades de estas sustancias.
Energética Química
Prácticamente todos los cambios químicos implican la absorción o liberación de energía, generalmente en forma de calor. Resulta que estos cambios energéticos, que son la provincia de la termodinámica química, sirven como un poderoso medio para predecir si una reacción dada puede proceder o no, y en qué medida. Además, todo lo que necesitamos para hacer esta predicción es información sobre las propiedades energéticas de los reactivos y productos; no hay necesidad de estudiar la reacción en sí. Debido a que estas son propiedades masivas de la materia, la termodinámica química es completamente macroscópica en su perspectiva.
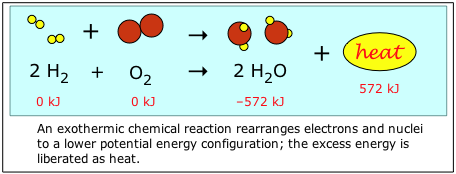
Dinámica: Cinética y Mecanismo
La energética del cambio químico que discutimos inmediatamente antes se relaciona con el resultado final del cambio químico: la composición de la mezcla de reacción final, y la cantidad de calor liberado o absorbido. La dinámica del cambio químico se refiere a cómo se produce la reacción:
- Qué tiene que pasar para que comience la reacción (¿qué molécula se golpea primero, qué tan fuerte y desde qué dirección?)
- ¿La reacción tiene lugar en un solo paso, o están involucrados múltiples pasos y estructuras intermedias?
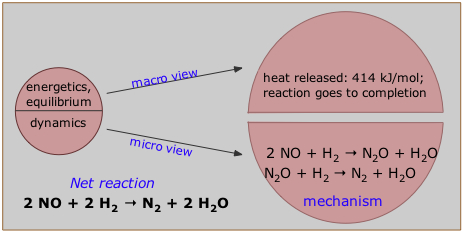
Estos detalles constituyen lo que los químicos llaman el mecanismo de la reacción. Por ejemplo, se cree que la reacción entre el óxido nítrico y el hidrógeno (identificada como la reacción neta en la parte inferior izquierda), tiene lugar en los dos pasos que se muestran aquí. Observe que el óxido nitroso, N 2 O, se forma en el primer paso y se consume en el segundo, por lo que no aparece en la ecuación neta de reacción. Se dice que el N 2 O actúa como intermedio en esta reacción. Algunos intermedios son especies inestables, a menudo moléculas distorsionadas o incompletas que no tienen existencia independiente; estas se conocen como estados de transición.
El lado microscópico de la dinámica analiza los mecanismos de las reacciones químicas. Esto se refiere a una descripción “soplada a golpe” de lo que sucede cuando los átomos en las especies reaccionantes se reorganizan en las configuraciones que tienen en los productos.
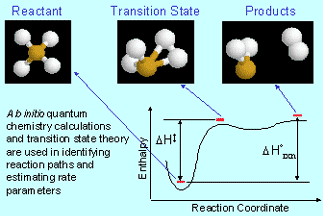
El mecanismo representa el aspecto microscópico del cambio químico. Los mecanismos, a diferencia de la energética, no pueden predecirse a partir de información sobre los reactivos y productos; la teoría química aún no ha avanzado hasta el punto en que podamos hacer mucho más que hacer conjeturas educadas. Para complicar aún más las cosas (¡o, a los químicos, interesantes! ), la misma reacción a menudo puede proceder a través de diferentes mecanismos bajo diferentes condiciones.
Cinética
Debido a que no podemos observar directamente a las moléculas a medida que reaccionan, lo mejor que podemos hacer es inferir un mecanismo de reacción a partir de datos experimentales, particularmente el que se relaciona con la velocidad de la reacción ya que está influenciada por las concentraciones de los reactivos. Esta área completamente experimental de dinámica química se conoce como cinética.
Las velocidades de reacción, como se les llama, varían inmensamente: algunas reacciones se completan en microsegundos, otras pueden llevar años; muchas son tan lentas que sus tasas son esencialmente cero. Para hacer las cosas aún más interesantes, no existe relación entre las velocidades de reacción y la “tendencia a reaccionar” como se rige por los factores en la mitad superior del diagrama anterior; esta última puede predecirse con precisión a partir de datos energéticos sobre las sustancias (las propiedades que mencionamos en la pantalla anterior), sino reacción las tasas deben ser determinadas por experimento.
Catalizadores
Los catalizadores pueden hacer cambios dramáticos en las velocidades de las reacciones, especialmente en aquellas cuya velocidad no catalizada es esencialmente cero. Consideremos, por ejemplo, estos datos de velocidad sobre la descomposición del peróxido de hidrógeno. H 2 O 2 es un subproducto de la respiración que es venenoso para las células vivas que, como consecuencia, han desarrollado una enzima altamente eficiente (un catalizador biológico) que es capaz de destruir el peróxido tan rápido como se forma. Los catalizadores funcionan permitiendo que una reacción proceda por un mecanismo alternativo.

En algunas reacciones, incluso la luz puede actuar como catalizador. Por ejemplo, los elementos gaseosos hidrógeno y cloro pueden permanecer mezclados en la oscuridad indefinidamente sin ningún signo de reacción, pero a la luz del sol se combinan explosivamente.
Corrientes de la Química Moderna
En la sección anterior analizamos la química desde un punto de vista conceptual. Si esto puede considerarse una visión “macroscópica” de la química, ¿cuál es la visión “microscópica”? Probablemente sería lo que realmente hacen los químicos. Debido a que una exploración a fondo de esto nos llevaría a muchos más detalles de los que podemos acomodar aquí, mencionaremos solo algunas de las áreas que han surgido como especialmente importantes en la química moderna.
Ciencia de la separación
Sorprendentemente, gran parte de la química tiene que ver con aislar un componente de una mezcla. Esto puede ocurrir en cualquier número de etapas de un proceso de fabricación, incluyendo los pasos muy críticos involucrados en la eliminación de subproductos tóxicos, odiferos o indeseables de otra manera de una corriente de desechos. Pero incluso en el laboratorio de investigación, a menudo se dedica una cantidad considerable de esfuerzo a separar la sustancia deseada de los muchos componentes de una mezcla de reacción, o en separar un componente de una mezcla compleja (por ejemplo, un metabolito de un fármaco de una muestra de orina), antes de medir la cantidad presente.
|
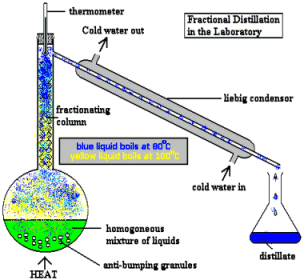
Destilación - separación de líquidos que tienen diferentes puntos de ebullición. Esta antigua técnica (que se cree que se originó con los alquimistas árabes en 3500 a. C.), sigue siendo una de las operaciones más empleadas tanto en el laboratorio como en procesos industriales como la refinación de petróleo. |
 |
|
Extracción con disolventes - separación de sustancias en función de sus diferentes solubilidades. Una herramienta común de laboratorio para aislar sustancias de plantas y mezclas de reacción química. Los usos prácticos incluyen el procesamiento de desechos radiactivos y la descafeinación de granos de café. El embudo separador que se muestra aquí es el aparato más simple para la extracción líquido-líquido; para la extracción sólido-líquido, se usa comúnmente el aparato Soxhlet. |
 |
|
Cromatografía - Este método extremadamente versátil depende de la tendencia de diferentes tipos de moléculas a adsorberse (unirse) a diferentes superficies a medida que viajan a lo largo de una “columna” del material adsorbente. Así como el progreso de las personas que caminan por un centro comercial depende de cuánto tiempo pasen mirando por las ventanas que pasen, esas moléculas que se adsorben con mayor fuerza a un material emergerán de la columna de cromatografía más lentamente que las moléculas que no están tan fuertemente adsorbidas. |
 Cromatografía en papel de jugo vegetal [link] |
|
Electroforesis en gel - un método poderoso para separar y “huella digital” macromoléculas como ácidos nucleicos o proteínas sobre la base de propiedades físicas como el tamaño y la carga eléctrica. |
 |
Identificación y ensayo
¿Qué tienen en común las siguientes personas?
- Un gerente de planta decide si aceptar un vagón cisterna de cloruro de vinilo para su fabricación en tubería de plástico
- Un químico agrícola que quiere conocer el contenido vitamínico de un nuevo híbrido vegetal
- El gerente de una planta de tratamiento de agua de la ciudad que necesita asegurarse de que el contenido de carbonato del agua se mantenga lo suficientemente alto como para evitar la corrosión, pero lo suficientemente bajo para evitar la acumulación de incrustaciones
La respuesta es que todos dependen de técnicas analíticas —mediciones de la naturaleza o cantidad (“ensayos”) de alguna sustancia de interés, a veces a concentraciones muy bajas. Una gran cantidad de investigación se dedica a encontrar medios más precisos y convenientes para realizar tales mediciones. Muchos de estos involucran instrumentos sofisticados; entre los más utilizados se encuentran los siguientes:
|
Espectrofotómetros que examinan las formas en que la luz de varias longitudes de onda es absorbida, emitida o alterada por especies atómicas y moleculares. |
 |
|
Espectrómetros de masas que descomponen las moléculas en fragmentos que pueden caracterizarse por métodos eléctricos. |
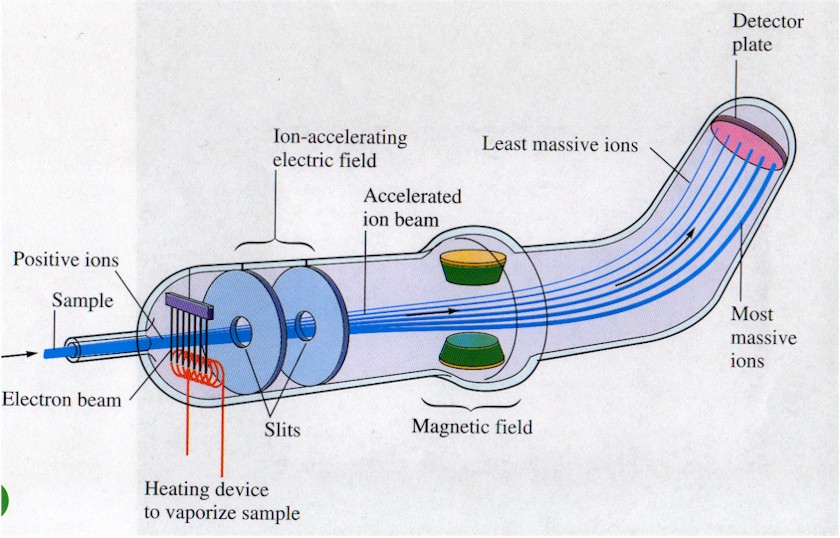 |
|
Instrumentos (espectrómetros de RMN) que analizan la acción de las ondas de radio y los campos magnéticos sobre los núcleos atómicos para examinar la naturaleza de los enlaces químicos unidos a un tipo particular de átomo. |
 |
|
“A principios de la década de 1900, un químico podía analizar alrededor de 200 muestras por año para los principales elementos formadores de rocas. Hoy en día, mediante espectrometría de fluorescencia de rayos X, dos químicos pueden realizar el mismo tipo de análisis en 7,000 muestras al año”. |

|
Materiales, polímeros y nanotecnología
La ciencia de los materiales intenta relacionar las propiedades físicas y el rendimiento de los materiales de ingeniería con su estructura química subyacente con el objetivo de desarrollar materiales mejorados para diversas aplicaciones.
|
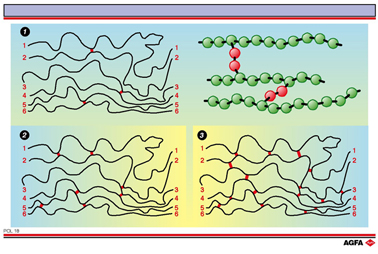
Química de polímeros - desarrollo de materiales poliméricos (“plásticos”) para usos industriales. Conectar moléculas de polímero individuales mediante reticulaciones (rojo) aumenta la resistencia del material. Así, el polietileno ordinario es un material bastante blando con un bajo punto de fusión, pero la forma reticulada es más rígida y resistente al calor. |
 |
|
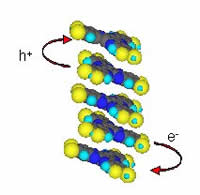
Los semiconductores orgánicos ofrecen una serie de ventajas potenciales sobre los dispositivos convencionales basados en metaloides. |
 |
|
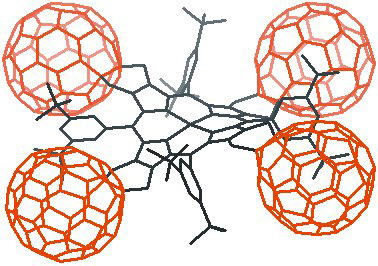
Fullerenos, nanotubos y nanocables - Los fullerenos se identificaron por primera vez en 1985 como productos de experimentos en los que el grafito se vaporizó usando un láser, trabajo para el cual R. F. Curl, Jr., R. E. Smally y H. W. Kroto compartieron el Premio Nobel de Química 1996. Se espera que la investigación del fullereno conduzca a nuevos materiales, lubricantes, recubrimientos, catalizadores, dispositivos electroópticos y aplicaciones médicas. |
 |
|
Química de nanodispositivos: construir ensamblajes a escala molecular para tareas específicas como computación, producción de movimientos, etc. |
|
|
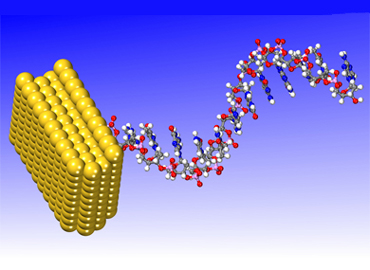
Biosensores y biochips: las superficies de metales y semiconductores “decoradas” con biopolímeros pueden servir como detectores extremadamente sensibles de sustancias biológicas y agentes infecciosos. |
 |
Bioquímica y Biología Molecular
Este campo abarca una amplia gama de estudios que van desde estudios fundamentales sobre la química de la expresión génica y las interacciones enzima-sustrato hasta el diseño de fármacos. Gran parte de la actividad en esta área está dirigida a esfuerzos en el descubrimiento de fármacos.
|
El cribado de medicamentos comenzó como un enfoque en gran medida disperso en el que un patógeno o una línea celular cancerosa se cribó contra cientos o miles de sustancias candidatas con la esperanza de encontrar algunas “pistas” que pudieran resultar en una terapia útil. Este campo es ahora altamente automatizado y generalmente involucra química combinatoria (ver más abajo) combinada con métodos innovadores de separación y ensayo. |
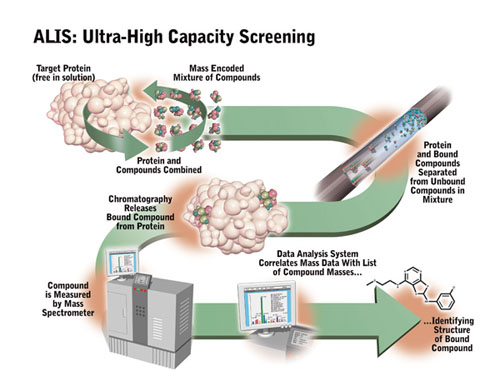 |
|
El diseño de fármacos analiza las interacciones entre enzimas y posibles inhibidores. El modelado por computadora es una herramienta esencial en este trabajo. |
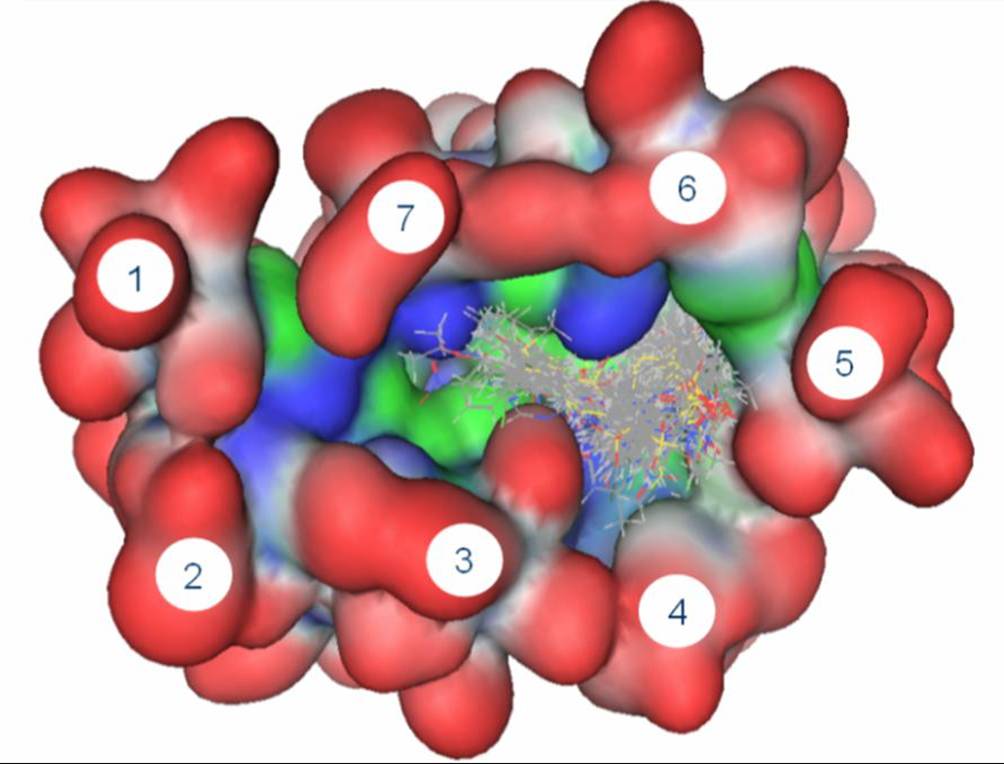 |
|
Proteómica - Este enorme campo se centra en las relaciones entre la estructura y función de las proteínas, de las cuales hay alrededor de 400,000 tipos diferentes en humanos. La proteómica está relacionada con la genética en que las secuencias de ADN en los genes se decodifican en proteínas que finalmente definen y regulan un organismo en particular. |
[Enlace a la imagen del artículo científico] |
|
La genómica química explora la cadena de eventos en los que las moléculas de señalización regulan la expresión génica. |
 |
Síntesis
En su sentido más general, esta palabra se refiere a cualquier reacción que conduzca a la formación de una molécula particular. Es a la vez una de las áreas más antiguas de la química y una de las más activamente perseguidas. Algunos de los principales hilos son
| Síntesis de nuevas moléculas - Los químicos siempre tienen el desafío de idear moléculas que contengan características novedosas como nuevas formas o tipos inusuales de enlaces. |
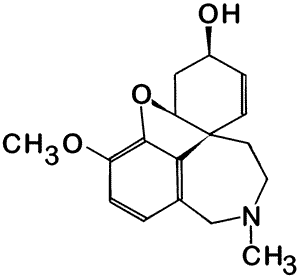 |
|
La química combinatoria se refiere a un grupo de técnicas ampliamente automatizadas para generar pequeñas cantidades de grandes cantidades de moléculas diferentes (“bibliotecas”) y luego seleccionar aquellas que tienen ciertas propiedades deseadas. Aunque es una técnica importante de descubrimiento de fármacos, también tiene muchas otras aplicaciones. |
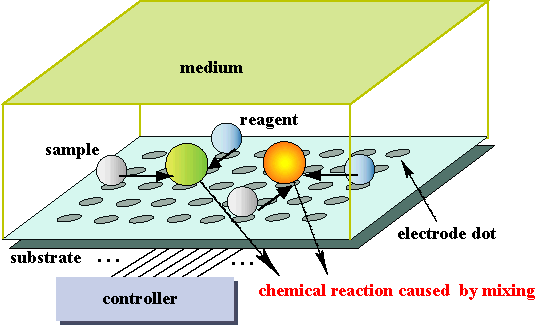 |
|
Química verde - métodos sintéticos que se enfocan en reducir o eliminar el uso o liberación de productos químicos o subproductos tóxicos o no biodegradables. |
 |
|
La química de procesos cierra la brecha entre la síntesis química y la ingeniería química al adaptar las rutas sintéticas a los métodos eficientes, seguros y ambientalmente responsables para la síntesis a gran escala. |
 |
¡Felicidades! Acabas de cubrir toda la Química, condensada en una lección rápida e indolora, ¡el curso de Química más corto del mundo! Sí, dejamos fuera muchos de los detalles, el más importante de los cuales te llevará unos meses de feliz descubrimiento para recoger. Pero si se tiene en cuenta la jerarquía global de composición/estructura, propiedades de sustancias, y cambio (equilibrio y dinámica) que hemos desarrollado tanto en la vista macroscópica como en la microscópica, le resultará mucho más fácil ensamblar los detalles a medida que los encuentre y ver dónde encajan en el imagen más grande.