2.1: Clasificación y Propiedades de la Materia
- Page ID
- 70788
- Dar ejemplos de propiedades extensas e intensivas de una muestra de materia. ¿Qué tipo de propiedad es más útil para describir un tipo particular de materia?
- Explicar qué distingue a la materia heterogénea de la materia homogénea.
- Describir los siguientes procesos de separación: destilación, cristalización, extracción líquido-líquido, cromatografía.
- En la medida algo limitada en que tenga sentido, clasificar una propiedad dada como una propiedad física o química de la materia.
La materia es “cualquier cosa que tenga masa y ocupe espacio”, nos enseñaron en la escuela. Bastante cierto, pero no muy satisfactorio. Desafortunadamente, una respuesta realmente completa está más allá del alcance de este curso, pero ofreceremos un indicio de ello en un capítulo posterior sobre la estructura atómica. Por el momento, pospongamos el intento de definir la materia y centrémonos en la visión del químico: la materia es de qué están compuestas las sustancias químicas. Pero, ¿a qué nos referimos con sustancias químicas? ¿Cómo organizamos nuestra visión de la materia y sus propiedades? Estas preguntas muy prácticas serán los temas de esta lección.
Propiedades de la Materia
La ciencia de la química se desarrolló a partir de observaciones hechas sobre la naturaleza y el comportamiento de diferentes tipos de materia, a las que nos referimos colectivamente como las propiedades de la materia. Las propiedades a las que nos referimos en esta lección son todas propiedades macroscópicas: las que se pueden observar en materia a granel. A nivel microscópico, la materia se caracteriza por su estructura: la disposición espacial de los átomos individuales en una unidad molecular o un sólido extendido. Al observar una muestra de materia y medir sus diversas propiedades, poco a poco adquirimos suficiente información para caracterizarla; para distinguirla de otros tipos de materia. Este es el primer paso en el desarrollo de la ciencia química, en la que el interés se centra en tipos específicos de materia y las transformaciones entre ellos.
Si piensas en las diversas propiedades observables de la materia, se hará evidente que éstas se dividen en dos clases. Algunas propiedades, como la masa y el volumen, dependen de la cantidad de materia en la muestra que estamos estudiando. Claramente, estas propiedades, por importantes que sean, no pueden por sí mismas ser utilizadas para caracterizar una especie de materia; decir que “el agua tiene una masa de 2 kg” es una tontería, aunque puede ser bastante cierto en una instancia particular. Las propiedades de este tipo se denominan propiedades extensas de la materia.
Supongamos que tomamos más medidas, y encontramos que la misma cantidad de agua cuya masa es de 2.0 kg también ocupa un volumen de 2.0 litros. Se han medido dos propiedades extensas (masa y volumen) de una misma muestra de materia. Esto nos permite definir una nueva cantidad, el cociente m/V que define otra propiedad del agua que llamamos densidad. A diferencia de la masa y el volumen, que por sí mismos se refieren únicamente a muestras individuales de agua, la densidad (masa por unidad de volumen) es una propiedad de todas las muestras de agua pura a la misma temperatura. La densidad es un ejemplo de una propiedad intensiva de la materia.
Esta definición de la densidad ilustra una regla general importante: la relación de dos propiedades extensas es siempre una propiedad intensiva.
Las propiedades intensivas son extremadamente importantes, porque cada tipo de materia posible posee un conjunto único de propiedades intensivas que la distingue de cualquier otro tipo de materia. Algunas propiedades intensivas se pueden determinar mediante simples observaciones: el color (espectro de absorción), el punto de fusión, la densidad, la solubilidad, la naturaleza ácida o alcalina y la densidad son ejemplos comunes. Aún más fundamental, pero menos directamente observable, es la composición química.
Cuantas más propiedades intensivas conozcamos, más precisamente podremos caracterizar una muestra de materia.
Las propiedades intensivas son extremadamente importantes, porque cada tipo de materia posible posee un conjunto único de propiedades intensivas que la distingue de cualquier otro tipo de materia. En otras palabras, las propiedades intensivas sirven para caracterizar la materia. Muchas de las propiedades intensivas dependen de variables como la temperatura y la presión, pero las formas en que estas propiedades cambian con tales variables pueden considerarse propiedades intensivas.
Clasificar cada una de las siguientes propiedades como una propiedad extensa o intensiva.
- El volumen de cerveza en una jarra
- El porcentaje de alcohol en la cerveza
- La cantidad de calorías de energía que se obtiene de comer un plátano
- El número de calorías de energía puestas a disposición de tu cuerpo cuando consumes 10.0 g de azúcar
- La masa de hierro presente en tu sangre
- La masa de hierro presente en 5 mL de tu sangre
- La resistencia eléctrica de un trozo de alambre de cobre calibre 22.
- La resistencia eléctrica de una longitud de 1 km de alambre de cobre calibre 22
- La presión del aire en una llanta de bicicleta
- Contestar a
-
extenso; depende del tamaño de la taza.
- Respuesta b
-
intensivo; lo mismo para cualquier muestra del mismo tamaño.
- Respuesta c
-
extenso; depende del tamaño y contenido de azúcar del plátano.
- Respuesta d
-
intensivo; lo mismo para cualquier porción de 10 g de azúcar.
- Respuesta e
-
extenso; depende del volumen de sangre en el cuerpo.
- Respuesta f
-
intensivo; lo mismo para cualquier muestra de 5 mL.
- Respuesta g
-
extenso; depende de la longitud del cable.
- Respuesta h
-
intensivo; lo mismo para cualquier longitud de 1 km del mismo cable.
- Contestar i
-
la presión en sí es intensiva, pero también depende de la cantidad de aire en el neumático.
El último ejemplo muestra que ¡no todo es blanco o negro! Pero a menudo encontramos materia que no es uniforme en todas partes, cuyas diferentes partes exhiben diferentes conjuntos de propiedades intensivas. Esto trae a colación otra distinción que abordamos inmediatamente a continuación.
¿Cómo clasificar la materia?
Una manera útil de organizar nuestra comprensión de la materia es pensar en una jerarquía que se extiende desde lo más general y complejo hasta lo más simple y fundamental. Las cajas de color naranja representan el reino central de la química, que trata en última instancia de sustancias químicas específicas, pero como cuestión práctica, la ciencia química se extiende tanto por encima como por debajo de esta región.
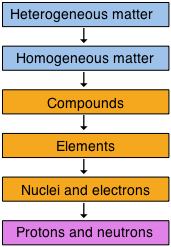
Alternativamente, cuando estamos pensando en muestras específicas de materia, puede ser más útil recrear nuestra clasificación en dos dimensiones:
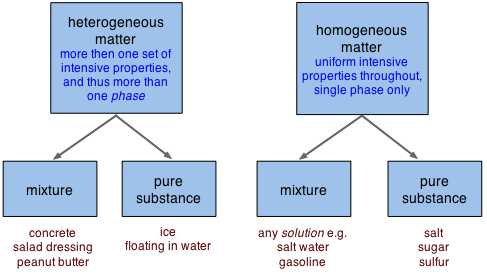
Observe, en la línea de fondo de los recuadros anteriores, que las “mezclas” y las “sustancias puras” pueden caer en las categorías homogéneas o heterogéneas.
Homogéneo y heterogéneo: es cuestión de fases
La materia homogénea (del griego homo = misma) puede considerarse uniforme y continua, mientras que la materia heterogénea (hetero = diferente) implica no uniformidad y discontinuidad. Para llevar esto más lejos, primero necesitamos definir la “uniformidad” de una manera más precisa, y esto nos lleva al concepto de fases.
Una fase es una región de materia que posee propiedades intensivas uniformes en todo su volumen. Un volumen de agua, un trozo de hielo, un grano de arena, un trozo de cobre, cada uno de estos constituye una sola fase, y por la definición anterior, se dice que es homogéneo. Una muestra de materia puede contener más de una sola fase; una bebida fría con hielo flotando en ella consiste en al menos dos fases, el líquido y el hielo. Si se trata de una bebida carbonatada, probablemente puedas ver burbujas de gas en ella que conforman una tercera fase.


Límites de fase
Cada fase en un sistema multifásico está separada de sus vecinos por un límite de fase, una región delgada en la que las propiedades intensivas cambian de manera discontinua. ¿Alguna vez te has preguntado por qué puedes ver fácilmente el hielo flotando en un vaso de agua aunque tanto el agua como el hielo son transparentes? La respuesta es que cuando la luz cruza un límite de fase, su dirección de desplazamiento se dobla ligeramente, y una parte de la luz se refleja de nuevo; son estos rayos de luz reflejados y distorsionados que emergen de los que revelan los trozos de hielo que flotan en el líquido.
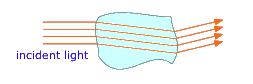
Si, en lugar de trozos visibles de material, la segunda fase se rompe en partículas diminutas, los rayos de luz suelen rebotar en las superficies de muchas de estas partículas en direcciones aleatorias antes de que emerjan del medio y sean detectados por el ojo. Este fenómeno, conocido como dispersión, da a los sistemas multifásicos de este tipo un aspecto turbio, volviéndolos translúcidos en lugar de transparentes. Dos ejemplos muy comunes son la niebla ordinaria, en la que se suspenden gotitas de agua en el aire, y la leche, que consiste en glóbulos de grasa de mantequilla suspendidos en una solución acuosa.
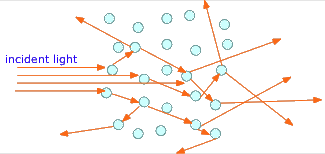
Volviendo a nuestra clasificación, podemos decir que la materia homogénea consiste en una sola fase a lo largo de su volumen; la materia heterogénea contiene dos o más fases.
Las dicotomías (clasificaciones “cualquiera o”) suelen descomponerse cuando se examinan de cerca, y la distinción entre materia homogénea y heterogénea es un buen ejemplo; esto es realmente una cuestión de grado, ¡ya que a nivel microscópico toda la materia está compuesta por átomos o moléculas separadas por espacio vacío! Para la mayoría de los propósitos prácticos, consideramos que la materia es homogénea cuando las discontinuidades que contiene son demasiado pequeñas para afectar su apariencia visual.
¿Qué tan grande debe ser una molécula o una aglomeración de moléculas antes de que comience a exhibir propiedades de un ser una fase separada? Dichas partículas abarcan la brecha entre los mundos micro y macro, y han sido conocidas como coloides desde que comenzaron a estudiarse alrededor de 1900. Pero con el desarrollo de la nanotecnología en la década de 1990, esta distinción se ha vuelto aún más borrosa.
Sustancias Puras y Mezclas
El aire que nos rodea, la mayoría de los líquidos y sólidos que encontramos, y toda demasiada del agua que bebemos consiste no en sustancias puras, sino en mezclas. Probablemente tengas una idea general de lo que es una mezcla, y en qué se diferencia de una sustancia pura; ¿cuál es el criterio científico para hacer esta distinción?
Para un químico, una sustancia pura suele referirse a una muestra de materia que tiene un conjunto distinto de propiedades que son comunes a todas las demás muestras de esa sustancia. Un buen ejemplo sería la sal ordinaria, el cloruro de sodio. No importa cuál sea su fuente (de una mina, evaporada del agua de mar o hecha en laboratorio), todas las muestras de esta sustancia, una vez purificadas, poseen el mismo conjunto único de propiedades.
Una sustancia pura es aquella cuyas propiedades intensivas son las mismas en cualquier muestra purificada de esa misma sustancia.Una mezcla, en contraste, está compuesta por dos o más sustancias, y puede exhibir una amplia gama de propiedades dependiendo de las cantidades relativas de los componentes presentes en la mezcla. Por ejemplo, puedes disolver hasta 357 g de sal en un litro de agua a temperatura ambiente, haciendo posible una infinita variedad de soluciones de “agua salada”. Para cada una de estas concentraciones, las propiedades como la densidad, los puntos de ebullición y congelación, y la presión de vapor de la solución resultante serán diferentes.
¿Algo es realmente puro?
Aquellos de nosotros que disfrutamos de la mantequilla de maní nunca compraríamos voluntariamente una marca anunciada como “impura”. Pero un artículo de Consumer Reports publicado hace algunos años mostraba una tabla que listaba el número de “excrementos de ratón” y “partes de insectos” (presumiblemente de silos de almacenamiento de maní) que encontraron en muestras de todas las principales marcas. ¡Buen provecho!
Por último, todos preferimos beber agua “pura”, pero no solemos preocuparnos por los gases atmosféricos disueltos e iones como Ca 2+ y HCO 3, que están presentes en la mayoría de las aguas potables. Pero estas “impurezas” inofensivas están siempre presentes en esas aguas “puras” de manantial.
y para- agua, respectivamente.La línea de fondo: Para un químico, el término “puro” tiene significado sólo en el contexto de una aplicación o proceso particular.
Clasificaciones operacionales y conceptuales
Dado que la química es una ciencia experimental, necesitamos un conjunto de criterios experimentales para colocar una muestra dada de materia en una de estas categorías. No hay un solo experimento que siempre logre decidir sin ambigüedades este tipo de preguntas. No obstante, hay un principio que siempre funcionará en teoría, si no en la práctica. Esto se basa en el hecho de que los diversos componentes de una mezcla pueden, en principio, separarse siempre en sustancias puras.
Considera una mezcla heterogénea de agua salada y arena. La arena se puede separar del agua salada por el proceso mecánico de filtración. De igual manera, la grasa de mantequilla contenida en la leche puede separarse del agua mediante un proceso conocido como batido, en el que la agitación mecánica obliga a las gotas de grasa de mantequilla a fusionarse en la masa sólida que conocemos como mantequilla. Estos ejemplos ilustran el principio general de que la materia heterogénea puede separarse en materia homogénea por medios mecánicos.
Cambiando esto, tenemos una definición operativa de materia heterogénea: Si, por alguna operación mecánica podemos separar una muestra de materia en dos o más tipos de materia, entonces nuestra muestra original era heterogénea. Para encontrar una definición operativa similar para mezclas homogéneas, considere cómo podríamos separar los dos componentes de una solución de agua salada. La forma más obvia sería evaporarse del agua, dejando la sal como un residuo sólido. Así, una mezcla homogénea se puede separar en sustancias puras al sufrir cambios parciales de estado apropiados, es decir, por evaporación, congelación, etc.
Anote el término parcial en la frase anterior; en el último ejemplo, evaporamos solo el agua, no la sal (¡lo cual sería muy difícil de hacer de todos modos!) La idea es que un componente de la mezcla se vea afectado preferencialmente por el proceso que estamos llevando a cabo. Este principio se enfatizará en los siguientes ejemplos.
Separación de mezclas homogéneas
A continuación se describen algunos métodos comunes de separación de mezclas homogéneas en sus componentes.
Destilación
Una mezcla de dos líquidos volátiles se elimina parcialmente por ebullición; las primeras porciones del vapor condensado se enriquecerán en el componente que tiene el punto de ebullición más bajo. Tenga en cuenta que si todo el líquido fuera evaporado, el destilado sería idéntico al líquido original. Pero si, digamos, se destila la mitad del líquido, el destilado contendría una fracción mayor del componente más volátil. Si el destilado se vuelve a destilar, se puede enriquecer aún más en el líquido de bajo punto de ebullición. Repitiendo este proceso muchas veces (ayudado por la columna de fraccionamiento por encima del recipiente de ebullición), se puede lograr un alto grado de separación.
Cristalización fraccional
Una solución saturada caliente que contiene dos o más sólidos disueltos se deja enfriar lentamente; el material menos soluble cristaliza primero y se puede separar por filtración. Este proceso es ampliamente empleado tanto en el laboratorio como, a una escala mucho mayor, en la industria.

De manera similar, una mezcla fundida de varios componentes, cuando se enfría lentamente, producirá primero cristales del material que tiene el punto de fusión más alto. Este proceso ocurre a gran escala en la naturaleza cuando el magma fundido del manto de la tierra se eleva a la litosfera y se enfría bajo tierra —un proceso que puede tardar hasta un millón de años. Es así como se forma la roca común conocida como granito. Eventualmente estas rocas se elevan y quedan expuestas en la superficie de la tierra.


Extracción líquido-líquido
Dos líquidos mutuamente insolubles, uno que contiene dos o más solutos (sustancias disueltas), se agitan juntos en un embudo separador. Cada soluto se concentrará en el líquido en el que sea más soluble. Luego, las dos soluciones se separan abriendo la llave de paso en la parte inferior, permitiendo que la solución más densa se drene.

Extracción sólido-líquido
Al trabajar con productos naturales como materiales vegetales, un primer paso suele ser extraer sustancias solubles de las partes de la planta. Esto, y extracciones similares de los componentes solubles de sólidos complejos, se realiza en un aparato conocido como extractor Soxhlet.

La idea es percolar continuamente un solvente caliente apropiado a través del material, el cual está contenido en un “dedal” de papel poroso. El vapor caliente del matraz hirviendo pasa por alto la cámara de extracción a través del brazo a la izquierda (etiquetado como “vapor” en la ilustración →) y al condensador, desde el cual gotea hacia abajo a la cámara de extracción, donde una porción del material soluble se mezcla con el disolvente. Cuando el condensado llega a la parte superior de la cámara, fluye hacia afuera a través del brazo de sifón, vaciando su contenido en el matraz hirviendo, que se concentra cada vez más en el material extraído.
La ventaja de este arreglo es que el proceso de percolación y extracción puede repetirse indefinidamente (generalmente de horas a días) sin mucha atención.
Cromatografía
A medida que una mezcla líquida o gaseosa fluye a lo largo de una columna que contiene un material adsorbente, los componentes adsorbidos más fuertemente tienden a moverse más lentamente y emerger más tarde que los componentes menos fuertemente adsorbidos. En este ejemplo, un extracto hecho de hojas de plantas se separa en sus componentes principales: caroteno, xantofila y clorofilas A y B.

Aunque la cromatografía se originó a mediados del siglo XIX, no se empleó ampliamente hasta la década de 1950, desde entonces ha abarcado una gran variedad de técnicas y ya no se limita a sustancias coloreadas. La cromatografía es ahora uno de los métodos más empleados para el análisis y separación de mezclas complejas de líquidos y gases.
Propiedades Físicas y Químicas
Dado que la química es en parte el estudio de las transformaciones que puede sufrir la materia, también podemos asignar a cualquier sustancia un conjunto de propiedades químicas que expresen los diversos cambios de composición que se sabe que sufre la sustancia. Las propiedades químicas también incluyen las condiciones de temperatura, etc., requeridas para provocar el cambio, y la cantidad de energía liberada o absorbida a medida que se produce el cambio.
Las propiedades que describimos anteriormente se conocen tradicionalmente como propiedades físicas, y deben distinguirse de las propiedades químicas que suelen referirse a cambios en la composición que puede sufrir una sustancia. Por ejemplo, podemos exponer algunas de las propiedades físicas y químicas más distintivas del elemento sodio:
|
Propiedades físicas (25 °C)
|
Propiedades químicas
|
|---|---|
|
|
Cuanto más de cerca se mira la distinción entre propiedades físicas y químicas, más borrosa se vuelve esta distinción. Por ejemplo, el alto punto de ebullición del agua en comparación con el del metano, CH 4, es consecuencia de las atracciones electrostáticas entre los enlaces O-H en moléculas adyacentes, en contraste con aquellos entre los enlaces C-H; en este nivel, ¡realmente nos estamos metiendo en la química! Entonces, aunque probablemente se espera que “distingas” las propiedades físicas y químicas en un examen, no te lo tomes demasiado en serio, ¡esto resulta ser una dicotomía bastante dudosa, amada por los maestros, pero de utilidad limitada!


