2.2: Energía, Calor y Temperatura
- Page ID
- 70787
- Explicar la diferencia entre la energía cinética y la energía potencial.
- Definir la energía química y la energía térmica.
- Definir calor y trabajo, y describir una limitación importante en su interconversión.
- Describir el significado físico de la temperatura.
- Explicar el significado de una escala de temperatura y describir cómo se define una escala particular.
- Convertir una temperatura expresada en Fahrenheit o Celsius a la otra escala.
- Describir la escala de temperatura Kelvin y su especial significado.
- Defina la capacidad calorífica y el calor específico, y explique cómo se pueden medir.
Todos los cambios químicos van acompañados de la absorción o liberación de calor. La íntima conexión entre materia y energía ha sido fuente de asombro y especulación desde los tiempos más primitivos; no es casualidad que el fuego fuera considerado uno de los cuatro elementos básicos (junto con la tierra, el aire y el agua) ya en el siglo V a.C. Esta unidad cubrirá solo los aspectos muy básicos de la asignatura, lo suficiente como para comenzar; hay un conjunto mucho más completo de lecciones sobre energía química en otros lugares.
¿Qué es la Energía?
La energía es uno de los conceptos más fundamentales y universales de la ciencia física, pero uno que es notablemente difícil de definir de manera que sea significativa para la mayoría de las personas. Esto quizá refleje el hecho de que la energía no es una “cosa” que existe por sí misma, sino que es más bien un atributo de la materia (y también de la radiación electromagnética) que puede manifestarse de diversas maneras. Se puede observar y medir sólo indirectamente a través de sus efectos sobre la materia que la adquiere, pierde o posee. La energía puede tomar muchas formas: mecánica, química, eléctrica, radiación (luz) y térmica. También sabes que la energía se conserva; se puede pasar de un objeto o lugar a otro, pero nunca puede simplemente desaparecer.
En el siglo XVII, el gran matemático Gottfried Leibniz (1646-1716) sugirió la distinción entre vis viva (“energía viva”) y vis mortua (“energía muerta”), que más tarde se conoció como energía cinética y energía potencial. A excepción de la energía radiante que se transmite a través de un campo electromagnético, la mayoría de las formas prácticas de energía que encontramos son de dos tipos: cinética y potencial.
- La energía cinética se asocia con el movimiento de un objeto; un cuerpo con una masa, m, y moviéndose a una velocidad, v, posee la energía cinética\( \frac{1}{2} mv^2\). Esta parte “v-cuadrada” es importante; si duplicas tu velocidad, consumes cuatro veces más combustible (glucosa para el corredor, gasolina o electricidad para tu auto.
- La energía potencial es la energía que tiene un cuerpo en virtud de su ubicación en un campo de fuerza, un campo gravitacional, eléctrico o magnético. Por ejemplo, si un objeto de masa m se eleva del suelo a una altura h, su energía potencial aumenta en mgh, donde g es una constante de proporcionalidad conocida como aceleración de la gravedad. De igual manera, la energía potencial de una partícula que tiene una carga eléctrica q depende de su ubicación en un campo electrostático.
La energía cinética y potencial son libremente interconvertibles
Toma un libro y manténgalo encima del tablero de la mesa; acabas de aumentar su energía potencial en el campo de fuerza de la gravedad terrestre. Ahora déjalo caer. Su energía potencial recién adquirida comienza a reaparecer como energía cinética a medida que acelera hacia abajo a una velocidad que aumenta en 9.8 m/seg cada segundo (9.8 m seg —2 o 32 ft seg —2). En el instante en que golpea la superficie, la energía potencial que le diste suministrada al libro ahora se ha convertido completamente en energía cinética.
¿Y qué pasa con esa energía cinética después de que el libro deja de moverse? Sigue ahí, pero ya no se puede ver su efecto; ahora se ha dispersado como energía cinética térmica (“calor”) en las moléculas del libro, la superficie de la mesa y, en última instancia, en los alrededores, incluido el aire.
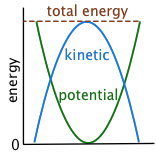
Cuanto más lo pienses, más ejemplos de conversión cinético-potencial encontrarás en la vida cotidiana. En muchos otros casos, sin embargo, se puede ver que la energía de un objeto se alterna repetidamente entre las formas potenciales y cinéticas. Dejado solo, el proceso continúa indefinidamente hasta que la fricción ha disipado la energía hacia el entorno.
Cementerios de Energía: Energía térmica
La energía se conserva: no puede crearse ni destruirse. Pero puede, y eventualmente siempre lo hará, desaparecer de nuestra visión y en el mundo microscópico de las partículas moleculares individuales. Todas las moléculas están en un estado continuo de movimiento y, por lo tanto, poseen energía cinética. Pero a diferencia del movimiento de un cuerpo masivo como una pelota de béisbol o un automóvil que se mueve a lo largo de una trayectoria definida, los movimientos de átomos o moléculas individuales son aleatorios y caóticos, cambiando para siempre en magnitud y dirección a medida que chocan entre sí o (como en el caso de un gas) con las paredes del contenedor.
A la suma total de toda esta energía cinética aleatoria a escala microscópica dentro de un cuerpo se le da un nombre especial, energía térmica. Aunque no podemos ver directamente la energía térmica en acción, ciertamente podemos sentirla; como veremos más adelante, se correlaciona directamente con la temperatura de un objeto.
La conexión química
Los átomos y las moléculas son los principales actores de la energía térmica, pero también poseen otros tipos de energía que juegan un papel importante en la química.
Energía de bonos
H 2 + es lo suficientemente estable energéticamente como para existir como una entidad identificable, y así se ajusta a la definición de molécula. Pero también es extremadamente reactivo, por lo que no se sienta por ahí por mucho tiempo. Solo se puede observar cuando una descarga eléctrica de alto voltaje pasa a través del gas hidrógeno; el resplandor azul que uno ve representa su desaparición ya que capta electrones y vuelve a la molécula de dihidrógeno H 2 mucho más estable.
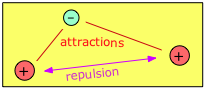
Consideremos, por ejemplo, la molécula más simple posible. Se trata del ion molécula de hidrógeno, H 2 +, en el que un solo electrón atrae simultáneamente a dos protones. Estos protones, que tienen cargas idénticas, se repelen entre sí, pero esto es superado por las atracciones electrón-protón, lo que lleva a una disminución neta de la energía potencial cuando un electrón se combina con dos protones. Esta disminución de energía potencial es suficiente para permitir que H 2 + exista como una molécula discreta que podemos representar como [H—H] + para representar explícitamente el enlace químico que une los dos átomos.
La fuerza de un enlace químico aumenta a medida que la energía potencial asociada con su formación se vuelve más negativa.
Los enlaces químicos también poseen cierta energía cinética que se asocia con el “movimiento” del electrón a medida que se propaga al espacio extendido que ocupa en lo que llamamos el “enlace”. Se trata de un efecto cuántico que no tiene contraparte clásica. La energía cinética tiene sólo la mitad de la magnitud de la energía potencial y trabaja en su contra; la energía de enlace total es la suma de las dos energías.
Energía química
Los enlaces químicos en las moléculas de glucosa almacenan la energía que alimenta nuestros cuerpos.
Las moléculas son vehículos tanto para almacenar como para transportar energía, y los medios para convertirla de una forma a otra cuando la formación, ruptura o reordenamiento de los enlaces químicos dentro de ellas va acompañada de la captación o liberación de energía, más comúnmente en forma de calor.
La energía química se refiere al potencial y la energía cinética asociada con los enlaces químicos en una molécula. Considera lo que sucede cuando el hidrógeno y el oxígeno se combinan para formar agua. Los reactivos H 2 y O 2 contienen más energía de enlace que H 2 O, por lo que cuando se combinan, se libera el exceso de energía emitida en forma de energía térmica, o “calor”.
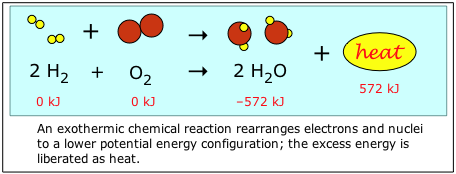
Por convención, el contenido energético de los elementos químicos en su estado natural (H 2 y O 2 en este ejemplo) se definen como “cero”. Esto facilita mucho los cálculos, y da a la mayoría de los compuestos “energías de formación” negativas. (ver abajo)
La energía química se manifiesta de muchas maneras diferentes:
- químico → térmico → cinético químico → térmico → cinético + radiante
- químico → eléctrico → cinético (función nerviosa, movimiento muscular)
- químico → eléctrico
Las escalas de energía son siempre arbitrarias
Al principio podrías pensar que un libro sentado sobre la mesa tiene cero energía cinética ya que no se mueve. En verdad, sin embargo, la tierra misma se mueve; está girando sobre su eje, está orbitando al sol, y el sol mismo se aleja de las otras estrellas en la expansión general del universo. Dado que estos movimientos normalmente no nos interesan, somos libres de adoptar una escala arbitraria en la que se mide la velocidad del libro con respecto a la tabla; en este llamado sistema de coordenadas de laboratorio, la energía cinética del libro puede considerarse cero.
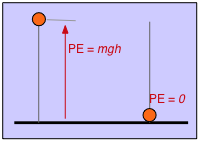
Hacemos lo mismo con la energía potencial. Si definimos la altura del tablero como el cero de energía potencial, entonces un objeto que tenga una masa\(m\) suspendida a una altura h por encima del tablero tendrá una energía potencial de mgh. Ahora deja caer el objeto; a medida que se acelera en el campo gravitacional de la tierra, su energía potencial se transforma en energía cinética. Un instante antes de que golpee el tablero de la mesa, esta transformación es completa y la energía cinética\(\frac{1}{2}mv^2\) es idéntica a la mgh original. A medida que el objeto llega a descansar, su energía cinética aparece como calor (tanto en el objeto mismo como en la superficie de la mesa) a medida que la energía cinética se vuelve aleatorizada como energía térmica.
Unidades de energía
La energía se mide en términos de su capacidad para realizar trabajos o para transferir calor. El trabajo mecánico se realiza cuando una fuerza f desplaza un objeto por una distancia d:
\[W = f\cdot d\]
La unidad básica de energía es el joule. Un julio es la cantidad de trabajo realizado cuando una fuerza de 1 newton actúa sobre una distancia de 1 m; así 1 J = 1 N-m. Un newton es la cantidad de fuerza requerida para acelerar una masa de 1 - kg por 1 metro por segundo en un segundo - 1 m seg —2, por lo que las dimensiones básicas del joule son kg m 2 s —2. Las otras dos unidades de energía que están en amplio uso son la caloría y la BTU (unidad térmica británica). Estos se definen en términos del efecto de calentamiento sobre el agua. Por el momento, limitaremos nuestra atención al joule y a la caloría.
El calor y el trabajo se miden en unidades de energía, pero no constituyen energía en sí misma. Como explicaremos a continuación, se refieren a procesos por los cuales la energía se transfiere hacia o desde algo, un bloque de metal, un motor o una taza de agua.
Calor
Cuando un cuerpo más cálido se pone en contacto con un cuerpo más frío, la energía térmica fluye del más cálido al más frío hasta que sus dos temperaturas son idénticas. El cuerpo más cálido pierde una cantidad de energía térmica Δ E, y el cuerpo más frío adquiere la misma cantidad de energía. Describimos este proceso diciendo que “Δ E julios de calor han pasado del cuerpo más cálido al más frío”. Es importante, sin embargo, entender que el Calor es la transferencia de energía debido a una diferencia de temperatura.
El calor NO fluye
A menudo nos referimos a un “flujo” de calor, recordando la noción del siglo XVIII de que el calor era una sustancia real llamada “calórica” que podía fluir como un líquido. Este es un nombre inapropiado; el calor es un proceso y no es algo que pueda ser contenido o almacenado en un cuerpo. Es importante que entiendas esto, porque el uso del término en nuestra conversación ordinaria (“el calor es terrible hoy”) tiende a hacernos olvidar esta distinción.
Básicamente existen tres mecanismos por los cuales se puede transferir el calor: conducción, radiación y convección. Este último proceso ocurre cuando las dos temperaturas diferentes hacen que diferentes partes de un fluido tengan densidades diferentes.

Trabajo
El trabajo es la transferencia de energía por cualquier proceso que no sea el calor.El trabajo, al igual que la energía, puede tomar diversas formas: mecánica, eléctrica, gravitacional, etc. Todos tienen en común el hecho de que son producto de dos factores, un término de intensidad y un término de capacidad. Por ejemplo, la forma más simple de trabajo mecánico surge cuando un objeto se mueve una cierta distancia contra una fuerza contraria. El trabajo eléctrico se realiza cuando un cuerpo que tiene una cierta carga se mueve a través de una diferencia de potencial.
|
tipo de trabajo
|
factor de intensidad
|
factor de capacidad
|
fórmula
|
|---|---|---|---|
| mecánico | fuerza | cambio en la distancia | \(f\Delta x\) |
| gravitacional | potencial gravitacional (una función de la altura) | masa | mgh |
| eléctrico | diferencia de potencial | cantidad de carga | \(Q\Delta V\) |
La realización del trabajo implica una transformación de la energía; así, cuando un libro cae al suelo, se realiza un trabajo gravitacional (una masa se mueve a través de una diferencia de potencial gravitacional), y la energía potencial que tenía el libro antes de que se dejara caer se convierte en energía cinética que en última instancia es dispersos en forma de energía térmica.
El trabajo mecánico es producto de la fuerza ejercida sobre un cuerpo y la distancia que se mueve: 1 N-m = 1 J.
El calor y el trabajo se consideran mejor como procesos por los cuales se intercambia la energía, más que como la energía misma. Es decir, el calor “existe” sólo cuando fluye, el trabajo “existe” sólo cuando se está haciendo.
Cuando dos cuerpos se colocan en contacto térmico y la energía fluye del cuerpo más cálido al más frío, llamamos al proceso “calor”. Una transferencia de energía hacia o desde un sistema por cualquier medio que no sea el calor se denomina “trabajo”.
De manera que se puede pensar en el calor y el trabajo solo como formas diferentes de lograr lo mismo: la transferencia de energía de un lugar u objeto a otro.
Para asegurarte de entender esto, supongamos que te dan dos recipientes idénticos de agua a 25°C. En un recipiente colocas un calentador eléctrico de inmersión hasta que el agua haya absorbido 100 julios de calor. El segundo recipiente se agita vigorosamente hasta que se hayan realizado 100 J de trabajo en él. Al final, ambas muestras de agua habrán sido calentadas a la misma temperatura y contendrán la misma cantidad incrementada de energía térmica. De ninguna manera se puede decir cuál contiene “más trabajo” o “más calor”.
Una limitación importante en la conversión de energía
Un motor de gas convierte la energía química disponible en su combustible en energía térmica. Solo una parte de esto está disponible para realizar trabajos; el resto se dispersa en los alrededores a través del escape. Esta limitación es la esencia de la Segunda Ley de la Termodinámica a la que llegaremos mucho más adelante en este curso
La energía térmica es muy especial de una manera crucial. Todas las demás formas de energía son interconvertibles: la energía mecánica puede convertirse completamente en energía eléctrica, y esta última puede convertirse completamente en térmica, como en el ejemplo de calentamiento de agua descrito anteriormente. Pero aunque el trabajo se puede convertir completamente en energía térmica, la conversión completa de la energía térmica en trabajo es imposible. Un dispositivo que logra parcialmente esta conversión se conoce como motor de calor; una máquina de vapor, un motor a reacción y el motor de combustión interna en un automóvil son ejemplos bien conocidos.
La temperatura y su significado
Todos tenemos una idea general de lo que significa la temperatura, y comúnmente la asociamos con “calor”, que, como señalamos anteriormente, es una palabra ampliamente incomprendida. Ambos se relacionan con lo que describimos anteriormente como energía térmica, la energía cinética aleatoria asociada a los diversos movimientos de la materia a nivel atómico y molecular.
El calor, recordarás, no es algo que esté “contenido dentro” de un cuerpo, sino más bien un proceso en el que la energía [térmica] entra o sale de un cuerpo como resultado de una diferencia de temperatura.
Entonces, cuando calientas tu taza de té al permitir que absorba 1000 J de calor de la estufa, puedes decir que el agua ha adquirido 1000 J de energía —pero no de calor. Si, en cambio, “calientas” tu té en un horno microondas, el agua adquiere su energía agregada por absorción directa de energía electromagnética; debido a que este proceso no es impulsado por una diferencia de temperatura, el calor no estuvo involucrado al!!
Termometría
Comúnmente medimos la temperatura por medio de un termómetro, un dispositivo que emplea algún material que posee una propiedad que varía en proporción directa a la temperatura. Las más comunes de estas propiedades son la densidad de un líquido, la expansión térmica de un metal o la resistencia eléctrica de un material.
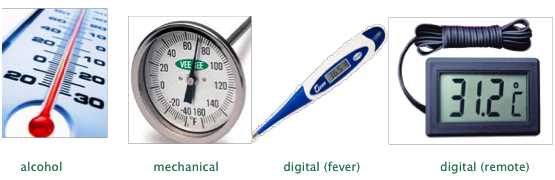
El termómetro ordinario que solemos pensar emplea un reservorio de líquido cuya expansión térmica (disminución de densidad) hace que se eleve en un tubo capilar. El mercurio metálico se ha utilizado tradicionalmente para este propósito, al igual que un alcohol (generalmente isopropílico) que contiene un tinte rojo.
El mercurio fue el líquido termométrico estándar de elección por más de 200 años, pero su uso para este propósito se ha ido eliminando gradualmente debido a su neurotoxicidad. Aunque la quema de carbón, la eliminación de lámparas fluorescentes, la incineración y la eliminación de baterías son las principales fuentes de entrada de mercurio al medio ambiente, desde hace mucho tiempo se sabe que los termómetros rotos liberan cientos de toneladas de mercurio. Una vez derramadas, pequeñas gotas del metal líquido tienden a alojarse en depresiones y grietas del piso donde pueden emitir vapor durante años.
Temperatura
La temperatura es una medida de la energía cinética promedio de las moléculas dentro del agua. Se puede pensar en la temperatura como una expresión de la “intensidad” con la que la energía térmica en un cuerpo se manifiesta en términos de movimiento molecular caótico, microscópico.
- El calor es la cantidad de energía térmica que entra o sale de un cuerpo.
- La temperatura mide la energía cinética traduccional promedio de las moléculas en un cuerpo.
Esta animación representa los movimientos traslacionales térmicos de las moléculas en un gas. En líquidos y sólidos, hay muy poco espacio vacío entre las moléculas, y en su mayoría simplemente chocan y se mueven entre sí.
Notarás que hemos colado la palabra "traslacional" en esta definición de temperatura. La traducción se refiere a un cambio de ubicación: en este caso, las moléculas se mueven en direcciones aleatorias. Esta es la forma principal de energía térmica en condiciones ordinarias, pero las moléculas también pueden sufrir otros tipos de movimiento, a saber, rotaciones y vibraciones internas. Estas dos últimas formas de energía térmica no son realmente “caóticas” y no contribuyen a la temperatura.
La energía se mide en julios y la temperatura en grados. Esta diferencia refleja la importante distinción entre energía y temperatura:
- Podemos decir que 100 g de agua caliente contienen más energía (¡no calor!) de 100 g de agua fría. Y debido a que la energía es una cantidad extensa, sabemos que una porción de 10 g de esta agua caliente contiene solo el diez por ciento de energía que la cantidad total de 100 g.
- La temperatura, por el contrario, no es una medida de cantidad; al ser una propiedad intensiva, es más una “cualidad” que describe la “intensidad” con la que se manifiesta la energía térmica. Por lo que tanto las porciones de 100 g como de 10 g del agua caliente descritas anteriormente poseen la misma temperatura.
Básculas de temperatura
La temperatura se mide observando su efecto sobre alguna variable dependiente de la temperatura como el volumen de un líquido o la resistencia eléctrica de un sólido. Para expresar una temperatura numéricamente, necesitamos definir una escala que esté marcada en incrementos uniformes a los que llamamos grados. La naturaleza de esta escala —su punto cero y la magnitud de un grado— son completamente arbitrarias.
Aunque las medias aproximadas para estimar y comparar temperaturas han existido desde el año 170 d.C., el primer termómetro de mercurio y escala de temperatura fueron introducidos en Holanda en 1714 por Gabriel Daniel Fahrenheit.

Fahrenheit estableció tres puntos fijos en su termómetro. Cero grados era la temperatura de una mezcla de hielo, agua y sal, que era aproximadamente la temperatura más fría que se podía reproducir en un laboratorio de la época. Cuando omitió la sal de la suspensión, alcanzó su segundo punto fijo cuando la combinación agua-hielo se estabilizó en “el grado treinta y segundo”. Su tercer punto fijo fue “encontrado como el noventa y seis grados, y el espíritu se expande a este grado cuando el termómetro se sostiene en la boca o debajo de la axila de un hombre vivo en buena salud”. Después de la muerte de Fahrenheit en 1736, su termómetro fue recalibrado utilizando 212 grados, temperatura a la que hierve el agua, como punto fijo superior. La temperatura normal del cuerpo humano registró 98.6 en lugar de 96.
¡Belice y Estados Unidos son los únicos países que todavía utilizan la escala Fahrenheit!
En 1743, el astrónomo sueco Anders Celsius ideó la escala centígrada acertadamente llamada que coloca exactamente 100 grados entre los dos puntos de referencia definidos por los puntos de congelación y ebullición del agua.
Por razones más conocidas a Celsius, asignó 100 grados al punto de congelación del agua y 0 grados a su punto de ebullición, resultando en una escala invertida que a nadie le gustó. Después de su muerte un año después, la báscula se puso al revés. La escala centígrada revisada se adoptó rápidamente en todas partes excepto en el mundo de habla inglesa, y se convirtió en la unidad métrica de temperatura. En 1948 fue renombrada oficialmente como la escala Celsius.
Comparaciones y conversiones de temperatura
Cuando decimos que la temperatura es de tantos grados, debemos especificar la escala particular en la que estamos expresando esa temperatura. Una escala de temperatura tiene dos características definitorias, las cuales se pueden elegir arbitrariamente:
- La magnitud del incremento unitario de temperatura, es decir, el tamaño del grado.
Para expresar una temperatura dada en una escala en términos de otra, es necesario tomar en cuenta ambos factores.
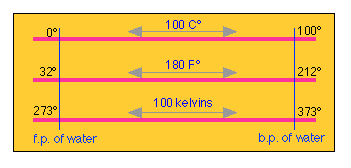
Convertir entre Celsius y Fahrenheit es fácil si se tiene en cuenta que entre los llamados puntos de hielo y vapor del agua hay 180 grados Fahrenheit, pero solo 100 grados Celsius, haciendo que el F° 100/180 = 5/9 la magnitud del C°.
Debido a que el punto de hielo está a 32 °F, las dos escalas están compensadas por esta cantidad. Si recuerdas esto, no hay necesidad de memorizar una fórmula de conversión; puedes resolverla cuando la necesites. Obsérvese la distinción entre “°C” (una temperatura) y “C°” (un incremento de temperatura).
Básculas de temperatura absoluta
Cerca de finales del siglo XIX cuando comenzó a entenderse el significado físico de la temperatura, se sintió la necesidad de una escala de temperatura cuyo cero realmente significa cero —es decir, la ausencia total de movimiento térmico. Esto dio lugar a la escala de temperatura absoluta cuyo punto cero es —273.15 °C, pero que conserva la misma magnitud de grado que la escala Celsius. Esto finalmente pasó a llamarse después de Lord Kelvin (William Thompson) por lo que el grado Celsius se convirtió en el kelvin. Ahora es común expresar un incremento como cinco C° como “cinco kelvin”
En 1859 el ingeniero y físico escocés William J.M. Rankine propuso una escala de temperatura absoluta basada en el grado Fahrenheit. El cero absoluto (0° Ra) corresponde a —459.67°F La escala Rankine ha sido ampliamente utilizada por esos mismos ingenieros estadounidenses y británicos que se deleitan en expresar energías en unidades de BTU y masas en libras.
La importancia de las escalas de temperatura absoluta es que las temperaturas absolutas se pueden ingresar directamente en todas las fórmulas fundamentales de la física y la química en las que la temperatura es una variable. Quizás el ejemplo más común, conocido por todos los estudiantes principiantes, es el estado de ecuación de gas ideal.
\[PV = nRT\]
Capacidad calorífica
A medida que un cuerpo pierde o gana calor, su temperatura cambia en proporción directa a la cantidad de energía térmica q transferida:
\[q= C\Delta T\]
La constante de proporcionalidad C se conoce como la capacidad calorífica
\[ C = \frac{q}{\Delta T} \]
Si Δ T se expresa en kelvin (grados) y q en julios, las unidades de C son J K —1. Es decir, la capacidad calorífica nos dice cuántos julios de energía se necesitan para cambiar la temperatura de un cuerpo en 1 C°. Cuanto mayor sea el valor de C, menor será el efecto de un cambio de energía dado sobre la temperatura.
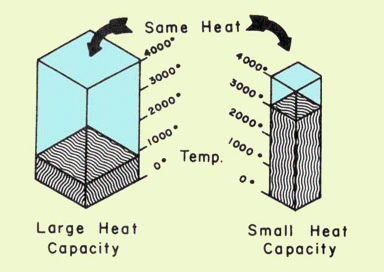
Debe quedar claro que C es una propiedad extensa, es decir, depende de la cantidad de materia. Todo el mundo sabe que se requiere una cantidad mucho mayor de energía para lograr un cambio de 10 C° en la temperatura de 1 L de agua en comparación con 10 mL de agua. Por esta razón, se acostumbra expresar C en términos de cantidad unitaria, como por gramo, en cuyo caso se convierte en la capacidad calorífica específica, comúnmente denominada “calor específico” y tiene las unidades J K —1 g —1.
Así, si cantidades idénticas de calor fluyen en dos cuerpos que tienen diferentes capacidades de calor, el que tiene la menor capacidad calorífica sufrirá el mayor cambio de temperatura. (Podría resultarle útil pensar en la capacidad calorífica como una medida de la capacidad de un cuerpo para resistir un cambio de temperatura al absorber o perder calor). Nota: se espera conocer las unidades de calor específico. La ventaja de hacerlo es que no es necesario aprender una “fórmula” para resolver problemas específicos de calor.
¿Cuántos julios de calor deben fluir en 150 mL de agua a 0 °C para elevar su temperatura a 25 °C?
Solución
La masa del agua es (150 mL) × (1.00 g mL —1) = 150 g El calor específico del agua es 4.18 J K —1 g —1. A partir de la definición de calor específico, la cantidad de energía
q = Δ E es (150 g) (25.0 K) (4.18 J K —1 g —1) = 16700 J.
¿Cómo puedo racionalizar este procedimiento? Debe ser obvio que cuanto mayor sea la masa de agua y mayor sea el cambio de temperatura, más calor se requerirá, por lo que estas dos cantidades van en el numerador. De igual manera, la energía requerida variará inversamente con el calor específico, que por lo tanto va en el denominador.
| Sustancia |
C, J /g-K |
|---|---|
| Aluminio | 0.900 |
| Cobre | 0.386 |
| Plomo | 0.128 |
| Mercurio | 0.140 |
| Zinc | 0.387 |
| Alcohol (etanol) | 2.4 |
| Agua | 4.18 |
| Hielo (—10° C) | 2.05 |
| Gasolina (n -octano) | 0.53 |
| Vidrio | 0.84 |
| Carbono (grafito/diamante) | 0.710/.509 |
| Cloruro de sodio | 0.854 |
| Roca (granito) | 0.790 |
| Aire | 1.01 |
Tenga en cuenta especialmente lo siguiente:
- Las capacidades caloríficas molares de los elementos metálicos son casi idénticas. Esta es la base de la Ley de Dulong y Petit, que sirvió como una herramienta importante para estimar los pesos atómicos de algunos elementos.
- El enlace de hidrógeno intermolecular en agua y alcoholes resulta en capacidades caloríficas anómalas para estos líquidos; lo mismo ocurre con el hielo, en comparación con otros sólidos.
- Los valores para grafito y diamante son consistentes con el principio de que los sólidos que están más “ordenados” tienden a tener mayores capacidades de calor.
Una pieza de níquel que pesa 2.40 g se calienta a 200.0 °C, y luego se deja caer en 10.0 mL de agua a 15.0 °C. La temperatura del metal baja y la del agua sube hasta alcanzar el equilibrio térmico y ambas están a 18.0 °C. ¿Cuál es el calor específico del metal?
Solución
La masa del agua es (10 mL) × (1.00 g mL —1) = 10 g El calor específico del agua es 4.18 1 J K —1 g —1 y su temperatura aumentó 3.0 C°, lo que indica que absorbió (10 g) (3 K) (4.18 J K —1 g —1) = 125 J de energía. La muestra metálica perdió esta misma cantidad de energía, sufriendo como resultado una caída de temperatura de 182 C°. La capacidad calorífica específica del metal es:
(125 J)/(2.40 g) (182 K) = 0.287 J K —1 g —1.
Observe que aquí no se requiere “fórmula” siempre y cuando conozca las unidades de calor específico; simplemente coloque las cantidades relevantes en el numerador o denominador para que las unidades salgan correctamente.


