4.1: Átomos, Elementos y Núcleo
- Page ID
- 70798
Asegúrese de comprender a fondo las siguientes ideas esenciales:
- Dar una definición química de elemento, y comentar la distinción entre los términos átomo y elemento.
- Debes conocer los nombres y símbolos de los elementos más comunes, incluyendo aquellos cuyos símbolos se derivan de sus nombres latinos.
- Describa, en sus propias palabras, las Leyes del Cambio Químico: conservación masiva, composición constante y múltiples proporciones.
- Explique cómo estas leyes se derivan de la teoría atómica de Dalton.
- Describir el experimento de dispersión de rayos alfa-de Rutherford y cómo condujo al presente modelo del átomo.
- Definir el número atómico y el número de masa, y explicar la relación entre ellos.
- Definir isótopo y nucleido, y escribir el símbolo para un nucleido de un elemento dado con un número dado de neutrones.
- Explicar el propósito de un espectrómetro de masas y su principio general de funcionamiento.
- Describir la escala de peso atómico.
- Encuentre el peso molecular o el peso de fórmula t de una fórmula química.
- Defina la unidad unificada de masa atómica y escriba los números másicos del protón, neutrón y electrón.
Los conceptos paralelos del elemento y el átomo constituyen los fundamentos mismos de la ciencia química. Como tal, el concepto del elemento es uno macroscópico que se relaciona con el mundo que podemos observar con nuestros sentidos. El átomo es la realización microscópica de este concepto; es decir, es la partícula física real que es única para cada elemento químico. Su tamaño muy pequeño ha impedido durante mucho tiempo que los átomos sean observables por medios directos, por lo que su existencia no fue universalmente aceptada hasta finales del siglo XIX. El hecho de que todavía se escuche la mención de la "teoría atómica de la materia” no debe implicar que ahora exista alguna duda sobre la existencia de los átomos. Pocas teorías en la historia de la ciencia han sido tan exhaustivamente validadas y también son entendidas.

Aunque la palabra átomo suele referirse a un tipo específico de partícula (un “átomo de magnesio”, por ejemplo), nuestro uso cotidiano del elemento tiende a ser más general, refiriéndose no solo a una sustancia compuesta por un tipo particular de átomo (“el bromo es uno de los pocos elementos que son líquidos a temperatura ambiente”), sino también a átomos en un sentido colectivo (“el magnesio es uno de los elementos que tiene dos electrones en su capa exterior”).
El concepto subyacente de los átomos como los bloques básicos de construcción de la materia ha existido durante mucho tiempo. Ya en el 600 a.C., el filósofo gujarati (indio) Acharya Kanad escribió que "Todo objeto de creación está hecho de átomos que a su vez se conectan entre sí para formar moléculas”. Un par de siglos después, en 460 a. C., el filósofo griego Demócrito razonó que si sigues rompiendo una pieza de materia en fragmentos cada vez más pequeños, habrá algún punto en el que las piezas no se pueden hacer más pequeñas. Llamó a estas “partículas de materia básica”, es decir, átomos. Pero esto era solo filosofía; no se convertiría en ciencia hasta 1800 cuando John Dalton mostró cómo el concepto atómico seguía naturalmente de los resultados de experimentos cuantitativos basados en mediciones de peso.
Elementos
El elemento es la unidad fundamental de identidad química. El concepto del elemento es muy antiguo. Se desarrolló en muchas civilizaciones diferentes en un intento de racionalizar la variedad del mundo y comprender la naturaleza del cambio, como, el cambio que ocurre cuando un trozo de madera se pudre, o se quema para producir carbón o ceniza. Los más conocidos por nosotros son los cuatro elementos “tierra, aire, fuego y agua” que fueron popularizados por los filósofos griegos (principalmente Empedocoles y Aristóteles) en el periodo 500-400 a.C.
A estos, los filósofos védicos (hindúes) de la India agregaron espacio, mientras que el antiguo concepto chino de Wu Xing consideraba la tierra, el metal, la madera, el fuego y el agua como fundamentales. Estos elementos básicos no se consideraban generalmente como los materiales reales que conocemos como tierra, agua, etc., sino que representaban los “principios” o esencias que los elementos transmitían a los diversos tipos de materia que encontramos en el mundo.
Finalmente, la experiencia práctica (en gran parte relacionada con la extracción de metales a partir de minerales) y los inicios de la experimentación científica en el siglo XVIII llevaron a nuestro concepto moderno del elemento químico. Un elemento es una sustancia: la forma más simple a la que se puede reducir cualquier otra sustancia química mediante un tratamiento térmico o químico apropiado. “Lo más simple”, en el contexto de la experimentación de la época, se definió en términos de peso; el cinabrio (sulfuro mercúrico) se puede descomponer en dos sustancias, el mercurio y el azufre, que a su vez no pueden reducirse a formas más ligeras.

Aunque Lavoisier acertó a muchos de estos, sí logró incluir algunas cosas que no encajan del todo en nuestra idea moderna de lo que constituye un elemento químico. Hay dos errores de este tipo en la sección superior de la tabla que deberías poder identificar aunque tu francés sea menos que tip-top— ¿puedes encontrarlos?
La otra mala asignación de Lavoisier de los elementos en la sección inferior no fue realmente su culpa. La tiza, la magnesia, las baritas, la alúmina y la sílice son compuestos altamente estables que contienen oxígeno; las altas temperaturas requeridas para descomponerlos no se pudieron lograr en la época de Lavoisier (la magnesia es de lo que está hecho el ladrillo de fuego). La clasificación adecuada de estas sustancias se retrasó hasta que la experimentación posterior reveló su verdadera naturaleza. Diez de los elementos químicos se conocen desde la antigüedad y cinco más fueron descubiertos a lo largo del siglo XVII.
Algunas preguntas frecuentes sobre los elementos
- ¿Cuántos elementos hay? Se han encontrado noventa y dos elementos en la naturaleza. Alrededor de 25 más se han hecho artificialmente, pero todos estos se descomponen en elementos más ligeros, con algunos de ellos desapareciendo en minutos o incluso segundos.
- ¿De dónde vienen los elementos? La creencia actual es que el helio y algunos otros elementos muy ligeros se formaron dentro de unos tres minutos del “big bang”, y que los siguientes 23 elementos (arriba a través del hierro) se forman principalmente por procesos de fusión nuclear dentro de las estrellas, en los que los núcleos más ligeros se combinan en elementos sucesivamente más pesados. Elementos más pesados que el hierro no se pueden formar de esta manera, y se producen sólo durante el catastrófico colapso de estrellas masivas (explosiones de supernovas).
- ¿Cómo varían los elementos en abundancia? De manera bastante marcada, y muy diferente en diferentes cuerpos en el cosmos. La mayoría de los átomos del universo aún consisten en hidrógeno, siendo el helio un segundo distante. En la Tierra, el oxígeno, el silicio y el aluminio son los más abundantes. Estos perfiles sirven como guías útiles para construir modelos para la formación de la tierra y otros cuerpos planetarios. El sistema de símbolos de elementos que utilizamos hoy fue establecido por el químico sueco Jons Jacob Berzelius en 1814. Antes de esa época, se utilizaron símbolos gráficos alquímicos, los cuales luego fueron modificados y popularizados por John Dalton. Afortunadamente para los angloparlantes, los símbolos de la mayoría de los elementos sirven como nemotécnicos para sus nombres, pero esto no es cierto para los siete metales conocidos desde la antigüedad, cuyos símbolos se derivan de sus nombres latinos. La otra excepción es el tungsteno (un nombre derivado del sueco), cuyo símbolo W refleja el nombre alemán que se usa más ampliamente.
- ¿Cómo se organizan los elementos? Dos principios organizativos generales desarrollados en el siglo XIX: uno se basó en los pesos relativos crecientes (pesos atómicos) de los elementos, dando una lista que comienza de esta manera:
H Él Li Ser B C N O F Ne Na Mg Al Si P S Cl Ar K Ca...
Los átomos se vuelven reales
A lo largo de la mayor parte de la historia la idea de que la materia está compuesta por partículas diminutas había languidecido como abstracción filosófica conocida como atomismo, y no se había establecido una relación clara entre estos “átomos” y los “elementos” químicos. Esto comenzó a cambiar a principios de 1800 cuando el desarrollo de balanzas que permitieron mediciones razonablemente precisas de los cambios de peso asociados a reacciones químicas marcó el comienzo de una nueva y fructífera era de química experimental. Esto resultó en el reconocimiento de varias leyes de cambio químico que sentaron las bases para la teoría atómica de la materia.

Leyes del Cambio Químico
Recordemos que una “ley”, en el contexto de la ciencia, es solo una relación, descubierta a través de la experimentación, que está suficientemente bien establecida para ser considerada como fuera de toda duda para la mayoría de los fines prácticos. Debido a que es la naturaleza de los científicos cuestionar lo “incuestionable”, ocasionalmente sucede que sí surgen excepciones, en cuyo caso la ley debe sufrir la modificación apropiada.
La conservación de la energía masiva suele considerarse la más fundamental de la ley de la naturaleza. También es un buen ejemplo de una ley que tuvo que ser modificada; se conocía simplemente como Conservación de la Masa hasta que Einstein demostró que la energía y la masa son intercambiables. Sin embargo, el término más antiguo es perfectamente aceptable dentro del campo de la química ordinaria en la que los cambios energéticos son demasiado pequeños para tener un efecto medible en las relaciones de masas. Dentro del contexto de la química, la conservación de la masa puede considerarse como “conservación de átomos”. El cambio químico simplemente los baraja en nuevos arreglos.
La conservación masiva tuvo especial importancia en la comprensión de los cambios químicos que involucran gases, que durante algún tiempo no siempre fueron considerados como materia real en absoluto. (Debido a sus densidades muy pequeñas, llevar a cabo mediciones de peso real en gases es bastante difícil de hacer, y estuvo mucho más allá de las capacidades de los primeros experimentadores). Así, cuando el metal magnesio se quema en el aire, el peso del producto sólido siempre supera al del metal original, lo que implica que el proceso es aquel en el que el metal se combina con lo que podría haberse pensado que era un componente “ingrávido” del aire, que ahora sabemos que es oxígeno.

Más importante aún, este resultado experimental nos dice algo muy importante sobre la masa del átomo de oxígeno en relación con la del átomo de magnesio.
La Ley de Proporciones Definidas, también conocida como la ley de la composición constante, establece que la proporción en peso del elemento presente en cualquier sustancia pura es siempre la misma. Esto nos permite generalizar la relación que ilustramos anteriormente.
¿Cuántos kilogramos de magnesio metálico podrían obtenerse teóricamente descomponiendo 0.400 kg de óxido de magnesio en sus elementos?
Solución
La relación de masa de Mg a O en este compuesto es
\ [\ dfrac {1} {1.66} = 0.602 \ nonumber\]
por lo que 0.400 kg del óxido contiene
\ [(0.400\; kg)\ times 0.602 = 0.241\;\ text {kg de Mg} \ nonumber.\]
El hecho de que nos preocupe lo contrario de la reacción antes citada es irrelevante.
La Ley de Proporciones Múltiples aborda el hecho de que Muchas combinaciones de elementos pueden reaccionar para formar más de un compuesto. En tales casos, esta ley establece que los pesos de un elemento que se combinan con un peso fijo de otro de estos elementos son múltiplos enteros entre sí. Es fácil decir esto, pero por favor asegúrate de entender cómo funciona. El nitrógeno forma un número muy grande de óxidos, cinco de los cuales se muestran aquí.
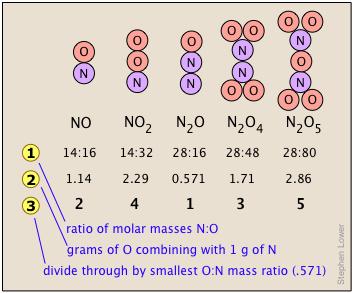
 La línea muestra la relación de los pesos relativos de los dos elementos en cada compuesto. Estas relaciones se calcularon simplemente tomando la masa molar de cada elemento, y multiplicando por el número de átomos de ese elemento por mol del compuesto. Así para NO 2, tenemos (1 × 14): (2 × 16) = 13:32. (Estos números no se conocían en los primeros días de la Química porque los pesos atómicos (es decir, masas molares) de la mayoría de los elementos no se conocían de manera confiable.
La línea muestra la relación de los pesos relativos de los dos elementos en cada compuesto. Estas relaciones se calcularon simplemente tomando la masa molar de cada elemento, y multiplicando por el número de átomos de ese elemento por mol del compuesto. Así para NO 2, tenemos (1 × 14): (2 × 16) = 13:32. (Estos números no se conocían en los primeros días de la Química porque los pesos atómicos (es decir, masas molares) de la mayoría de los elementos no se conocían de manera confiable.- Los números en Línea
 son solo las relaciones de masa de O:N, que se encuentran dividiendo las proporciones correspondientes en la línea 1. Pero alguien que depende únicamente del experimento los resolvería encontrando la masa de O que se combina con la masa unitaria (1 g) de nitrógeno.
son solo las relaciones de masa de O:N, que se encuentran dividiendo las proporciones correspondientes en la línea 1. Pero alguien que depende únicamente del experimento los resolvería encontrando la masa de O que se combina con la masa unitaria (1 g) de nitrógeno. - La línea se obtiene dividiendo las cifras la línea anterior por la relación O:N más pequeña en la línea anterior, que es la de N 2 O. Obsérvese que así como dice la ley de proporciones múltiples, el peso de oxígeno que combina con el peso unitario de nitrógeno trabaja a números enteros pequeños.
- Por supuesto que con la misma facilidad podríamos haber ilustrado la ley considerando la masa de nitrógeno que combina con un gramo de oxígeno; ¡funciona en ambos sentidos!
El nitrógeno y el hidrógeno forman muchos compuestos, algunos de los cuales también involucran otros elementos. La masa de hidrógeno que se combina con 1.00 g de nitrógeno para formar tres de estos compuestos son: urea, 0.1428 g; amoníaco, 0.0714 g; cloruro amónico, 0.2857 g. Mostrar que estos datos son consistentes con la Ley de Proporciones Múltiples.
Solución
El “peso fijo” que estamos considerando aquí es el nitrógeno. La inspección de los números anteriores muestra que el amoníaco contiene la menor relación en peso H:N = 0.0714, mientras que la relación en peso de H:N en urea es el doble de este número, y que en cloruro amónico es cuatro veces 0.0714. Así, las relaciones H:N se encuentran en sí mismas en la proporción de 2:1:4, respectivamente, y se confirma la Ley.
La interpretación de Dalton estableció la teoría atómica
La idea de que la materia está compuesta por pequeños “átomos” de algún tipo había existido por lo menos durante 2000 años. El logro de Dalton fue identificar átomos con elementos químicos reales.

Si los premios Nobel hubieran existido a principios de los 1800, el maestro de escuela de inglés/meteorólogo/ químico John Dalton (1766-1844) sin duda habría ganado uno por mostrar cómo la información experimental disponible en ese momento, plasmada en las leyes del cambio químico que acabamos de describir, son totalmente consistentes con la hipótesis de que los átomos son las unidades más pequeñas de identidad química. Estos puntos de la teoría atómica de Dalton proporcionaron explicaciones satisfactorias de todas las leyes del cambio químico señaladas anteriormente:
La explicación de Dalton sobre la Ley de Conservación de la Masa fue que en realidad es una consecuencia de la “conservación de los átomos” que se presume son indestructibles por medios químicos. En las reacciones químicas, los átomos simplemente se reordenan, pero nunca se destruyen.
La explicación de Dalton de la ley de composición constante fue que si los compuestos se componen de números definidos de átomos, cada uno de los cuales tiene su propia masa característica, entonces la masa relativa de cada elemento en un compuesto debe ser siempre la misma. Así, los elementos deben estar siempre presentes en una muestra pura de un compuesto en las mismas proporciones en masa.
Un conjunto dado de elementos suele formar dos o más compuestos en los que los números de átomos de algunos de los elementos son diferentes. Porque estos números deben ser enteros (¡no puedes tener “la mitad” de un átomo!) , la masa de un elemento combinada con una masa fija de cualquier otro elemento en cualquiera de estos dos compuestos puede diferir solo por números enteros. Así, para la serie de compuestos nitrógeno-hidrógeno citados en el Ejemplo de Problema anterior, tenemos las siguientes relaciones:
| Compuesto | Fórmula | relación en peso H:N | relación a 0.0714 |
|---|---|---|---|
|
urea
|
CO (NH 2) 2
|
0.1428
|
2
|
|
amoníaco
|
NH 3
|
0.0714
|
1
|
|
cloruro de amonio
|
NH 4 Cl
|
0.2857
|
4
|
Aunque de inmediato se encontró que la teoría atómica de Dalton era una herramienta útil para organizar el conocimiento químico, pasó algún tiempo antes de que llegara a ser aceptada como una verdadera representación del mundo. Así, tan tarde como 1887, un comentarista observó
“Los átomos son trozos redondos de madera inventados por el señor Dalton”.
Estas bolas de madera han evolucionado hasta convertirse en imágenes generadas por computadora derivadas del microscopio de fuerza atómica (AFM), un dispositivo electromecánico exquisitamente sensible en el que se registra la distancia entre la punta de una sonda submicroscópica de alambre y la superficie directamente debajo de ella a medida que la sonda se mueve una superficie a la que se adsorben los átomos. El principio general de la AFM es bastante simple, ¡pero su realización en un dispositivo real puede parecer algo intimidante! Este microscopio de fuerza atómica altamente especializado es uno de varios dispositivos similares descritos en este Laboratorio Nacional de Argonne.
Masas Relativas
La teoría atómica de Dalton inmediatamente llevó a la conclusión de que aunque los átomos son demasiado pequeños para ser estudiados directamente, sus masas relativas pueden estimarse observando los pesos de los elementos que se combinan para formar compuestos similares. Estos pesos a veces se denominan pesos de combinación. Sin embargo, hay una dificultad: necesitamos conocer las fórmulas de los compuestos que estamos considerando para poder hacer comparaciones válidas. Por ejemplo, podemos encontrar las masas relativas de dos átomos X e Y que se combinan con el oxígeno sólo si asumimos que los valores de n en las dos fórmulas\(XO_n\) y\(YO_n\) son los mismos. Pero las masas muy relativas que estamos tratando de encontrar deben conocerse para determinar estas fórmulas.
La forma de solucionar esto fue enfocarse en compuestos binarios (de dos elementos) que se suponía que tenían relaciones de átomos simples como 1:1, 1:2, etc., y esperar que se encontrara suficientes compuestos 1:1 para proporcionar un punto de partida para comparar los diversos pares de pesos de combinación. Los compuestos de oxígeno, conocidos como óxidos, desempeñaron un papel especialmente importante aquí, en parte porque casi todos los elementos químicos forman compuestos con oxígeno, y la mayoría de ellos tienen fórmulas muy simples.
—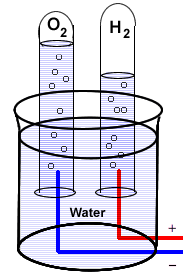
La primera prueba de que el agua está compuesta por hidrógeno y oxígeno fue por el descubrimiento, en 1800, de que una corriente eléctrica podría descomponer el agua en estos elementos. Observe los volúmenes 2:1 de los dos gases desplazando el agua en la parte superior de los tubos.
De estos compuestos de oxígeno, el que contiene hidrógeno —agua ordinaria— había sido ampliamente estudiado. Experimentos anteriores habían dado que la composición del agua es de 87.4 por ciento de oxígeno y 12.6 por ciento de hidrógeno en peso. Esto significa que si se asume [incorrectamente] que la fórmula del agua es HO, entonces la relación en masa de los dos tipos de átomos debe ser O:H = 87.4/12.6 = 6.9. Trabajos posteriores corrigieron esta cifra a 8, pero la suposición equivocada sobre la fórmula del agua quedaría plagando la química durante casi cincuenta años hasta que estudios sobre volúmenes de gas demostraron que el agua es H 2 O.
Dalton reconoció plenamente la naturaleza tentativa de las relaciones en peso basadas en fórmulas simples asumidas como HO para agua, pero sin embargo pudo compilar en 1810 una lista de los pesos relativos de los átomos de algunos de los elementos que investigó observando cambios de peso en reacciones químicas.
|
hidrógeno
|
nitrógeno
|
carbono
|
oxígeno
|
fósforo
|
azufre
|
hierro
|
zinc
|
cobre
|
plomo
|
|---|---|---|---|---|---|---|---|---|---|
|
1
|
5
|
5.4
|
7
|
9
|
13
|
50
|
56
|
56
|
95
|
Debido a que el hidrógeno es el elemento más ligero, se le asignó un peso relativo de unidad. Al asignar masas relativas definidas a átomos de los diferentes elementos, Dalton había dado realidad al concepto del átomo y estableció el vínculo entre átomo y elemento. Una vez que se conocieron las fórmulas químicas correctas de más compuestos, estudios de peso combinado más precisos finalmente condujeron a los pesos relativos de los átomos que conocemos hoy como los pesos atómicos, que discutimos más adelante.
El átomo nuclear
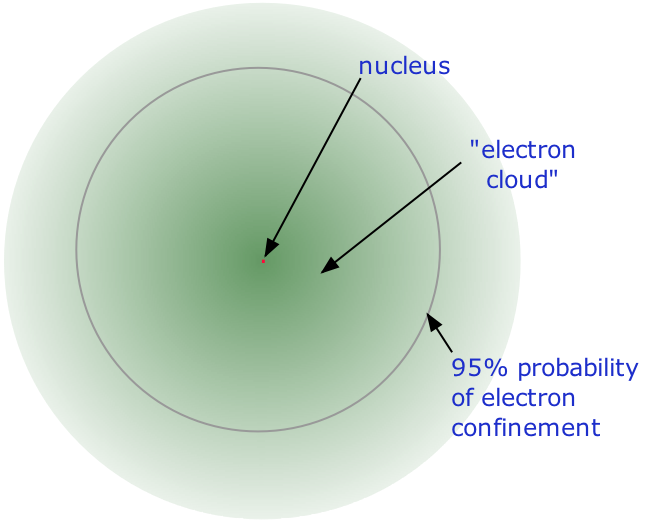
La naturaleza física precisa de los átomos emergió finalmente de una serie de elegantes experimentos realizados entre 1895 y 1915. El más notable de estos logros fue el famoso experimento de dispersión de rayos alfa-1911 de Ernest Rutherford, que estableció que
 •
•
- Casi toda la masa de un átomo está contenida dentro de un núcleo minúsculo (y por lo tanto extremadamente denso) que lleva una carga eléctrica positiva cuyo valor identifica a cada elemento y se conoce como el número atómico del elemento.
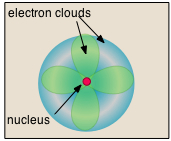
- Casi todo el volumen de un átomo consiste en un espacio vacío en el que residen los electrones, los portadores fundamentales de carga eléctrica negativa. La masa extremadamente pequeña del electrón (1/1840 la masa del núcleo de hidrógeno) hace que se comporte como una partícula cuántica, lo que significa que no se puede especificar su ubicación en ningún momento; lo mejor que podemos hacer es describir su comportamiento en términos de la probabilidad de que se manifieste en cualquier punto del espacio. Es común (pero algo engañoso) describir el volumen de espacio en el que los electrones de un átomo tienen una probabilidad significativa de ser encontrados como la nube de electrones. Este último no tiene límite exterior definido, así que tampoco el átomo. El radio de un átomo debe definirse arbitrariamente, como el límite en el que se puede encontrar el electrón con 95% de probabilidad. Los radios atómicos suelen ser de 30-300pm.
Protones y Neutrones
El núcleo en sí está compuesto por dos tipos de partículas. Los protones son los portadores de carga eléctrica positiva en el núcleo; la carga protónica es exactamente la misma que la carga electrónica, pero de signo opuesto. Esto significa que en cualquier átomo [eléctricamente neutro], el número de protones en el núcleo (a menudo referido como la carga nuclear) se equilibra con el mismo número de electrones fuera del núcleo.
Iones
Debido a que los electrones de un átomo están en contacto con el mundo exterior, es posible que se pierdan uno o más electrones, o se agreguen algunos nuevos. El átomo cargado eléctricamente resultante se llama ion.
La otra partícula nuclear es el neutrón. Como su nombre lo indica, esta partícula no lleva carga eléctrica. Su masa es casi la misma que la del protón. La mayoría de los núcleos contienen aproximadamente el mismo número de neutrones y protones, por lo que podemos decir que estas dos partículas juntas representan casi toda la masa del átomo.
Número atómico (Z)
¿Qué parámetro único caracteriza de manera única al átomo de un elemento dado? No es la masa relativa del átomo, como veremos en la sección sobre isótopos a continuación. Es, más bien, el número de protones en el núcleo, al que llamamos el número atómico y denotamos con el símbolo Z. Cada protón lleva una carga eléctrica de +1, por lo que el número atómico también especifica la carga eléctrica del núcleo. En el átomo neutro, los protones Z dentro del núcleo están equilibrados por electrones Z fuera de él.

Moseley buscó una propiedad medible de cada elemento que aumentara linealmente con el número atómico. Encontró esto en una clase de rayos X emitidos por un elemento cuando es bombardeado con electrones. Las frecuencias de estos rayos X son únicas para cada elemento, y aumentan uniformemente en elementos sucesivos. Moseley encontró que las raíces cuadradas de estas frecuencias dan una línea recta cuando se trazan contra Z; esto le permitió ordenar los elementos en orden de aumentar el número atómico.
Se puede pensar en el número atómico como una especie de número de serie de un elemento, empezando en 1 para hidrógeno y aumentando en uno por cada elemento sucesivo. El nombre químico del elemento y su símbolo están vinculados de manera única al número atómico; así el símbolo “Sr” significa estroncio, cuyos átomos tienen todos Z = 38.
Número de masa (A)
Esto es sólo la suma de los números de protones y neutrones en el núcleo. A veces está representado por el símbolo A, por lo que
\[A = Z + N\]
en el que Z es el número atómico y N es el número de neutrones.
Nuclidos y sus Símbolos
El término nucleido se refiere simplemente a cualquier tipo particular de núcleo. Por ejemplo, un núcleo de número atómico 7 es un nucleido de nitrógeno. Cualquier nucleido se caracteriza por el par de números (Z, A). El símbolo del elemento depende solo de Z, por lo que el símbolo 26 Mg se utiliza para especificar el nucleido masa-26 de magnesio, cuyo nombre implica Z =12. Una forma más explícita de denotar un tipo particular de núcleo es sumar el número atómico como subíndice. Por supuesto, esto es algo redundante, ya que el símbolo Mg siempre implica Z =12, pero a veces es una conveniencia a la hora de discutir varios nucleidos.
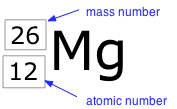
Dos nucleidos que tienen el mismo número atómico pero diferentes números de masa se conocen como isótopos. La mayoría de los elementos ocurren en la naturaleza como mezclas de isótopos, pero veintitrés de ellos (incluyendo berilio y flúor, que se muestran en la tabla) son monoisotópicos. Por ejemplo, hay tres isótopos naturales de magnesio: 24 Mg (79% de todos los átomos de Mg), 25 Mg (10%) y 26 Mg (11%); los tres están presentes en todos los compuestos de magnesio en aproximadamente estas mismas proporciones.
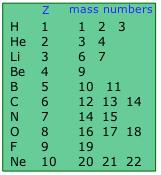
Aproximadamente 290 isótopos ocurren en la naturaleza. Los dos isótopos pesados de hidrógeno son especialmente importantes, tanto que tienen nombres y símbolos propios:

El deuterio representa solo alrededor de 15 de cada millón de átomos de hidrógeno. El tritio, que es radiactivo, es aún menos abundante. Todo el tritio en la tierra es un subproducto de la desintegración de otros elementos radiactivos.
Pesos atómicos
Por supuesto, los átomos son demasiado pequeños para pesarlos directamente; las mediciones de peso solo se pueden hacer en los números masivos (pero desconocidos) de átomos que se observan en las reacciones químicas. Los primeros experimentos de peso combinado de Dalton y otros establecieron que el hidrógeno es el más ligero de los átomos, pero la naturaleza cruda de las mediciones e incertidumbres sobre las fórmulas de muchos compuestos dificultó el desarrollo de una escala confiable de los pesos relativos de los átomos. Incluso las medidas de peso más exigentes que podemos hacer hoy en día están sujetas a incertidumbres experimentales que limitan la precisión a cuatro cifras significativas en el mejor de los casos.
Atomos de pesaje: Espectrometría de masas
Una forma alternativa de examinar el comportamiento de las partículas atómicas individuales se hizo evidente en 1912, cuando J.J. Thomson y F.W. Aston demostraron que una corriente de átomos de neón gaseosos, desdoblada por medio de una descarga eléctrica, produjo dos tipos de partículas subatómicas con cargas eléctricas opuestas, como se reveló por sus deflexiones en campos magnéticos y electrostáticos aplicados externamente. (Las deflexiones en sí mismas podrían ser observadas por las manchas que las partículas hicieron al impactar sobre una placa fotográfica). Esto, combinado con el hallazgo hecho un año antes por Wilhelm Wien de que el grado de deflexión de una partícula en estos campos es proporcional a la relación de su carga eléctrica a su masa, abrió el camino para caracterizar estas partículas por lo demás invisibles.
Los átomos neutros, al no tener carga, no pueden acelerarse a lo largo de un camino para formar un haz, ni pueden desviarse. Sin embargo, se les puede hacer adquirir cargas eléctricas dirigiéndoles un haz de electrones, y esta fue la base del primer espectrómetro de masas desarrollado por el ex alumno de Thomson, F.W. Aston (1877-1945, Premio Nobel de 1922) en 1919. Esto le permitió identificar rápidamente 212 de los 287 isótopos naturales.
El espectrómetro de masas se ha convertido en uno de los instrumentos de laboratorio más utilizados. La espectrometría de masas ahora se utiliza principalmente para identificar moléculas. La ionización generalmente rompe una molécula en fragmentos que tienen diferentes proporciones de carga a masa, cada molécula da como resultado una “huella” única de partículas cuyo origen se puede deducir mediante una reconstrucción similar a un rompecabezas. Durante muchos años, la “espectrometría de masas” se había limitado a moléculas pequeñas, pero con el desarrollo de nuevas formas de crear iones a partir de moléculas, ahora se ha convertido en una herramienta importante para analizar materiales y biomoléculas grandes, incluidas las proteínas.
La escala de pesos relativos (la escala de peso atómico) que ahora usamos se basa en\(\ce{^{12}_6C}\), cuya masa relativa se define como exactamente 12. Los pesos atómicos son las relaciones entre los pesos de un elemento y el peso de un número idéntico de\(\ce{^{12}_6C}\) átomos. Al ser proporciones, los pesos atómicos son adimensionales.
De 1850 a 1961 se definió la escala de peso atómico en relación al oxígeno = 16.
Un cierto número (llamarlo “un trillón”) de átomos de oxígeno pesa 1.200 g. ¿Cuál será el peso de un número igual de átomos de litio?
Solución
De la tabla de pesos atómicos, la relación másica de Li/O = 6.94/16.00, por lo que el peso de un trillón de átomos de litio será
\ [(1.200\; g)\ veces\ dfrac {6.94} {16.00} =0.570\; g \ nonumber\]
Se puede visualizar la escala de peso atómico como una larga línea de números que va desde 1 hasta alrededor de 280. El comienzo de la escala se ve así:
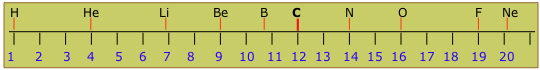
Notarás que las masas relativas de los diferentes elementos (mostrados en la parte superior) no son todos enteros. Si todos los núcleos difieran por números integrales de protones y neutrones que tienen masas prácticamente idénticas, esperaríamos que los pesos atómicos fueran enteros. Algunos están muy cerca de los enteros (la razón por la que no son exactamente integrales se explicará en la siguiente sección), pero muchos no están ni cerca de integrales. Esta desconcertante observación finalmente condujo al concepto de isótopos.
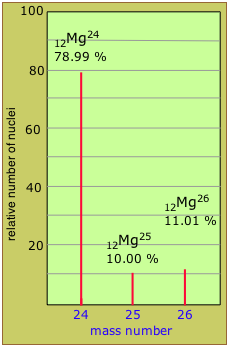
Estimar el peso atómico promedio del magnesio a partir de los datos de abundancia isotópica mostrados en la gráfica de espectrometría de masas anterior.
Solución
Simplemente tomamos el promedio ponderado de los números de masa:
(0.7899 × 24) + (0.1000 × 25) + (0.1101 × 26) = 24.32
Nota: El peso atómico medido de Mg (24.305) es ligeramente menor que este debido a que las masas atómicas de los componentes nucleares no son estrictamente aditivas, como se explicará más adelante.
Cuando solo hay dos isótopos significativamente abundantes, se pueden estimar las abundancias relativas a partir de los números de masa y el peso atómico promedio. El siguiente es un problema de examen favorito:
El peso atómico promedio del cloro es 35.45 y el elemento tiene dos isótopos estables\(\ce{^{35}_{17}Cl}\) y\(\ce{^{37}_{17}Cl}\). Estimar las abundancias relativas de estos dos isótopos.
Solución
¡Aquí finalmente puedes poner a trabajar tu álgebra de secundaria! Si dejamos que x represente la fracción de\(\ce{^{35}Cl}\), entonces (1- x) da la fracción de\(\ce{^{37}Cl}\). El peso atómico promedio ponderado es entonces
35 x + 37 (1- x) = 35.45
Resolviendo para x da 2 x = 1.55, x = 0.775, por lo que las abundancias son 77.5% Cl 35 y 22.5% Cl 37.
El cloro elemental, Cl 2, está conformado por los dos isótopos mencionados en el ejemplo anterior. ¿Cuántos picos esperarías observar en el espectro de masas de Cl 2?
Solución
El espectrómetro de masas detectará un pico para cada posible combinación de los dos isótopos en diclorina: 35 Cl- 35 Cl, 35 Cl- 37 Cl y 37 Cl- 37 Cl.
Tablas de Pesos Atómicos
se actualizan cada pocos años a medida que se dispone de mejores datos.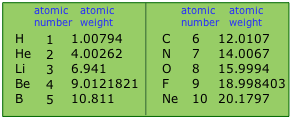
Una peculiaridad que podrías notar es que el número de cifras significativas varía de un elemento a otro. Tiende a ser más alto para los elementos monoisotópicos, como puedes ver aquí para el berilio y el flúor. Para algunos elementos, las abundancias isotópicas varían ligeramente, dependiendo de la fuente; esta varianza reduce la precisión útil de un valor.
Pesos atómicos, pesos moleculares y pesos de fórmulas
Las moléculas están compuestas por átomos, por lo que un peso molecular es solo la suma de los pesos atómicos de los elementos que contiene.
¿Cuál es el peso molecular del ácido sulfúrico,\(H_2SO_4\)?
Solución
Los pesos atómicos de hidrógeno y de oxígeno son 1.01 y 16.00, respectivamente (debe tener estos valores comunes memorizados). De una mesa, se puede encontrar que el peso atómico del azufre es de 32.06. Sumando todo, tenemos
\[(2 \times 1.01) + 32.06 + (4 \times 16.00) = 98.08\]
Debido a que algunos sólidos no están compuestos por moléculas discretas (cloruro de sodio, NaCl y sílice, SiO 2 son ejemplos comunes), el término peso de la fórmula se usa a menudo en lugar del peso molecular. En general, los términos peso molecular y peso de fórmula son intercambiables.
Fraccionamiento Isotópico
Los isótopos de un elemento dado son tan similares en su comportamiento químico que las pequeñas diferencias que pueden existir pueden considerarse insignificantes para la mayoría de los propósitos prácticos. Sin embargo, los isótopos más pesados tienden a reaccionar o evaporarse ligeramente más lentamente que los más ligeros, por lo que dado el tiempo suficiente, diversos procesos geoquímicos pueden resultar en un enriquecimiento de un isótopo sobre el otro, un efecto conocido como fraccionamiento isotópico geoquímico.
Las diferencias que sí existen son más evidentes en los elementos más ligeros, y especialmente en el hidrógeno, cuyos tres isótopos difieren en masa en cantidades relativamente grandes. Así, el “agua pesada”, D 2 O (2 H 2 O) no se descompone por electrólisis tan rápidamente como lo es 1 H 2 O, por lo que se enriquece en la porción no descompuesta del agua en un aparato de electrólisis. Su punto de ebullición es de 101.7°C y se congela a 3.8°. Los animales morirán si beben agua pesada en lugar de agua ordinaria.
Las diminutas diferencias entre los comportamientos de la mayoría de los isótopos constituyen una herramienta invaluable para la investigación en geoquímica. Por ejemplo, la pequeña fracción de moléculas de agua que contienen O 18 se evapora más lentamente que la más ligera (y mucho más abundante) H 2 O 16. Pero la relación de O 18 a O 16 en el agua que se evapora depende de la temperatura a la que se produzca este proceso. Al observar esta proporción en núcleos de hielo glacial y en depósitos de carbonatos marinos, es posible determinar la temperatura promedio de la tierra en diversos momentos del pasado.
Masas atómicas
Aquí de nuevo está el comienzo de la báscula de peso atómico que viste arriba:

Ya entiendes que los pesos atómicos son pesos relativos, basados en una escala definida por 6 C 12 = 12. Pero, ¿cuál es el peso absoluto de un átomo, expresado en gramos o kilogramos? En otras palabras, ¿qué masa real representa cada unidad en la escala de peso atómico?
La respuesta es 1.66053886 × 10 —27 kg. Esta cantidad (cuyo valor no necesitas memorizar) se conoce como la unidad unificada de masa atómica, denotada por la abreviatura u o amu. La unidad unificada de masa atómica se define como 1/12 de la masa de un átomo de carbono-12. Afortunadamente, no necesitas memorizar este valor, porque puedes calcular fácilmente su valor a partir del número de Avogadro, N A, que se espera que conozcas:
\[1\, u = \dfrac{1}{N_A} \;g = \dfrac{1}{1000\; N_A} \;Kg\]
Nota: Definición de Unidad de Masa Atómica
La unidad unificada de masa atómica se define como 1/12 de la masa de un átomo de carbono-12.
Masas de las Partículas Subatómicas
Los átomos están compuestos por protones, neutrones y electrones, cuyas propiedades se muestran a continuación:
|
partícula
|
masa, g
|
masa, u
|
cargar
|
símbolo
|
|---|---|---|---|---|
| electrón | 9.1093897 × 10 —28 | 5.48579903 × 10 —4 | 1— | \(\ce{_{–1}^{0}e}\) |
| protón | 1.6726231 × 10 —24 | 1.007276470 | 1+ | \(\ce{_1^0H^{+}}\)o\(\ce{_1^0p}\) |
| neutrones | 1.6749286 × 10 —24 | 1.008664904 | 0 | \(\ce{_1^0n}\) |
Dos puntos importantes deben señalarse de la Tabla\(\PageIndex{1}\):
- La masa del electrón es insignificante en comparación con la de las dos partículas nucleares;
- El protón y el neutrón tienen masas que son casi, pero no exactamente, idénticas.
Masas Nucleares
Como mencionamos en uno de los ejemplos problemáticos anteriores, la masa de un núcleo siempre es ligeramente diferente de las masas de los nucleones (protones y neutrones) de los que está compuesto. La diferencia, conocida como defecto de masa, está relacionada con la energía asociada a la formación del núcleo a través de la famosa fórmula de Einstein e = mc 2. Esta es la única instancia de la química en la que se debe tener en cuenta la conservación de la energía masiva, más que de la masa sola. Pero no hace falta que te preocupes por esto en esta parte del curso.
Para todos los fines prácticos, hasta llegar a la sección del curso sobre química nuclear, se puede considerar que el protón y el neutrón tienen masas de aproximadamente 1 u, y que la masa de un átomo (en u) es solo la suma de los números de neutrones y protones.


