4.2: El número de Avogadro y el Topo
- Page ID
- 70793
Asegúrese de comprender a fondo las siguientes ideas esenciales:
- Define el número de Avogadro y explique por qué es importante conocerlo.
- Define el topo. Ser capaz de calcular el número de moles en una masa dada de una sustancia, o la masa correspondiente a un número dado de moles.
- Definir el peso molecular, el peso de la fórmula y la masa molar; explicar en qué se diferencia este último de los dos primeros.
- Ser capaz de encontrar el número de átomos o moléculas en un peso dado de una sustancia.
- Encontrar el volumen molar de un sólido o líquido, dada su densidad y masa molar.
- Explicar cómo el volumen molar de un sólido metálico puede conducir a una estimación del diámetro atómico.
Los cambios químicos que observamos siempre involucran números discretos de átomos que se reordenan en nuevas configuraciones. Estos números son ENORMES— de magnitud demasiado grande para que podamos contar o incluso visualizar, pero siguen siendo números, y necesitamos tener una manera de lidiar con ellos. También necesitamos un puente entre estos números, que no podemos medir directamente, y los pesos de las sustancias, que sí medimos y observamos. El concepto mole proporciona este puente, y es fundamental para toda la química cuantitativa.
Contando átomos: Número de Avogadro
Debido a su pequeño tamaño, los átomos y moléculas no pueden ser contados por observación directa. Pero tanto como lo hacemos al “contar” los frijoles en un frasco, podemos estimar el número de partículas en una muestra de un elemento o compuesto si tenemos alguna idea del volumen que ocupa cada partícula y el volumen del recipiente. Una vez hecho esto, conocemos el número de unidades de fórmula (para usar el término más general para cualquier combinación de átomos que deseamos definir) en cualquier peso arbitrario de la sustancia. El número, por supuesto, dependerá tanto de la fórmula de la sustancia como del peso de la muestra. No obstante, si consideramos un peso de sustancia que es el mismo que su fórmula peso (molecular) expresado en gramos, solo tenemos un número para conocer: el número de Avogadro.
Número de Avogadro
El número de Avogadro es conocido por diez dígitos significativos:
\[N_A = 6.022141527 \times 10^{23}.\]
Sin embargo, solo necesitas conocerlo a tres cifras significativas:
\[N_A \approx 6.02 \times 10^{23}. \label{3.2.1}\]
Entonces, ¿\(6.02 \times 10^{23}\)de qué? Bueno, de lo que quieras: manzanas, estrellas en el cielo, burritos. No obstante, el único uso práctico para ello\(N_A\) es tener una forma más conveniente de expresar el enorme número de partículas diminutas como átomos o moléculas que tratamos en química. El número de Avogadro es un número colectivo, igual que una docena. Los estudiantes pueden pensar en la “docena de químicos”.\(6.02 \times 10^{23}\)
Antes de entrar en el uso del número de Avogadro en problemas, tómate un momento para convencerte del razonamiento plasmado en los siguientes ejemplos.
Los pesos atómicos de oxígeno y carbono son 16.0 y 12.0 unidades de masa atómica (\(u\)), respectivamente. ¿Cuánto más pesado es el átomo de oxígeno en relación con el carbono?
Solución
Los pesos atómicos representan las masas relativas de diferentes tipos de átomos. Esto significa que el átomo de oxígeno tiene una masa que es
\[\dfrac{16\, \cancel{u}}{12\, \cancel{u}} = \dfrac{4}{3} ≈ 1.33 \nonumber\]
tan grande como la masa de un átomo de carbono.
La masa absoluta de un átomo de carbono es 12.0 unidades de masa atómica unificadas (\(u\)). ¿Cuántos gramos pesará un solo átomo de oxígeno?
Solución
La masa absoluta de un átomo de carbono es 12.0\(u\) o
\[12\,\cancel{u} \times \dfrac{1.6605 \times 10^{–24}\, g}{1 \,\cancel{u}} = 1.99 \times 10^{–23} \, g \text{ (per carbon atom)} \nonumber\]
La masa del átomo de oxígeno será 4/3 mayor (del Ejemplo\(\PageIndex{1}\)):
\[ \left( \dfrac{4}{3} \right) 1.99 \times 10^{–23} \, g = 2.66 \times 10^{–23} \, g \text{ (per oxygen atom)} \nonumber\]
Alternativamente podemos hacer el cálculo directamente como con carbono:
\[16\,\cancel{u} \times \dfrac{1.6605 \times 10^{–24}\, g}{1 \,\cancel{u}} = 2.66 \times 10^{–23} \, g \text{ (per oxygen atom)} \nonumber\]
Supongamos que tenemos átomos de\(N\) carbono, donde\(N\) hay un número lo suficientemente grande como para darnos un montón de átomos de carbono cuya masa es de 12.0 gramos. ¿Cuánto pesaría el mismo número,\(N\), de átomos de oxígeno?
Solución
\(\PageIndex{1}\)Volvemos a utilizar los resultados de Ejemplo. La colección de átomos de\(N\) oxígeno tendría una masa de
\[\dfrac{4}{3} \times 12\, g = 16.0\, g. \nonumber\]
¿Cuál es el valor numérico de\(N\) en Ejemplo\(\PageIndex{3}\)?
- Responder
-
Utilizando los resultados de Ejemplos\(\PageIndex{2}\) y\(\PageIndex{3}\).
\[N \times 1.99 \times 10^{–23} \, g \text{ (per carbon atom)} = 12\, g \nonumber\]
o
\[N = \dfrac{12\, \cancel{g}}{1.99 \times 10^{–23} \, \cancel{g} \text{ (per carbon atom)}} = 6.03 \times 10^{23} \text{atoms} \nonumber \]
Hay muchos átomos en 12 g de carbono.
Cosas para entender sobre el número de Avogadro
- Es un número, así como lo es “docena”, y así es adimensional.
- Es un número enorme, mucho mayor en magnitud de lo que podemos visualizar
- Su uso práctico se limita a contar pequeñas cosas como átomos, moléculas, “unidades de fórmula”, electrones o fotones.
- El valor de N A solo puede conocerse con la precisión de que se pueda estimar el número de átomos en un peso medible de una sustancia. Debido a que grandes números de átomos no se pueden contar directamente, se han realizado una variedad de ingeniosas mediciones indirectas que involucran cosas como el movimiento browniano y la dispersión de rayos X.
- El valor de la corriente se determinó midiendo las distancias entre los átomos de silicio en un cristal ultrapuro de este elemento que se conformó en una esfera perfecta. (La medición se realizó por dispersión de rayos X). Cuando se combina con la masa medida de esta esfera, produce el número de Avogadro. Sin embargo, hay dos problemas con esto:
- La esfera de silicio es un artefacto, más que ser algo que ocurre en la naturaleza, y por lo tanto puede no ser perfectamente reproducible.
- El estándar de masa, el kilogramo, no se conoce con precisión, y su valor parece estar cambiando. Por estas razones, existen propuestas para revisar las definiciones tanto de N A como del kilogramo.
Los lunares y sus usos
El mol (mol abreviado) es la medida SI de cantidad de una “entidad química”, que puede ser un átomo, molécula, unidad de fórmula, electrón o fotón. Un topo de cualquier cosa es solo el número de Avogadro de ese algo. O bien, si piensas como abogado, podrías preferir la definición oficial de SI:
El mol es la cantidad de sustancia de un sistema que contiene tantas entidades elementales como átomos hay en 0.012 kilogramo de carbono 12
El número de Avogadro (Ecuación\ ref {3.2.1}) como cualquier número puro, es adimensional. Sin embargo, también define el mol, por lo que también podemos expresar N A como 6.02 × 10 23 mol —1; en esta forma, se le conoce propiamente como constante de Avogadro. Esta construcción enfatiza el papel del número de Avogadro como factor de conversión entre número de moles y número de “entidades”.
¿Cuántos moles de átomos de níquel hay en 80 átomos de níquel?
Solución
\[\dfrac{80 \;atoms}{6.02 \times 10^{23} \; atoms\; mol^{-1}} = 1.33 \times 10^{-22} mol \nonumber\]
¿Esta respuesta es razonable? Sí, porque 80 es una fracción extremadamente pequeña de\(N_A\).
Masa molar
El peso atómico, peso molecular o peso de fórmula de un mol de las unidades fundamentales (átomos, moléculas o grupos de átomos que corresponden a la fórmula de una sustancia pura) es la relación de su masa a 1/12 la masa de un mol de átomos de C 12, y siendo una relación, es adimensional. Pero al mismo tiempo, esta masa molar (como muchos ahora prefieren llamarla) es también la masa observable de un mol (N A) de la sustancia, por lo que frecuentemente enfatizamos esto al declararlo explícitamente como tantos gramos (o kilogramos) por mol: g mol —1.
Es importante tener siempre en cuenta que el mole es un número y no una masa. Pero cada partícula individual tiene una masa propia, por lo que un mol de cualquier sustancia específica siempre corresponderá a cierta masa de esa sustancia.
El bórax es el nombre común de tetraborato de sodio,\(\ce{Na2B4O7}\).
- ¿Cuántos moles de boro están presentes en 20.0 g de bórax?
- ¿Cuántos gramos de boro están presentes en 20.0 g de bórax?
Solución
El peso de la fórmula de\(\ce{Na2B4O7}\) por lo que el peso molecular es:
\[(2 \times 23.0) + (4 \times 10.8) + (7 \times 16.0) = 201.2 \nonumber\]
- 20 g de bórax contienen (20.0 g) ÷ (201 g mol —1) = 0.10 mol de bórax, y así 0.40 mol de B.
- 0.40 mol de boro tiene una masa de (0.40 mol) × (10.8 g mol —1) = 4.3 g.
El pigmento fotosintético vegetal clorofila contiene 2.68 por ciento de magnesio en peso. ¿Cuántos átomos de Mg habrá en 1.00 g de clorofila?
Solución
Cada gramo de clorofila contiene 0.0268 g de Mg, peso atómico 24.3.
- Número de moles en este peso de Mg: (.0268 g)/(24.2 g mol —1) = 0.00110 mol
- Número de átomos: (0.00110 mol) × (6.02E23 mol —1) =\(6.64 \times 10^{20}\)
¿Esta respuesta es razonable? (¡Siempre sospeche de las respuestas de números enormes!) Sí, porque esperaríamos tener un gran número de átomos en cualquier cantidad observable de una sustancia.
Volumen molar
Este es el volumen que ocupa un mol de una sustancia pura. El volumen molar depende de la densidad de una sustancia y, al igual que la densidad, varía con la temperatura debido a la expansión térmica, y también con la presión. Para sólidos y líquidos, estas variables normalmente tienen poco efecto práctico, por lo que los valores citados para 1 atm de presión y 25°C son generalmente útiles en un rango bastante amplio de condiciones. Este definitivamente no es el caso de los gases, cuyos volúmenes molares deben calcularse para una temperatura y presión específicas.
El metanol, CH 3 OH, es un líquido que tiene una densidad de 0.79 g por mililitro. Calcular el volumen molar de metanol.
Solución
El volumen molar será el volumen ocupado por una masa molar (32 g) del líquido. Expresando la densidad en litros en lugar de mL, tenemos
\[V_M = \dfrac{32\; g\; mol^{–1}}{790\; g\; L^{–1}}= 0.0405 \;L \;mol^{–1} \nonumber\]
El volumen molar de un elemento metálico permite estimar el tamaño del átomo. La idea es dividir mentalmente una pieza del metal en tantas cajitas cúbicas como átomos haya, para luego calcular la longitud de cada caja. Suponiendo que un átomo se asienta en el centro de cada caja y que cada átomo está en contacto directo con sus seis vecinos (dos a lo largo de cada dimensión), esto da el diámetro del átomo. La manera en que los átomos se agrupan en cristales metálicos reales suele ser más complicada que esta y varía de metal a metal, por lo que este cálculo sólo proporciona un valor aproximado.
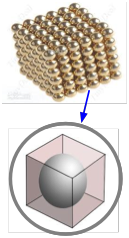
La densidad del estroncio metálico es de 2.60 g cm —3. Utilice este valor para estimar el radio del átomo de Sr, cuyo peso atómico es 87.6.
Solución
El volumen molar de Sr es:
\[\dfrac{87.6 \; g \; mol^{-1}}{2.60\; g\; cm^{-3}} = 33.7\; cm^3\; mol^{–1}\]
El volumen de cada “caja” es”
\[\dfrac{33.7\; cm^3 mol^{–1}} {6.02 \times 10^{23}\; mol^{–1}} = 5.48 \times 10^{-23}\; cm^3\]
La longitud lateral de cada caja será la raíz cúbica de este valor,\(3.79 \times 10^{–8}\; cm\). El radio atómico será la mitad de este valor, o
\[1.9 \times 10^{–8}\; cm = 1.9 \times 10^{–10}\; m = 190 pm\]
Nota: Probablemente tu calculadora no tenga un botón de raíz cúbica, pero se espera que puedas encontrar raíces cúbicas; normalmente puedes usar el botón x y con y =0.333. También debe poder estimar la magnitud de este valor para su comprobación. La forma más fácil es expresar el número para que el exponente sea un múltiplo de 3. Tomemos\(54 \times 10^{-24}\), por ejemplo. Ya que 3 3 =27 y 4 3 = 64, sabes que la raíz cúbica de 55 estará entre 3 y 4, por lo que la raíz cúbica debe ser un poco menor de 4 × 10 —8.
Entonces, ¿qué tan bueno es nuestro radio atómico? Las tablas estándar dan que el radio atómico del estroncio está en el rango 192-220pm.


