4.4: Ecuaciones Químicas y Estequiometría
- Page ID
- 70799
Asegúrese de comprender a fondo las siguientes ideas esenciales
- Dadas las fórmulas de reactivos y productos, escribir una ecuación química equilibrada para la reacción.
- Dadas las solubilidades relativas, escribir una ecuación iónica neta equilibrada para una reacción entre soluciones acuosas de dos compuestos iónicos.
- Escriba los factores de conversión química apropiados para calcular las masas de todos los componentes de una reacción química cuando la masa de un solo componente se especifique en cualquier sistema de unidades. y encontrar las masas de todos los componentes presentes cuando la reacción esté completa.
- Describir la manera en que el concepto de reactivo limitante se relaciona con la combustión y el ejercicio humano.
Una ecuación química expresa el cambio neto en la composición asociado a una reacción química al mostrar el número de moles de reactivos y productos. Pero debido a que cada componente tiene su propia masa molar, las ecuaciones también definen implícitamente la manera en que se relacionan las masas de productos y reactivos. En esta unidad nos concentraremos en comprender y hacer uso de estas relaciones de masas.
En una reacción química, uno o más reactivos se transforman en productos:
reactantes → productos
El propósito de una ecuación química es expresar esta relación en términos de las fórmulas de los reactivos y productos reales que definen un cambio químico particular. Por ejemplo, la reacción del mercurio con el oxígeno para producir óxido mercúrico se expresaría mediante la ecuación
Hg + O 2 → HGo 2
A veces, por conveniencia, es deseable indicar el estado físico (gas, líquido o sólido) de una o más de las especies mediante abreviaturas apropiadas:
Hg (l) + O 2 (g) → HGo 2 (s)
C (grafito) + O 2 (g) → CO 2 (g)
C (diamante) + O 2 (g) → CO 2 (g)
Sin embargo, esto siempre es opcional.
Cómo leer y escribir ecuaciones químicas
Una ecuación química es una declaración de un hecho: expresa el cambio neto que se produce como resultado de una reacción química. Al hacerlo, se debe ser congruente con la ley de conservación de masas:

En el contexto de una reacción química ordinaria, la conservación de la masa significa que los átomos no se crean ni se destruyen. Este requisito se cumple fácilmente asegurándose de que hay números iguales de todos los átomos en ambos lados de la ecuación.
Cuando equilibramos una ecuación, simplemente la hacemos consistente con el hecho observado de que los átomos individuales se conservan en los cambios químicos. No existe una “receta” establecida para equilibrar ecuaciones químicas ordinarias; lo mejor es comenzar por estudiar cuidadosamente ejemplos seleccionados como los que se dan a continuación.
Escribir una ecuación equilibrada para la combustión de propano C 3 H 8 en oxígeno O 2. Los productos son dióxido de carbono CO 2 y agua H 2 O.
Solución
Comience por escribir la ecuación desequilibrada
\[C_3H_8 + O_2 → CO_2 + H_2O \nonumber\]
Por lo general, lo mejor es comenzar equilibrando compuestos que contienen el elemento menos abundante, por lo que primero equilibramos la ecuación para el carbono:
C 3 H 8 + O 2 → 3 CO 2 + H 2 O
Al equilibrar el oxígeno, vemos que no hay forma de que un número par de moléculas de O 2 a la izquierda pueda producir el número desigual de átomos de O que se muestra a la derecha. No te preocupes por esto ahora, solo usa el coeficiente fraccional apropiado:
C 3 H 8 + 3 ½ O 2 → 3 CO 2 + H 2 O
Finalmente, equilibramos los hidrógenos agregando más aguas a la derecha:
C 3 H 8 + 7/2 O 2 → 3 CO 2 + 4 H 2 O
Ah, pero ahora los oxígenos están apagados otra vez —arreglar esto también nos permite deshacernos de la fracción del lado izquierdo:
C 3 H 8 + 5 O 2 → 3 CO 2 + 4 H 2 O
A menudo sucede, sin embargo, que sí terminamos con un coeficiente fraccionario, como en esta variante del ejemplo anterior.
Escribir una ecuación equilibrada para la combustión de etano C 2 H 6 en oxígeno O 2. Los productos son dióxido de carbono CO 2 y agua H 2 O.
Solución
Comience por escribir la ecuación desequilibrada
C 2 H 6 + O 2 → CO 2 + H 2 O
... luego equilibrar el carbono:
C 2 H 6 + O 2 → 2 CO 2 + H 2 O
Vamos a equilibrar el hidrógeno a continuación:
C 2 H 6 + O 2 → 2 CO 2 + 3 H 2 O
... pero ahora necesitamos un número no integral de moléculas de dioxígeno a la izquierda:
C 2 H 6 + 7/2 O 2 → 2 CO 2 + 3 H 2 O
Mi preferencia es simplemente dejarla en esta forma; no hay nada malo con 7/2 = 3 ½ moles de O 2, y poco que ganar multiplicando cada término por dos— no a menos que tu maestro sea un verdadero stickler por hacerlo “por el libro”, en cuyo caso es mejor que escribas
2 C 2 H 6 + 7 O 2 → 4 CO 2 + 6 H 2 O
Ecuaciones Iónicas Neto
Los compuestos iónicos suelen disociarse en solución acuosa; así, si combinamos soluciones de nitrato de plata AgnO 3 y cloruro de sodio NaCl realmente estamos combinando cuatro especies diferentes: los cationes (iones positivos) Ag + y Na + y los aniones ( iones negativos) NO 3 — y Cl —. Ocurre que cuando los iones Ag + y Cl — se juntan, se combinarán para formar un precipitado insoluble de cloruro de plata. La ecuación neta para esta reacción es
\[Ag^+_{(aq)} + Cl^–_{(aq)} → AgCl_{(s)}\]
Tenga en cuenta que
- los iones NO 3 —y Cl — no están directamente involucrados en esta reacción; la ecuación expresa solo el cambio neto, que es la eliminación de los iones plata y cloruro de la solución para formar un sólido insoluble.
- el símbolo (aq) significa que los iones están en solución acuosa y, por lo tanto, están hidratados o unidos a moléculas de agua.
- el símbolo (s) indica que la sustancia AgCl existe como un sólido. Cuando se forma un sólido en una reacción que tiene lugar en solución, se le conoce como precipitado. La formación de un precipitado a menudo se indica por subrayado.
Del ejemplo anterior que involucra cloruro de plata, está claro que una ecuación neta iónica significativa solo puede escribirse si dos iones se combinan para formar un compuesto insoluble. Para hacer esta determinación, ayuda a conocer las reglas de solubilidad —que todos los estudiantes de química fueron obligados a memorizar a la vez, pero hoy en día se obtienen generalmente de tablas como la que se muestra a continuación.
| Anión (ion negativo) | Catión (ion positivo) | ¿Soluble? |
|---|---|---|
| cualquier anión | iones de metales alcalinos (Li +, Na +, K +, etc.) |
si
|
| nitrato, NO 3 — | cualquier catión |
si
|
| acetato, CH 3 COO — | cualquier catión excepto Ag + |
si
|
| iones haluro Cl —, Br — o I — | Ag +, Pb 2 +, Hg 2 2 +, Cu 2 + |
no
|
| iones haluro Cl —, Br — o I — | cualquier otro catión |
si
|
| sulfato, SO 4 2— | Ca 2 +, Sr 2 +, Ba 2 +, Ag +, Pb 2 + |
no
|
| sulfato, SO 4 2— | cualquier otro catión |
si
|
| sulfuro, S 2 — | iones de metales alcalinos o NH 4 + |
si
|
| sulfuro, S 2 — | Ser 2 +, Mg 2 +, Ca 2 +, Sr 2 +, Ba 2 +, Ra 2 + |
si
|
| sulfuro, S 2 — | cualquier otro catión |
no
|
| hidróxido, OH — | iones de metales alcalinos o NH 4 + |
si
|
| hidróxido, OH — | Sr 2 +, Ba 2 +, Ra 2 + |
ligeramente
|
| hidróxido, OH — | cualquier otro catión |
no
|
| fosfato, PO 4 3—, carbonato CO 3 2— | iones de metales alcalinos o NH 4 + |
si
|
| fosfato, PO 4 3—, carbonato CO 3 2— | cualquier otro catión |
no
|
Escriba ecuaciones iónicas netas para lo que sucede cuando se combinan soluciones acuosas de las siguientes sales:
- PbCl 2 + K 2 SO 4
- K 2 CO 3 + Sr (NO 3) 2
- AlCl 3 + CaSO 4
- Na 3 PO 4 + CaCl 2
Utilice la tabla de reglas de solubilidad (arriba) para encontrar las combinaciones insolubles:
- Pb 2 + (aq) + SO 4 2— (aq) → PbSO 4 (s)
- Sr 2 + (aq) + CO 3 2— (aq) → SrCo 3 (s)
- sin reacción neta
- 3 Ca 2 + (aq) + 2 PO 4 3— (aq) → 3 Ca 3 (PO 4) 2 (s)
Tenga en cuenta la necesidad de equilibrar las cargas eléctricas
Relaciones de Masas en Ecuaciones Químicas
Una ecuación química equilibrada expresa el número relativo de moles de cada componente (producto o reactivo), pero debido a que cada fórmula en la ecuación implica una masa definida de la sustancia (su masa molar), la ecuación también implica que existen ciertas relaciones de peso entre los componentes. Por ejemplo, la ecuación que describe la combustión de monóxido de carbono a dióxido de carbono
\[2 CO + O_2 → 2 CO_2\]
implica las siguientes relaciones:
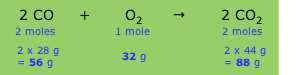
Las masas relativas mostradas en la línea de fondo establecen la estequiometría de la reacción, es decir, las relaciones entre las masas de los diversos componentes. Dado que estas masas varían en proporción directa entre sí, podemos definir qué equivale a un factor de conversión (a veces denominado factor químico) que relaciona la masa de cualquier componente con la de cualquier otro componente.
Evaluar el factor químico y el factor de conversión que relaciona la masa de dióxido de carbono con la del CO consumido en la reacción.
Solución
Del cuadro anterior, la relación másica de CO 2 a CO en esta reacción es 88/56 = 1.57; este es el factor químico para la conversión de CO en CO 2. El factor de conversión es solo 1.57/1 con las unidades de masa explícitamente declaradas:
\[\dfrac{1.57\; g\; CO_2}{ 1\; g\; CO} = 1\]
- ¿Cuántas toneladas de CO 2 se pueden obtener de la combustión de 10 toneladas de CO?
- ¿Cuántos kg de CO deben quemarse para producir 20 kg de CO 2?
Soluciones
- (1.57 T CO 2/1 T CO) × (10 T CO) = 15.7 T CO 2
- Observe la respuesta a esta debe referirse al monóxido de carbono, no al CO 2, por lo que escribimos el factor de conversión a la inversa:
(1 kg CO/1.57 kg CO 2) × (20 kg CO 2) = (20/1.57) g CO = 12.7 kg CO.
¿Esta respuesta es razonable? Sí, porque la masa de CO siempre debe ser menor que la del CO 2 en esta reacción.
Más problemas de masa y masa
No esperes pasar Química a menos que puedas manejar problemas como los de abajo; aparecen frecuentemente en todo tipo de contextos.
El mineral FeS 2 se puede convertir en el importante químico industrial ácido sulfúrico H 2 SO 4 mediante una serie de procesos. Suponiendo que la conversión es completa, ¿cuántos litros de ácido sulfúrico (densidad 1.86 kg L —1) se pueden hacer a partir de 50 kg de mineral?
Solución
Como ocurre con la mayoría de los problemas, esto se descompone en varios más simples. Comenzamos por elaborar la estequiometría en el supuesto de que todo el azufre en el o termina como H 2 SO 4, permitiéndonos escribir
FeS 2 → 2 H 2 SO 4
está equilibrado con respecto a los dos componentes de interés, y esto es todo lo que necesitamos aquí. Las masas molares de los dos componentes son 120.0 y 98 g mol —1, respectivamente, por lo que la ecuación puede interpretarse en términos de masas como[120 unidades de masa] FeS 2 → [2 × 98 unidades de masa] H 2 SO 4
Así 50 kg de mineral rendirán (50 kg) × (196/120) = 81.7 kg de producto.
[Comprobar: ¿esta respuesta es razonable? Sí, porque el factor (196/120) es cercano a (200/120) = 5/3, por lo que la masa del producto debe ser ligeramente menor que el doble de la masa de mineral consumido.]
De la información de densidad encontramos que el volumen de líquido H 2 SO 4 es
(81.7 kg) ÷ (1.86 kg L —1) = 43,9 L
[Comprobar: ¿esta respuesta es razonable? Sí, porque la densidad nos dice que el número de litros de ácido será ligeramente superior a la mitad de su peso.]
El cloruro de bario forma un hidrato cristalino, BaCl 2 ·xH 2 O, en el que se incorporan x moléculas de agua al sólido cristalino por cada unidad de BaCl 2. Esta agua puede ser expulsada por el calor; si 1.10 g de la sal hidratada se calientan y se vuelven a pesar varias veces hasta que no se produzca más pérdida de peso (es decir, pérdida de agua), el peso final de la muestra es 0.937 g. ¿Cuál es el valor de x en la fórmula del hidrato?
Solución
El primer paso es encontrar el número de moles de BacL 2 (peso molecular 208.2) a partir de la masa de la muestra deshidratada.
(0.937 g)/(208.2 g mol —1) = 0.00450 mol
Ahora encuentra los moles de H 2 O (peso molecular 18) perdidos al secarse la muestra:
(1.10 — .937) g/(18 g mol —1) = .00905 mol
Al permitir una cantidad razonable de error de medición, es evidente que la relación molar de BacL 2:H2O = 1:2. La fórmula del hidrato es BacL 2 ·2H 2 O.
Reactivos limitantes
La mayoría de las reacciones químicas que tienen lugar en el mundo real comienzan con cantidades más o menos arbitrarias de los diversos reactivos; generalmente tenemos que hacer un esfuerzo especial si queremos asegurar que se combinen las cantidades estequiométricas de los reactivos. Esto significa que uno o más reactivos generalmente estarán presentes en exceso; habrá más presentes de los que pueden reaccionar, y algunos permanecerán después de que termine la reacción. Al mismo tiempo, un reactivo se agotará completamente; a esto lo llamamos el reactivo limitante porque la cantidad de esta sustancia presente controlará, o limitará, las cantidades de los demás reactivos que se consumen así como las cantidades de productos producidos.
Los problemas limitantes de los reactivos se manejan de la misma manera que los problemas de estequiometría ordinarios con un paso preliminar adicional: primero se debe determinar cuál de los reactivos es limitante, es decir, cuál se agotará por completo. Para empezar, considera el siguiente ejemplo muy sencillo
Para la reacción hipotética 3 A + 4 B → [productos], determinar qué reactivo se consumirá por completo cuando combinemos
- cantidades equimolares de A y B;
- 0.57 mol de A y 0.68 mol de B.
Solución
a) La simple inspección de la ecuación muestra claramente que se requieren más moles de B, por lo que este componente se consumirá (y es así el reactivo limitante), dejando atrás ¾ tantos moles de A.
b) ¿Cuántos moles de B reaccionarán con .57 mol de A? La respuesta será
(4/3 × 0.57 mol). Si esto llega a menos de 0.68 mol, entonces B será el reactivo limitante, y se debe continuar con el problema en base a la cantidad de B presente. Si el reactivo limitante es A, entonces todos los 0.57 moles de A reaccionarán, dejando algo del B en exceso. ¡Entérate!
El azufre y el cobre, cuando se calientan juntos, reaccionan para formar sulfuro de cobre (I), Cu 2 S. ¿Cuántos gramos de Cu 2 S se pueden hacer a partir de 10 g de azufre y 15 g de cobre?
Solución
A partir de los pesos atómicos de Cu (63.55) y S (32.06) podemos interpretar la reacción he 2 Cu + S → Cu 2 S como
[2 × 63.55 = 127.1 unidades de masa] Cu + [32.06 unidades de masa] S
→ [159.2 unidades de masa] Cu 2 S
Así 10 g de S requerirán
(10 g S) × (127.1 g Cu)/(32.06 g S) = 39.6 g Cu
... que es mucho más de lo que hay disponible, así que el cobre es el reactivo limitante aquí.
[Comprobar: ¿esta respuesta es razonable? Sí, porque el factor químico (127/32) funciona a aproximadamente 4, lo que indica que el azufre reacciona con aproximadamente cuatro veces su peso de cobre.]
La masa de sulfuro de cobre formada estará determinada por la masa de cobre disponible:
(15 g Cu) × (159.2 g Cu 2 S)/(127.1 g Cu) = 18.8 g Cu 2 S
[Comprobar: ¿esta respuesta es razonable? Sí, porque el factor químico (159.2/127.1) es apenas un poco mayor que la unidad, lo que indica que la masa del producto superará ligeramente a la del cobre consumido.]
El concepto de reactivos limitantes nos toca a todos en nuestra vida cotidiana — y como mostraremos en el segundo ejemplo a continuación, ¡incluso en el mantenimiento de la vida misma!
Relaciones aire-combustible en la combustión
La combustión es un proceso exotérmico en el que un combustible se combina con oxígeno; la combustión completa de un combustible hidrocarbonado como el metano o la gasolina produce dióxido de carbono y agua:
CH 4 + 2 O 2 → CO 2 + 2 H 2 O (g)
Calcular la relación másica de CH 4 a O 2 requerida para la combustión completa.
Solución
Esta es solo la relación de la masa molar de CH 4 (16 g) a la de dos moles de dioxígeno (2 x 32 g)
Así (64 g)/(16 g) = 4/1 = 4.0.

La combustión incompleta es generalmente indeseable porque desperdicia combustible, produce menos calor y libera contaminantes como el hollín de carbono. Los procesos de combustión que producen energía siempre deben operar en modo de combustible limitado.
En los procesos de combustión ordinarios, la fuente de oxígeno es el aire. Debido a que solo alrededor del 20 por ciento de las moléculas en el aire seco consisten en O 2, el volumen de aire que debe suministrarse es cinco veces mayor de lo que se requeriría para O 2 puro. El cálculo de la relación de masa aire-combustible (“relación A/F”) empleada por los ingenieros de combustión se complica por las diferentes masas molares de dioxígeno y aire. Para la combustión de metano, la relación A/F funciona a aproximadamente 17.2Se dice que las relaciones A/F que exceden los valores estequiométricos son pobres, mientras que aquellas en las que el aire se convierte en el componente limitante se caracterizan como ricas. Para asegurar una combustión completa, es una práctica común mantener una mezcla ligeramente magra. Las cantidades del llamado exceso de aire comúnmente admitidas en los quemadores varían de 5-10% para el gas natural a hasta 100% para ciertos grados de carbón.
Para los motores de combustión interna alimentados con gasolina (aproximadamente equivalente a C 7 H 14), la relación A/F estequiométrica es de 15:1. Sin embargo, las consideraciones prácticas requieren diferentes relaciones en varias etapas de operación. Los valores típicos varían desde una relación rica para el arranque o la aceleración hasta relaciones ligeramente magras para la conducción normal. Estas relaciones las establece el carburador, con control adicional por la computadora del motor y el sensor de oxígeno de la línea de salida en vehículos modernos, o por un estrangulador manual en los anteriores.
Respiración aeróbica y anaerobia
Nuestros cuerpos requieren un suministro continuo de energía para mantener la actividad neuronal, sintetizar proteínas y otros componentes bioquímicos esenciales, reemplazar las células y potenciar la acción muscular. El “combustible” —el portador de la energía química— la glucosa, un azúcar simple que se libera según sea necesario del glucógeno polimérico similar al almidonado, la forma en que se almacena la energía que obtenemos de los alimentos. La sangre arterial transporta la glucosa disuelta junto con el dioxígeno unido a hemoglobina a las células individuales que son los sitios de “combustión” de glucosa:
\[C_6H_{12}O_6 + 6 O_2 → 6 CO_2 + 6 H_2O\]
La reacción neta y la cantidad de energía liberada son las mismas que si la glucosa se quemara al aire libre, pero dentro de las células la reacción procede en una serie de pequeños pasos que capturan la mayor parte de esta energía para el uso del cuerpo, liberando solo una pequeña fracción de la misma como energía térmica (calor). Debido a que este proceso utiliza oxígeno del aire que respiramos, se le conoce como respiración aeróbica. Y como con cualquier proceso de combustión eficiente, la glucosa es el reactivo limitante aquí.
Sin embargo, hay momentos en que la actividad física vigorosa hace que los músculos consuman glucosa a un ritmo que excede la capacidad de la sangre para entregar la cantidad requerida de oxígeno. En estas condiciones, la respiración celular cambia a un modo anaeróbico alternativo:
\[C_6H_{12}O_6 → 2 CH_3CH(OH)COOH\]
Como se puede ver en esta ecuación, la glucosa sólo se descompone parcialmente (en ácido láctico), y así solo una parte de su energía química es capturada por el cuerpo. Existen numerosos beneficios para la salud del ejercicio aeróbico, incluida una mayor capacidad del cuerpo para mantener una condición aeróbica. Pero si te gusta correr a corta distancia (correr corriendo) o ser perseguido por un tigre, la menor eficiencia del ejercicio anaeróbico puede ser un pequeño precio a pagar.


