4.3: Las fórmulas y su significado
- Page ID
- 70808
Asegúrese de comprender a fondo los siguientes conceptos esenciales que se han presentado anteriormente.
- Explique por qué el símbolo de un elemento a menudo difiere de la fórmula del elemento..
- Definir un ion, y explicar el significado de su fórmula.
- Encuentra la fórmula más simple (“empírica”) de una sustancia a partir de una fórmula molecular más compleja. Explicar el significado de la fórmula de un sólido iónico como el NaCl.
- Defina el peso molecular, el peso de la fórmula y la masa molar. Calcula cualquiera de estos a partir de cualquier fórmula química.
- Dada una fórmula química, expresar las relaciones molares de dos elementos cualesquiera, o la fracción molar de uno de sus elementos.
- Encuentra la composición porcentual de un compuesto a partir de su fórmula.
- Calcular la relación de masa de dos elementos cualesquiera presentes en un compuesto a partir de su fórmula.
- Encuentra la fórmula empírica de un compuesto binario a partir de la relación molar de sus dos elementos, expresada como un número decimal.
- Encuentra la fórmula empírica de un compuesto binario a partir de la relación de masa de sus dos elementos.
- Encontrar la fórmula empírica de un compuesto a partir de su composición en masa o porcentaje.
En el corazón de la química se encuentran las sustancias —elementos o compuestos— que tienen una composición definida que se expresa mediante una fórmula química. En esta unidad aprenderás a escribir e interpretar fórmulas químicas tanto en términos de moles como de masas, y a ir en sentido inverso, en la que utilizamos información experimental sobre la composición de un compuesto para elaborar una fórmula.
La fórmula de un compuesto especifica el número de cada tipo de átomo presente en una unidad molecular de un compuesto. Dado que cada sustancia química única tiene una composición definida, cada sustancia debe ser descriptible por una fórmula química.
El conocido alcohol etanol está compuesto por moléculas que contienen dos átomos de carbono, cinco átomos de hidrógeno y un átomo de oxígeno. ¿Cuál es su fórmula molecular?
Solución
Simplemente escriba el símbolo de cada elemento, siguiendo por un subíndice que indique el número de átomos si hay más de uno presente. Así: C 2 H 5 O
Tenga en cuenta que:
- El número de átomos de cada elemento en una fórmula molecular se escribe como un subíndice;
- Cuando solo está presente un solo átomo de un elemento en una fórmula molecular, se omite el subíndice.
- En el caso de compuestos orgánicos (que contienen carbono), se acostumbra colocar los símbolos de los elementos C, H, (y si están presentes,) O, N en este orden en la fórmula.
Fórmulas de Elementos e Iones
El símbolo de un elemento es la combinación de una o dos letras que representa el átomo de un elemento en particular, como Au (oro) u O (oxígeno). El símbolo se puede utilizar como abreviatura para el nombre de un elemento (¡es más fácil escribir “Mb” en lugar de “molibdeno”!) En un uso químico más formal, un símbolo de elemento también puede representar un átomo, o, dependiendo del contexto, por un mol de átomos del elemento.
Algunos de los elementos no metálicos existen en forma de moléculas que contienen dos o más átomos del elemento. Estas moléculas se describen mediante fórmulas como N 2, S 6 y P 4. Algunos de estos elementos pueden formar más de un tipo de molécula; el ejemplo más conocido de esto es el oxígeno, que puede existir como O 2 (la forma común que compone el 21% de las moléculas en el aire), y también como O 3, una molécula inestable y altamente reactiva conocida como ozono. Las moléculas de carbono en forma de bola de fútbol a veces llamadas buckyballs tienen la fórmula C 60.
Alótropos
Diferentes formas moleculares del mismo elemento (como\(\ce{O_2}\) y\(\ce{O_3})\) se llaman alótropos.
Los iones son átomos o moléculas que llevan una carga eléctrica. Estas cargas se representan como superíndices en las fórmulas iónicas. Por lo tanto:
| \(\ce{Cl^{-}}\) | el ion cloruro, con una carga negativa por átomo |
| \(\ce{S^{2-}}\) | el ion sulfuro lleva dos cargas negativas |
| \(\ce{HCO3^{2–}}\) | el ion carbonato— un ion molecular |
| \(\ce{NH4^{+}}\) | el ión amonio |
Tenga en cuenta que el número de cargas (en unidades de la carga electrónica) siempre debe preceder al signo positivo o negativo, pero este número se omite cuando la carga es ±1.
Fórmulas de sólidos extendidos
En CdCl 2 sólido, los átomos de Cl y Cd se organizan en láminas que se extienden indefinidamente. Cada átomo está rodeado por seis átomos del tipo opuesto, por lo que se puede seleccionar arbitrariamente cualquier Cl—Cd-Cl como la “unidad molecular”. Una de esas unidades de CdCl 2 está indicada por los dos enlaces de color rojo en el diagrama, pero no constituye una “molécula” discreta de CdCl 2.
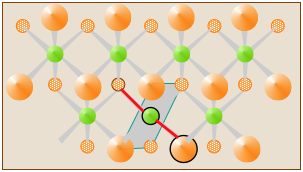
Muchos sólidos aparentemente “simples” existen solo como sólidos iónicos (como NaCl) o como sólidos extendidos (como CuCl 2) en los que no se pueden identificar moléculas discretas. Las fórmulas que escribimos para estos compuestos simplemente expresan números relativos de los diferentes tipos de átomos en el compuesto en los números enteros más pequeños posibles. Estas son idénticas a las fórmulas empíricas o “más simples” que discutimos más adelante.
Muchos minerales y la mayoría de las rocas contienen proporciones variables de ciertos elementos y solo se pueden caracterizar con precisión a nivel estructural. Debido a que estas no suelen ser sustancias puras, las “fórmulas” convencionalmente utilizadas para describirlas tienen significados limitados. Por ejemplo el olivino de roca común, que puede considerarse una solución sólida de Mg 2 SiO 4 y Fe 2 SiO 4, puede representarse por (Mg, Fe) 2 SiO 4. Esto implica que la relación de los metales a SiO 4 es constante, y que el magnesio suele estar presente en mayor cantidad que el hierro.
Fórmulas empíricas
Las fórmulas empíricas dan los números relativos de los diferentes elementos en una muestra de un compuesto, expresados en los números enteros más pequeños posibles. El término empírico se refiere al hecho de que fórmulas de este tipo se determinan experimentalmente; tales fórmulas también se conocen comúnmente como fórmulas empíricas.
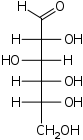
La glucosa (el “combustible” con el que corre tu cuerpo) está compuesta por unidades moleculares que tienen la fórmula C 6 H 12 O 6. ¿Cuál es la fórmula empírica de la glucosa?
Solución
La molécula de glucosa contiene el doble de átomos de hidrógeno que carbonos u oxígenos, por lo que dividimos entre 6 para obtener CH 2 O.
Nota: esta fórmula empírica, que se aplica a todos los azúcares de 6 carbonos, indica que estos compuestos están “compuestos” de carbono y agua, lo que explica por qué los azúcares se conocen como carbohidratos.
Algunos compuestos sólidos no existen como unidades moleculares discretas, sino que se construyen como redes extendidas de átomos o iones bidimensionales o tridimensionales. Las composiciones de tales compuestos se describen comúnmente por sus fórmulas empíricas. En el caso muy común de los sólidos iónicos, dicha fórmula también expresa los números mínimos de iones positivos y negativos requeridos para producir una unidad eléctricamente neutra, como en NaCl o CuCl 2.
- Escribir la fórmula del bromuro férrico, dado que el ion férrico (hierro-III) es Fe 3 + y el ion bromuro lleva una sola carga negativa.
- Escribe la fórmula del sulfuro de bismuto, formado cuando se combinan los iones Bi 3 + y S 2—.
Solución:
- Se requieren tres iones Br — para equilibrar las tres cargas positivas de Fe 3 +, de ahí la fórmula FeBr 3.
- La única manera de obtener números iguales de cargas opuestas es tener seis de cada una, por lo que la fórmula será Bi 2 S 3.
Qué fórmulas no nos dicen
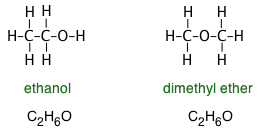
Las fórmulas que normalmente escribimos no transmiten información sobre la estructura del compuesto, es decir, el orden en el que los átomos están conectados por enlaces químicos o están dispuestos en el espacio tridimensional. Esta limitación es especialmente significativa en compuestos orgánicos, en los que cientos si no miles de moléculas diferentes pueden compartir la misma fórmula empírica. Por ejemplo, tanto el etanol como el éter dimetílico tienen la fórmula empírica C 2 H 6 O, sin embargo las fórmulas estructurales revelan la naturaleza muy diferente de estas dos moléculas:
Fórmulas Más Complejas
A menudo es útil escribir fórmulas de tal manera que transmitan al menos alguna información sobre la estructura de un compuesto. Por ejemplo, la fórmula del sólido (NH 4) 2 CO 3 es inmediatamente identificable como carbonato de amonio, y esencialmente un compuesto de iones amonio y carbonato en una relación 2:1, mientras que la fórmula más simple o empírica N 2 H 8 El CO 3 oscurece esta información.
De igual manera, la distinción entre etanol y éter dimetílico se puede hacer escribiendo las fórmulas como C 2 H 5 OH y CH 3 —O—CH 3, respectivamente. Aunque ninguna de estas fórmulas especifica las estructuras con precisión, cualquiera que haya estudiado química orgánica puede trabajarlas, e inmediatamente reconocerá el grupo —OH (hidroxilo) que es la característica definitoria de la gran clase de compuestos orgánicos conocidos como alcoholes. El átomo —O— que une dos carbonos es de manera similar la característica definitoria de los éteres.
Se utilizan varios términos relacionados para expresar la masa de un mol de una sustancia.
- Peso molecular: Esto es análogo al peso atómico: es el peso relativo de una unidad de fórmula del compuesto, basado en la escala carbono-12. El peso molecular se encuentra añadiendo pesos atómicos de todos los átomos presentes en la unidad de fórmula. Los pesos moleculares, como los pesos atómicos, son adimensionales; es decir, no tienen unidades.
- Peso de la fórmula: Lo mismo que el peso molecular. Este término se usa a veces en conexión con sólidos iónicos y otras sustancias en las que no existen moléculas discretas.
- Masa molar: La masa (en gramos, kilogramos, o cualquier otra unidad) de un mol de partículas o unidades de fórmula. Cuando se expresa en gramos, la masa molar es numéricamente igual que el peso molecular, pero debe ir acompañada de la unidad de masa.
- Calcular el peso de fórmula del cloruro de cobre (II),\(\ce{CuCl2}\).
- ¿Cómo expresarías esta misma cantidad que una masa molar?
Solución
- Los pesos atómicos de Cu y Cl son, respectivamente 63.55 y 35.45; la suma de cada peso atómico, multiplicada por los números de cada tipo de átomo en la unidad de fórmula, produce:\[ 63.55 + 2(25.35) = 134.45.\]
- Las masas de un mol de átomos de Cu y Cl son, respectivamente, 63.55 g y 35.45 g; la masa de un mol de CuCl 2 unidades es:\[(63.55 g) + 2(25.35 g) =134.45 g.\]
Interpretación de fórmulas en términos de relaciones molares y fracciones molares
La información contenida en las fórmulas se puede usar para comparar las composiciones de compuestos relacionados como en el siguiente ejemplo:
La relación de hidrógeno a carbono suele ser de interés para comparar diferentes combustibles. Calcular estas relaciones para metanol (CH 3 OH) y etanol (C 2 H 5 OH).
Solución
Las relaciones H:C para los dos alcoholes son 4:1 = 4.0 para el metanol y 6:2 (3.0) para el etanol.
Alternativamente, a veces se usan fracciones molares para expresar lo mismo. La fracción molar de un elemento M en un compuesto es solo el número de átomos de M dividido por el número total de átomos en la unidad de fórmula.
Calcular la fracción molar y el porcentaje molar de carbono en etanol (C 2 H 5 OH).
Solución
La unidad de fórmula contiene nueve átomos, dos de los cuales son carbono. La fracción molar de carbono en el compuesto es 2/9 = .22. Así, el 22 por ciento de los átomos en el etanol son carbono.
Interpretación de fórmulas en términos de masas de los elementos
Dado que la fórmula de un compuesto expresa la proporción de los números de sus átomos constituyentes, una fórmula también transmite información sobre las masas relativas de los elementos que contiene. Pero para poder hacer esta conexión, necesitamos conocer las masas relativas de los diferentes elementos.
Encuentra las masas de carbono, hidrógeno y oxígeno en un mol de etanol (C 2 H 5 OH).
Solución
Usando los pesos atómicos (masas molares) de estos tres elementos, tenemos
- carbono: (2 mol) (12.0 g mol —1) = 24 g de C
- hidrógeno: (6 mol) (1.01 g mol —1) = 6 g de H
- oxígeno: (1 mol) (16.0 g mol —1) = 16 g de O
La fracción de masa de un elemento en un compuesto es solo la relación entre la masa de ese elemento y la masa de toda la unidad de fórmula. Las fracciones de masa siempre están entre 0 y 1, pero frecuentemente se expresan como porcentaje.
Encontrar la fracción de masa y el porcentaje de masa de oxígeno en etanol (C 2 H 5 OH)
Solución
Utilizando la información desarrollada en el ejemplo anterior, la masa molar de etanol es (24 + 6 + 16) g mol —1 = 46 g mol —1. De esto, 16 g se deben al oxígeno, por lo que su fracción de masa en el compuesto es (16 g)/(46 g) = 0.35 lo que corresponde a 35%.
Encontrar la composición porcentual de un compuesto a partir de su fórmula es un cálculo fundamental que debes dominar; la técnica es exactamente como se muestra arriba. Encontrar una fracción de masa suele ser el primer paso para resolver tipos de problemas relacionados:
¿Cuántas toneladas de potasio están contenidas en 10 toneladas de KCl?
Solución
La fracción de masa de K en KCl es 39.1/74.6=.524; 10 toneladas de KCl contienen (39.1/74.6) × 10 toneladas de K, o 5.24 toneladas de K. (Pesos atómicos: K = 39.1, Cl = 35.5.)
Tenga en cuenta que no hay necesidad de lidiar explícitamente con los moles, lo que requeriría convertir toneladas a kg.
¿Cuántos gramos de KCl contendrán 10 g de potasio?
Solución
La relación másica de KCl/k es de 74.6 ÷ 39.1; 10 g de potasio estarán presentes en (74.6/39.1) × 10 gramos de KCl, o 19 gramos.
Las relaciones másicas de dos elementos en un compuesto se pueden encontrar directamente a partir de las relaciones molares que se expresan en fórmulas.
El cloruro de magnesio fundido (MgCl 2) se puede descomponer en sus elementos pasando una corriente eléctrica a través de él. ¿Cuántos kg de cloro se liberarán cuando se formen 2.5 kg de magnesio? (Mg = 24.3, Cl = 35.5)
Solución
La relación másica de Cl/Mg es (35.5 ×2) /24.3, o 2.9; así se producirán 2.9 kg de cloro por cada kg de Mg, o (2.9 × 2.5) = 7.2 kg de cloro por 2.5 kg de Mg. (Tenga en cuenta que no es necesario conocer la fórmula del cloro elemental (Cl 2) para resolver este problema.)
Fórmulas empíricas a partir de datos experimentales
Como se explicó anteriormente, la fórmula empírica (fórmula empírica) es aquella en la que los números relativos de los diversos elementos se expresan en los números enteros más pequeños posibles. El cloruro de aluminio, por ejemplo, existe en forma de unidades estructurales que tienen la composición Al 2 Cl 6; la fórmula empírica de esta sustancia es AlCl 3. Algunos métodos de análisis proporcionan información sobre los números relativos de los diferentes tipos de átomos en un compuesto. El proceso de encontrar la fórmula de un compuesto a partir de un análisis de su composición depende de su capacidad para reconocer los equivalentes decimales de las proporciones enteras comunes como 2:3, 3:2, 4:5, etc.
El análisis de un compuesto de aluminio mostró que 1.7 mol de Al se combina con 5.1 mol de cloro. Escribe la fórmula empírica de este compuesto.
Solución
La fórmula Al 1.7 Cl 5.1 expresa los números relativos de moles de los dos elementos en el compuesto. Se puede convertir en la fórmula empírica dividiendo ambos subíndices por el más pequeño, produciendo AlCl 3.
Más comúnmente, se encuentra que una masa arbitraria de un compuesto contiene ciertas masas de sus elementos. Estos deben ser convertidos en moles para poder encontrar la fórmula.
En un experimento de laboratorio estudiantil, se encontró que 0.5684 g de magnesio se quema en el aire para formar 0.9426 g de óxido de magnesio. Encuentra la fórmula empírica de este compuesto. Pesos atómicos: Mg = 24.305, O=16.00.
Solución
Expresar esta relación como 0.375 g de C a 1.00 g de O.
- moles de carbono: (.375 g)/(12 g/mol) = 0.03125 mol C;
- moles de oxígeno: (1.00 g)/(16 g/mol) = 0.0625 mol O
- relación molar de C/O = 0.03125/0.0625 = 0.5;
esto corresponde a la fórmula C 0.5 O, que expresamos en números enteros como CO 2.
Se encontró que una muestra de 4.67 g de un compuesto de aluminio contenía 0.945 g de Al y 3.72 g de Cl. Encuentra la fórmula empírica de este compuesto. Pesos atómicos: Al = 27.0, Cl=35.45.
SoluciónLa muestra contiene (0.945 g)/(27.0 g mol —1) = .035 mol de aluminio y (3.72 g) (35.45) = 0.105 mol de cloro. La fórmula Al .035 Cl .105 expresa los números relativos de moles de los dos elementos en el compuesto. Se puede convertir en la fórmula empírica dividiendo ambos subíndices por el más pequeño, produciendo AlCl 3.
La composición de un compuesto binario (de dos elementos) a veces se expresa como una relación de masa. El enfoque más fácil aquí es tratar los números que expresan la relación como masas, convirtiendo así el problema en el tipo descrito inmediatamente antes.
Un compuesto compuesto solo por carbono y oxígeno contiene estos dos elementos en una relación másica C:H de 0.375. Encuentra la fórmula empírica.
Solución
Expresar esta relación como 0.375 g de C a 1.00 g de O.
- moles de carbono: (.375 g)/(12 g/mol) = .03125 mol C;
- moles de oxígeno: (1.00 g)/(16 g/mol) = .0625 mol O
- relación molar de C/O = .03125/.0625 = 0.5;
esto corresponde a la fórmula C 0.5 O, que expresamos en números enteros como CO 2.
La composición por masa de un compuesto se expresa más comúnmente como porcentaje en peso (gramos por 100 gramos de compuesto). El primer paso es de nuevo convertirlos a números relativos de moles de cada elemento en una masa fija del compuesto. Aunque esta masa fija es completamente arbitraria (¡no hay nada especial alrededor de 100 gramos!) , las proporciones de las cantidades molares de los diversos elementos no son arbitrarias: estas relaciones deben ser expresables como números enteros, ya que representan proporciones de números integrales de átomos.
Encuentre la fórmula empírica de un compuesto que tenga la siguiente composición porcentual en masa. Los pesos atómicos se dan entre paréntesis: 36.4% Mn (54.9), 21.2% S (32.06), 42.4% O (16.0)
Solución100 g de este compuesto contienen:
- Mn: (36.4 g)/(54.9 g mol —1) = 0.663 mol
- S: (21.2 g)/(32.06 g mol —1) = 0.660 mol
- O: (42.4 g)/(16.0 g mol —1) = 2.65 mol
La fórmula Mn .663 S .660 O 2.65 expresa los números relativos de moles de los tres elementos en el compuesto. Se puede convertir en la fórmula empírica dividiendo todos los subíndices por el más pequeño, produciendo Mn 1.00 S 1.00 O 4.01 que escribimos como MnSO 4.
Nota: debido a que las masas determinadas experimentalmente están sujetas a pequeños errores, generalmente es necesario descuidar pequeñas desviaciones de los valores enteros.
Encuentre la fórmula empírica de un compuesto que tenga la siguiente composición porcentual en masa. Los pesos atómicos se dan entre paréntesis: 27.6% Mn (54.9), 24.2% S (32.06), 48.2% O (16.0).
Solución
Una fórmula preliminar basada en 100 g de este compuesto se puede escribir como
o
Mn .503 S .754 O 3.01
Dividir por el subíndice más pequeño produce Mn 1 S 1.5 O 6. La inspección de esta fórmula sugiere que multiplicar cada subíndice por 2 produce la fórmula entera Mn 2 S 3 O 12.
Apuntes sobre métodos experimentales
Una de las operaciones más fundamentales en química consiste en descomponer un compuesto en sus elementos (proceso conocido como análisis) y luego determinar la fórmula empírica a partir de las cantidades relativas de cada tipo de átomo presente en el compuesto. En muy pocos casos es práctico llevar a cabo dicho proceso directamente: así calentar sulfuro de mercurio (II) resulta en su descomposición directa:
\[\ce{2 HgS -> 2Hg + O2}.\]
De igual manera, la electrólisis del agua produce los gases H 2 y O 2 en una relación volumétrica 2:1.
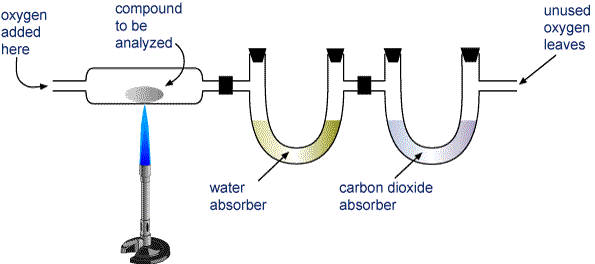
Sin embargo, la mayoría de los análisis elementales deben realizarse indirectamente. El más utilizado de estos métodos ha sido tradicionalmente el análisis de combustión de compuestos orgánicos. Un hidrocarburo desconocido C a H b O c puede caracterizarse calentándolo en una corriente de oxígeno para que se descomponga completamente en CO 2 gaseoso y H 2 O. Estos gases se hacen pasar a través de tubos que contienen sustancias que absorben cada gas selectivamente. Al pesar cuidadosamente cada tubo antes y después del proceso de combustión, se pueden calcular los valores de a y b para carbono e hidrógeno, respectivamente. El subíndice c para oxígeno se encuentra restando las masas calculadas de carbono e hidrógeno de las de la muestra original.
Desde la década de 1970, ha sido posible realizar análisis de combustión con equipos automatizados. Este también puede determinar nitrógeno y azufre:
Las mediciones de masa o peso han sido durante mucho tiempo la principal herramienta para comprender el cambio químico de manera cuantitativa. Las balanzas y básculas de pesaje han estado en uso con fines comerciales y farmacéuticos desde el inicio de la historia registrada, pero estos dispositivos carecían de la precisión de 0.001-g requerida para la química cuantitativa y el análisis elemental realizado a escala de laboratorio.
No fue hasta mediados del siglo XVIII que el químico escocés Joseph Black inventó la balanza analítica de igual brazo. La característica clave de esta invención fue una viga ligera y rígida soportada sobre un punto de apoyo con filo de cuchilla; bordes de cuchilla adicionales apoyaron las bandejas de pesaje. Los bordes de las navajas redujeron en gran medida la fricción que limitaba la sensibilidad de los diseños anteriores; no es casualidad que las medidas precisas de combinación de pesos y pesos atómicos comenzaron aproximadamente en este momento.
Las balanzas analíticas están encerradas en una caja de vidrio para evitar la interferencia de las corrientes de aire, y los pesos calibrados se manejan con fórceps para evitar la adsorción de humedad o aceites de los dedos desnudos.
Cualquiera que estuvo inscrito en la química general de nivel universitario hasta la década de 1960 recordará el entrenamiento (y el tedio) asociado con estos dispositivos. Estos podrían leer directamente a 1 miligramo y permitir estimaciones a ±0.1 mg. Los refinamientos técnicos posteriores agregaron amortiguación magnética del balanceo de la viga, frenos de pan y juegos de pesas incorporados operados por perillas. Las mejores balanzas de grado de investigación alcanzaron precisiones de 0.001 mg.
A partir de la década de 1970, las balanzas electrónicas han entrado en un amplio uso, siendo especialmente populares los tipos de un solo pan. Una balanza de un solo pan elimina la necesidad de comparar el peso de la muestra con el de los pesos calibrados. La adición de una muestra a la sartén provoca un desplazamiento de una célula de carga que genera un campo electromagnético compensador de magnitud suficiente para elevar el platillo a su posición original. La corriente requerida para lograr esto se detecta y se convierte en una medición de peso. Las mejores balanzas electrónicas de grado de investigación pueden leer hasta 1 microgramo, pero las sensibilidades de 0.1 mg son más comunes para el uso de laboratorio estudiantil.


