5.7: Propiedades periódicas de los elementos
- Page ID
- 70936
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
Asegúrese de comprender a fondo las siguientes ideas esenciales:
- Debe poder esbozar la forma general de la tabla periódica e identificar los diversos bloques e identificar los grupos correspondientes a los metales alcalinos, los elementos de transición, los halógenos y los gases nobles.
- Para los primeros dieciocho elementos, deberías ser capaz de predecir las fórmulas de compuestos binarios típicos que se pueden esperar que formen con hidrógeno y con oxígeno.
- Comentar el concepto del “tamaño” de un átomo, y dar ejemplos de cómo se definen los radios en al menos dos clases de sustancias.
- Definir la energía de ionización y la afinidad electrónica, y explicar las tendencias generales periódicas.
- Anotar el significado y significado de la electronegatividad.
La tabla periódica en la forma originalmente publicada por Dmitri Mendeleev en 1869 fue un intento de enumerar los elementos químicos en orden de sus pesos atómicos, al tiempo que se dividió la lista en filas de tal manera que elementos que tuvieran similares características físicas y químicas se colocarían en cada columna. En ese momento, no se sabía nada sobre los átomos; el desarrollo de la tabla era enteramente empírico. Nuestro objetivo en esta lección es ayudarle a entender cómo la forma y organización de la tabla periódica moderna son consecuencias directas de la estructura electrónica atómica de los elementos.
Organización de la Tabla Periódica
Para entender cómo se organiza la tabla periódica, imaginemos que escribimos una larga lista horizontal de los elementos en orden de su creciente número atómico. Comenzaría de esta manera:
H Él Li Ser B C N O F Ne Na Mg Al Si P S Cl Ar K Ca...
Ahora bien, si miramos las diversas propiedades físicas y químicas de estos elementos, encontraríamos que sus valores tienden a aumentar o disminuir con Z de una manera que revela un patrón repetitivo, es decir, una periodicidad. Para los elementos enumerados anteriormente, estos descansos se pueden indicar mediante las barras verticales que se muestran aquí en color:
H Él | Li Ser B C N O F Ne | Na Mg Al Si P S Cl Ar | Ca...
Periodos: Para construir la tabla, colocamos cada secuencia en una fila separada, a la que llamamos punto. Las filas están alineadas de tal manera que los elementos de cada columna vertical poseen ciertas similitudes. Así, los primeros elementos de corto período H y He son químicamente similares a los elementos Li y Ne al inicio y al final del segundo período. El primer periodo se divide para colocar H por encima de Li y He por encima de Ne.
La nomenclatura “bloque” mostrada anteriormente se refiere al tipo suborbital (número cuántico l, o clasificación s-p-d-f) de los orbitales de mayor energía que están ocupados en un elemento dado. Para n =1 no hay bloque p, y el bloque s se divide de manera que el helio se coloca en el mismo grupo que los otros gases inertes, a lo que se asemeja químicamente. Para el segundo periodo (n =2) hay un bloque p pero no un bloque d; en la habitual “forma larga” de la tabla periódica se acostumbra dejar un hueco entre estos dos bloques para dar cabida a los d bloques que ocurren en n =3 y superiores. A n =6 introducimos un bloque f, pero para mantener la mesa a dimensiones razonables los bloques f se colocan debajo del cuerpo principal de la tabla.
Grupos: Cada columna de la tabla periódica se conoce como grupo. Los elementos pertenecientes a un grupo dado tienen una fuerte similitud en sus comportamientos químicos.
En el pasado, se utilizaban dos sistemas diferentes de números romanos y letras para denotar los diversos grupos. Los norteamericanos agregaron la letra B para denotar los grupos del bloque d y A para los demás; este es el sistema que se muestra en la tabla anterior. El resto del mundo utilizó A para los elementos d -block y B para los demás. En 1985 se adoptó un nuevo sistema internacional en el que las columnas simplemente se etiquetaban 1-18. Si bien este sistema ha encontrado suficiente resistencia en América del Norte para frenar su incorporación a los libros de texto, parece probable que el sistema “uno a dieciocho” se haga cargo gradualmente.
Familias. Los químicos han encontrado desde hace mucho tiempo conveniente referirse a los elementos de diferentes grupos, y en algunos casos de tramos de grupos por los nombres indicados en la tabla que se muestra a continuación. Los dos de estos que son más importantes para que conozcas son los gases nobles y los metales de transición.
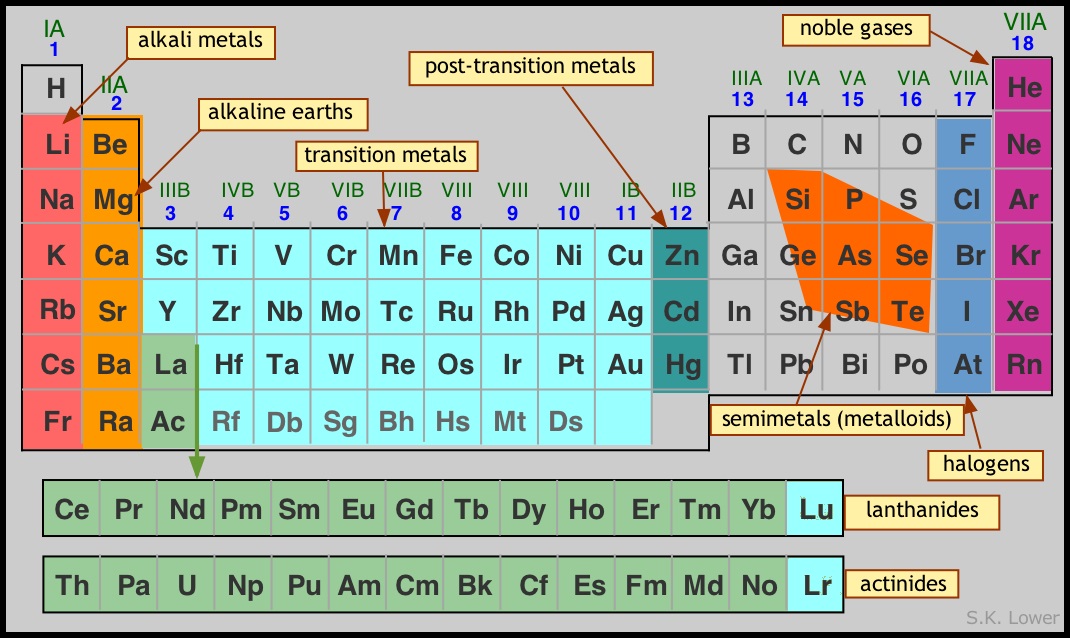
El modelo de concha del átomo
Las propiedades de un átomo dependen en última instancia del número de electrones en los diversos orbitales, y de la carga nuclear que determina la compacidad de los orbitales. Para relacionar las propiedades de los elementos con sus ubicaciones en la tabla periódica, a menudo es conveniente hacer uso de una visión simplificada del átomo en el que el núcleo está rodeado por una o más “conchas” esféricas concéntricas, cada una de las cuales consiste en los orbitales de mayor número cuántico principal ( siempre s - y p -orbitales) que contienen al menos un electrón. El modelo de concha (como con cualquier modelo científico) es menos una descripción del mundo que una forma simplificada de mirarlo que nos ayuda a comprender y correlacionar diversos fenómenos. La principal simplificación aquí es que trata únicamente de los elementos del grupo principal de los bloques s - y p, omitiendo los elementos d - y f -bloque cuyas propiedades tienden a estar menos estrechamente ligadas a sus números de grupo.
Los electrones (denotados por los puntos rojos) en la capa más externa de un átomo son los que interactúan más fácilmente con otros átomos, y por lo tanto juegan un papel importante en el gobierno de la química de un elemento. Observe el uso de símbolos de gas noble para simplificar la notación de configuración electrónica.
En particular, el número de electrones de capa externa (que viene dado por el dígito más a la derecha en el número de grupo) es un determinante principal del “poder combinatorio” de un elemento, o valencia. La tendencia general es que un átomo gane o pierda electrones, ya sea directamente (conduciendo a la formación de iones) o compartiendo electrones con otros átomos para lograr una configuración de capa externa de s 2 p 6. Esta configuración, conocida como octeto, corresponde a la de uno de los elementos de gas noble del Grupo 18.
- los elementos de los Grupos 1, 2 y 13 tienden a renunciar a sus electrones de valencia para formar iones positivos como Na +, Mg 2 + y Al 3 +, así como los compuestos NaH, MgH 2 y AlH 3. Las configuraciones de caparazón exterior de los átomos metálicos en estas especies corresponden a la del neón.
- elementos en los Grupos 15-17 tienden a adquirir electrones, formando iones como P 3—, S 2— y Cl — o compuestos como PH 3, H 2 S y HCl. Las configuraciones de capa exterior de estos elementos corresponden a la del argón.
- los elementos del Grupo 14 normalmente no forman iones en absoluto, sino que comparten electrones con otros elementos en compuestos tetravalentes como CH 4.
El diagrama anterior muestra las tres primeras filas de lo que se conoce como los elementos representativos, es decir, los elementos s - y p -block solamente. A medida que nos movemos más hacia abajo (en la cuarta fila y abajo), la presencia de d-electrones ejerce una influencia complicada que permite que los elementos exhiban múltiples cenefas. Este efecto es especialmente notable en los elementos de metal de transición, y es la razón para no incluir el bloque d con los elementos representativos en absoluto.
Carga nuclear efectiva
Esos electrones en el caparazón más externo o de valencia son especialmente importantes porque son los que pueden dedicarse al intercambio y compartir que es responsable de las reacciones químicas; cuán estrechamente están unidos al átomo determina gran parte de la química del elemento. El grado de unión es el resultado de dos fuerzas opuestas: la atracción entre el electrón y el núcleo, y las repulsiones entre el electrón en cuestión y todos los demás electrones en el átomo. Todo lo que importa es la fuerza neta, la diferencia entre la atracción nuclear y la totalidad de las repulsiones electrón-electrón.
Podemos simplificar aún más el modelo de concha imaginando que los electrones de la capa de valencia son los únicos electrones en el átomo, y que la carga nuclear tiene cualquier valor que se requiera para unir estos electrones tan fuertemente como se observa experimentalmente. Debido a que el número de electrones en este modelo es menor que el número atómico Z, la carga nuclear requerida también será más pequeña. y se conoce como la carga nuclear efectiva. La carga nuclear efectiva es esencialmente la carga positiva que un electrón de valencia “ve”.
Efectivo Z vs. Z
Parte de la diferencia entre Z y Z efectiva se debe a otros electrones en la capa de valencia, pero esto suele ser solo un contribuyente menor porque estos electrones tienden a actuar como si estuvieran dispersos en una capa esférica difusa de mayor radio. Los actores principales aquí son los electrones en las cáscaras internas mucho más compactas que rodean el núcleo y ejercen lo que a menudo se llama un efecto de blindaje o "cribado" sobre los electrones de valencia.

La fórmula para calcular la carga nuclear efectiva no es muy complicada, pero aquí nos saltaremos una discusión al respecto. Un procedimiento aún más simple, aunque bastante crudo, es simplemente restar el número de electrones de la capa interna de la carga nuclear; el resultado es una forma de carga nuclear efectiva que se llama la carga central del átomo.

Tamaños de átomos e iones
El concepto de “tamaño” es algo ambiguo cuando se aplica a la escala de átomos y moléculas. La razón de esto es evidente cuando se recuerda que un átomo no tiene límite definido; hay una probabilidad finita (pero muy pequeña) de encontrar el electrón de un átomo de hidrógeno, por ejemplo, a 1 cm, o incluso a 1 km del núcleo. No es posible especificar un valor definido para el radio de un átomo aislado; lo mejor que podemos hacer es definir una capa esférica dentro de cuyo radio se puede encontrar algún porcentaje arbitrario de la densidad electrónica
. 
Cuando un átomo se combina con otros átomos en un elemento sólido o compuesto, se puede determinar un radio efectivo observando las distancias entre filas adyacentes de átomos en estos sólidos. Esto se lleva a cabo más comúnmente mediante experimentos de dispersión de rayos X. Debido a las diferentes formas en que los átomos pueden agregarse, se pueden definir varios tipos diferentes de radios atómicos.
Nota
Las distancias en la escala atómica se han expresado tradicionalmente en unidades Ångstrom (1Å = 10 —8 cm = 10 —10 m), pero hoy en día se prefiere el picómetro:
1 pm = 10 —12 m = 10 — 10 cm = 10 —2 Å, o 1Å = 100pm.
Los radios de átomos e iones están típicamente en el rango de 70-400pm.
Se puede obtener una idea aproximada del tamaño de un átomo metálico simplemente midiendo la densidad de una muestra del metal. Esto nos dice el número de átomos por unidad de volumen del sólido. Se supone que los átomos son esferas de radio r en contacto entre sí, cada una de las cuales se asienta en una caja cúbica de longitud de borde 2 r. El volumen de cada caja es solo el volumen total del sólido dividido por el número de átomos en esa masa del sólido; el radio atómico es la raíz cubo de r.
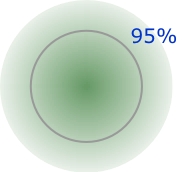
Aunque el radio de un átomo o ion no se puede medir directamente, en la mayoría de los casos se puede inferir a partir de mediciones de la distancia entre núcleos adyacentes en un sólido cristalino. Esto se lleva a cabo más comúnmente mediante experimentos de dispersión de rayos X. Debido a que dichos sólidos caen en varias clases diferentes, se definen varios tipos de radio atómico. Muchos átomos tienen varios radios diferentes; por ejemplo, el sodio forma un sólido metálico y así tiene un radio metálico, forma una molécula gaseosa Na 2 en fase vapor (radio covalente), y por supuesto forma sólidos iónicos como NaCl.

El radio iónico es el radio efectivo de iones en sólidos como NaCl. Es bastante fácil medir la distancia entre filas adyacentes de iones Na + y Cl — en tal cristal, pero no hay una manera inequívoca de decidir qué porciones de esta distancia son atribuibles a cada ion. Lo mejor que se puede hacer es hacer estimaciones basadas en estudios de varios sólidos iónicos diferentes (LiI, KI, NaI, por ejemplo) que contienen un ion en común. Se han hecho muchas estimaciones de este tipo, y resultan ser notablemente consistentes.
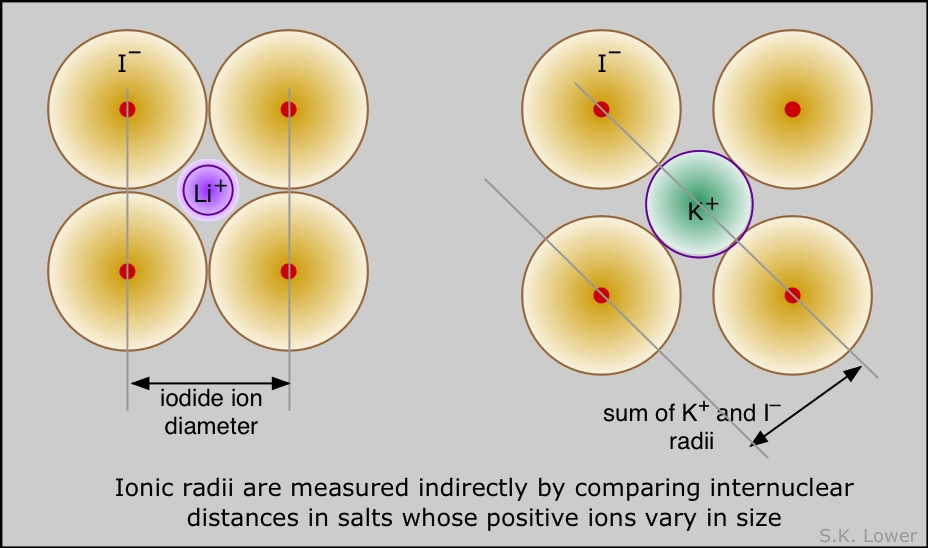
Muchos átomos tienen varios radios diferentes; por ejemplo, el sodio forma un sólido metálico y así tiene un radio metálico, forma una molécula gaseosa Na 2 en fase vapor (radio covalente), y por supuesto forma sólidos iónicos como se mencionó anteriormente.
Tendencias periódicas en el tamaño atómico
Se esperaría que el tamaño de un átomo dependiera principalmente del número cuántico principal del orbital ocupado más alto; es decir, del “número de conchas de electrones ocupadas”. Dado que cada fila de la tabla periódica corresponde a un incremento en n, el radio atómico aumenta a medida que bajamos una columna. El otro factor importante es la carga nuclear; cuanto mayor sea el número atómico, más fuertemente serán atraídos los electrones hacia el núcleo, y cuanto menor sea el átomo. Este efecto es responsable de la contracción que observamos a medida que avanzamos a través de la tabla periódica de izquierda a derecha.
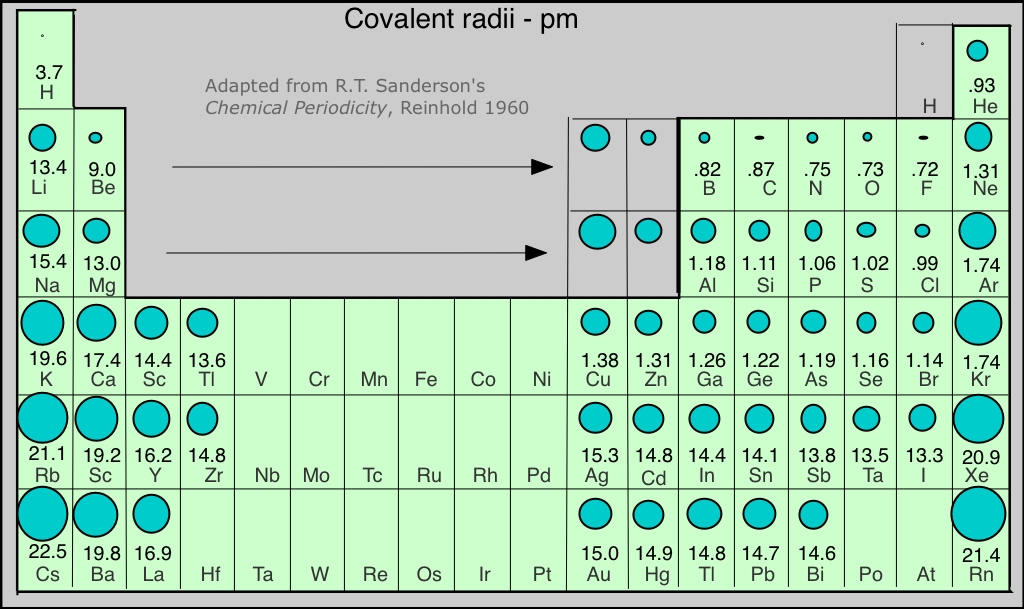
La figura muestra una tabla periódica en la que se representan gráficamente los tamaños de los átomos. Las discontinuidades aparentes en este diagrama reflejan la dificultad de comparar los radios de los átomos de los tipos de enlaces metálicos y no metálicos. Los radios de los elementos de gas noble son estimaciones de los de los elementos cercanos.
Radios iónicos
Un ion positivo es siempre más pequeño que el átomo neutro, debido a la disminución de la repulsión electrón-electrón. Si se pierde un segundo electrón, el ion se vuelve aún más pequeño; por ejemplo, el radio iónico de Fe 2 + es 76 pm, mientras que el de Fe 3 + es 65 pm. Si la formación del ion implica el vaciado completo de la capa exterior, entonces la disminución en el radio es especialmente grande.
El ion hidrógeno H + está en una clase por sí mismo; al no tener ninguna nube de electrones, su radio es el del protón desnudo, o aproximadamente 0.1 pm, ¡una contracción del 99.999%! Debido a que la carga positiva de la unidad se concentra en un volumen de espacio tan pequeño, la densidad de carga del ion hidrógeno es extremadamente alta; interactúa muy fuertemente con otra materia, incluidas las moléculas de agua, y en solución acuosa existe solo como el ion hidronio H 3 O +.
Los iones negativos son siempre más grandes que el ion parental; la adición de uno o más electrones a una capa existente aumenta la repulsión electrón-electrón, lo que resulta en una expansión general del átomo.

Una serie isoelectrónica es una secuencia de especies que tienen el mismo número de electrones (y por lo tanto la misma cantidad de repulsión electrón-electrón) pero que difieren en carga nuclear. Por supuesto, solo un miembro de tal secuencia puede ser un átomo neutro (neón en la serie que se muestra a continuación). Se ve claramente el efecto del aumento de la carga nuclear en el radio.

Tendencias periódicas en la formación de iones
Las reacciones químicas se basan en gran medida en las interacciones entre los electrones más ligados en átomos, por lo que no es sorprendente que la tendencia de un átomo a ganar, perder o compartir electrones sea una de sus propiedades químicas fundamentales.
Energía de ionización
Este término siempre se refiere a la formación de iones positivos. Para eliminar un electrón de un átomo, se debe trabajar para superar la atracción electrostática entre el electrón y el núcleo; este trabajo se denomina energía de ionización del átomo y corresponde al proceso exotérmico
\[M_{(g)} → M^+_{(g)} + e^–\]
donde\(M_{(g)}\) significa cualquier átomo aislado (gaseoso).
Un átomo tiene tantas energías de ionización como electrones. Los electrones siempre se eliminan de la órbita ocupada de mayor energía. Un examen de las sucesivas energías de ionización de los diez primeros elementos (abajo) proporciona la confirmación experimental de que la unión de los dos electrones más internos (1 s orbital) es significativamente diferente de la de los n = 2 electrones.Energías de ionización sucesivas de un átomo aumentan rápidamente a medida que la reducción de la repulsión electrón-electrón hace que las capas de electrones se contraigan, uniendo así los electrones aún más fuertemente al núcleo.

Las energías de ionización aumentan con la carga nuclear Z a medida que avanzamos a través de la tabla periódica. Disminuyen a medida que bajamos de la tabla porque en cada periodo el electrón se está retirando de una concha un paso más lejos del núcleo que en el átomo inmediatamente por encima de él. Esto da como resultado las conocidas líneas en zig-zag cuando se trazan las primeras energías de ionización en función de Z.

Esta gráfica más detallada de las energías de ionización de los átomos de los diez primeros elementos revela algunas irregularidades interesantes que pueden estar relacionadas con las energías ligeramente más bajas (mayores estabilidades) de los electrones en semillenos (espín no emparejado) en relación con las subcáscaras completamente llenas.

Finalmente, a continuación se muestra un estudio más completo de las energías de ionización de los elementos principales del grupo.
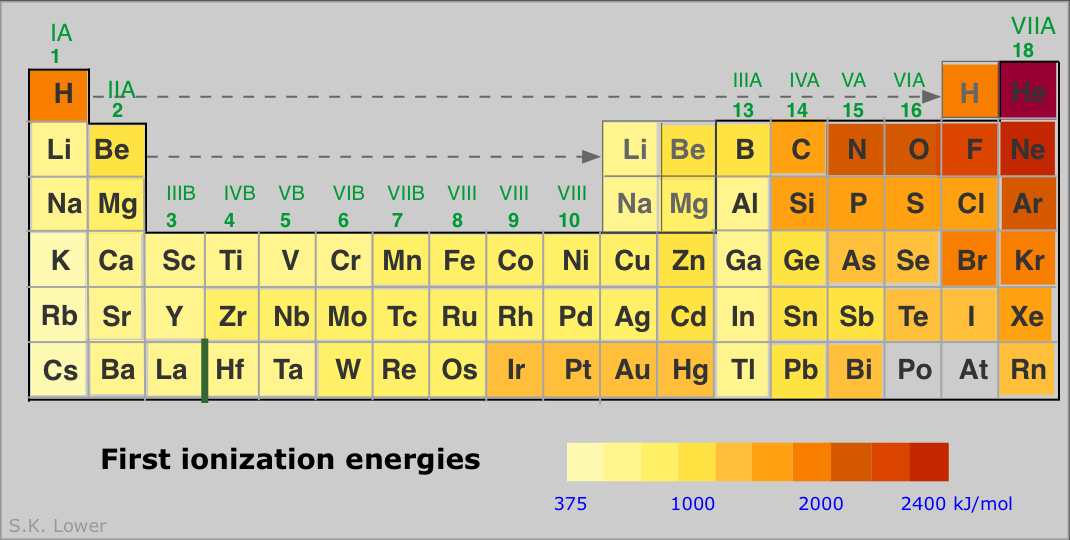
Algunos puntos a tener en cuenta:
- Los gases nobles tienen los IE más altos de cualquier elemento en el periodo. Esto no tiene nada que ver con ninguna misteriosa “estabilidad especial” de la configuración electrónica s 2 p 6; es simplemente una cuestión de la alta carga nuclear que actúa sobre orbitales más contratados.
- Los IE (así como muchas otras propiedades) tienden a no variar mucho entre los elementos del bloque d. Esto refleja el hecho de que a medida que se están llenando los orbitales d más compactos, ejercen un efecto de cribado que en parte desplaza esa carga nuclear creciente en los orbitales más externos de mayor número cuántico principal.
- Cada uno de los elementos del Grupo 13 tiene un First-IE inferior al del elemento que lo precede. La inversión de la tendencia IE en este grupo a menudo se atribuye a la eliminación más fácil del electrón p de capa externa simple en comparación con el de los electrones contenidos en s - y d -orbitales rellenos (y por lo tanto espin-pareados) en los elementos precedentes.
Afinidad electrónica
La formación de un ion negativo ocurre cuando un electrón de alguna fuente externa ingresa al átomo y se incorpora en el orbital de energía más baja que posee una vacante. Debido a que el electrón entrante es atraído hacia el núcleo positivo, la formación de iones negativos suele ser exotérmica. La energía que se desprende es la afinidad electrónica del átomo. Para algunos átomos, la afinidad electrónica parece ser ligeramente negativa, lo que sugiere que la repulsión electrón-electrón es el factor dominante en estos casos.
En general, las afinidades electrónicas tienden a ser mucho más pequeñas que las energías de ionización, lo que sugiere que están controladas por factores opuestos que tienen magnitudes similares. Estos dos factores son, como antes, la carga nuclear y la repulsión electrón-electrón. Pero este último, sólo un actor menor en la formación de iones positivos, es ahora mucho más significativo. Una razón de esto es que los electrones contenidos en las capas internas del átomo ejercen una carga negativa colectiva que cancela parcialmente la carga del núcleo, ejerciendo así un llamado efecto de blindaje que disminuye la tendencia a la formación de iones negativos.
Debido a estos efectos opuestos, las tendencias periódicas en las afinidades electrónicas no son tan claras como las de las energías de ionización. Esto es particularmente evidente en las primeras filas de la tabla periódica, en las que los pequeños efectos tienden a ampliarse de todos modos porque un electrón agregado produce un gran aumento porcentual en el número de electrones en el átomo.
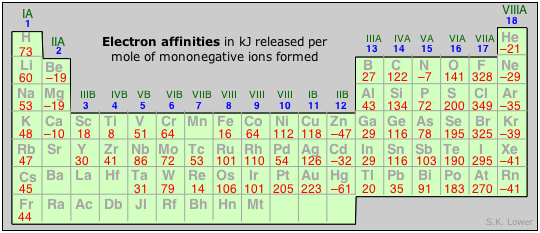
En general, podemos decir que las afinidades electrónicas se vuelven más exotérmicas a medida que avanzamos de izquierda a derecha a lo largo de un periodo (debido al aumento de la carga nuclear y al menor tamaño de los átomos). Hay algunas irregularidades interesantes, sin embargo:
- En los elementos del Grupo 2, el orbital lleno de 2 s aparentemente protege el núcleo de manera tan efectiva que las afinidades electrónicas son ligeramente endotérmicas.
- Los elementos del Grupo 15 tienen valores bastante bajos, debido posiblemente a la necesidad de colocar el electrón agregado en un orbital p medio lleno; no está claro por qué la afinidad electrónica del nitrógeno debe ser endotérmica. La tendencia vertical es que la afinidad electrónica se vuelva menos exotérmica en períodos sucesivos debido a un mejor blindaje del núcleo por más conchas internas y al mayor tamaño del átomo, pero aquí también hay algunas anomalías aparentes.
Electronegatividad
Cuando dos elementos se unen en un enlace químico, el elemento que atrae más fuertemente a los electrones compartidos es más electronegativo. Se dice que los elementos con bajas electronegatividades (los elementos metálicos) son electropositivos.
Las electronegatividades son propiedades de átomos que están unidos químicamente entre sí; no hay forma de medir la electronegatividad de un átomo aislado.
Además, el mismo átomo puede exhibir diferentes electronegatividades en diferentes ambientes químicos, por lo que la “electronegatividad de un elemento” es solo una guía general de su comportamiento químico en lugar de una especificación exacta de su comportamiento en un compuesto particular. Sin embargo, la electronegatividad es eminentemente útil para resumir el comportamiento químico de un elemento. Harás un uso considerable de la electronegatividad cuando estudies la unión química y la química de los elementos individuales.

Debido a que no existe una definición única de electronegatividad, cualquier escala numérica para medirla debe ser necesariamente algo arbitraria. La mayoría de esas escalas se basan en propiedades atómicas que son directamente medibles y que se relacionan de una manera u otra con la propensión a atraer electrones. La más utilizada de estas escalas fue ideada por Linus Pauling y está relacionada con la energía de ionización y la afinidad electrónica. La escala Pauling va de 0 a 4; la mayor afinidad electrónica, 4.0, se asigna al flúor, mientras que el cesio tiene el valor más bajo de 0.7. Los valores menores de aproximadamente 2.2 suelen estar asociados con carácter electropositivo o metálico. En la representación de la escala mostrada en la figura, los elementos están dispuestos en filas correspondientes a sus ubicaciones en la tabla periódica. La correlación es obvia; la electronegatividad se asocia con las filas superiores y las columnas más a la derecha.
La ubicación del hidrógeno en esta escala refleja algunas de las propiedades químicas significativas de este elemento. Aunque actúa como un elemento metálico en muchos aspectos (formando un ion positivo, por ejemplo), también puede formar sólidos de iones hidruros (H —) con los elementos más electropositivos, y por supuesto su capacidad de compartir electrones con el carbono y otros elementos del bloque p da lugar a una muy rica química, incluyendo por supuesto los millones de compuestos orgánicos.


