5.6: Configuraciones de electrones atómicos
- Page ID
- 70957
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
Asegúrese de comprender a fondo las siguientes ideas esenciales:
- Declarar la característica principal de que distingue las energías de los estados excitados de un átomo de un solo electrón de los átomos que contienen más de un electrón.
- Explique por qué la primera energía de ionización del átomo de helio es menor que el doble de la primera ionización del átomo de hidrógeno.
- Ser capaz de escribir una configuración plausible de electrones para cualquier átomo que tenga un número atómico menor a 90.
En la sección anterior aprendiste que un patrón de onda estacionaria de electrones caracterizado por los números cuánticos (n, l, m) se llama orbital. Según el principio de exclusión Pauli, no hay dos electrones en un mismo átomo que puedan tener el mismo conjunto de números cuánticos (n, l, m, s). Esto limita el número de electrones en un orbital dado a dos (s = ±1), y requiere que el átomo que contenga más de dos electrones debe colocarlos en patrones de onda estacionaria correspondientes a números cuánticos principales más altos n, lo que significa que estos electrones estarán más lejos de la núcleo y menos fuertemente ligado por él.
En este capítulo, veremos cómo las restricciones de Pauli sobre los números cuánticos permisibles de electrones en un átomo afectan la configuración electrónica de los diferentes elementos, y, al influir en su comportamiento químico, gobierna la estructura de la tabla periódica.
Los átomos de un electrón
Comencemos con átomos que contienen sólo un solo electrón. El hidrógeno es, por supuesto, la única especie eléctricamente neutra de este tipo, pero al eliminar electrones de elementos más pesados podemos obtener iones de un electrón tales como\(He^+\) y\(Li^{2+}\), etc. cada uno tiene una configuración de estado fundamental de 1 s 1, lo que significa que su único electrón exhibe un patrón de onda estacionaria gobernado por los números cuánticos n =1, m =0 y l =0, con el número cuántico de espín s indefinido porque no hay otro electrón con el que compararlo. Todos tienen espectros de emisión simples cuyas características principales fueron explicadas adecuadamente por el modelo de Bohr.
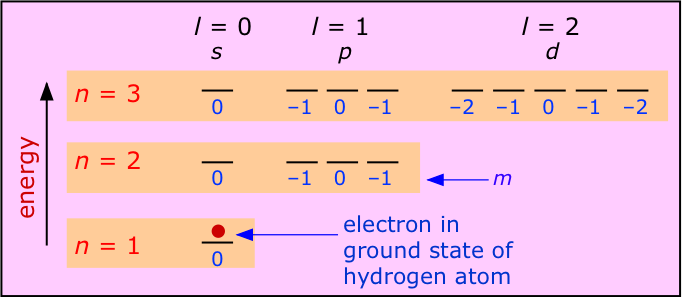
La característica más importante de un átomo de un solo electrón es que la energía del electrón depende únicamente del número cuántico principal n. Como muestra el diagrama anterior, los números cuánticos l y m no tienen ningún efecto sobre la energía; decimos que todos los orbitales que tienen un valor dado de n son degenerados. Así, el espectro de emisión producido al excitar el electrón al nivel n =2 consiste en una sola línea, no cuatro líneas. La longitud de onda de esta línea de emisión para los átomos H, He + y Li 2 + disminuirá con el número atómico porque la mayor carga nuclear disminuirá las energías de los diversos n niveles. Por la misma razón, las energías requeridas para eliminar un electrón de estas especies aumentan rápidamente a medida que aumenta la carga nuclear, debido a que la creciente atracción acerca al electrón al núcleo, produciendo así una fuerza de atracción aún mayor.
Repulsión Electrón-Electrón
Se necesitan 1312 kJ de energía para eliminar el electrón de un mol de átomos de hidrógeno. ¿Cuál podríamos esperar que sea este valor para el helio? El helio contiene dos electrones, pero su núcleo contiene dos protones; cada electrón “ve” ambos protones, por lo que podríamos esperar que los electrones del helio estarían unidos dos veces más fuertemente que el electrón del hidrógeno. Por lo tanto, la energía de ionización del helio debe ser dos veces 1312 kJ/mol, o 2612 kJ/mol. Sin embargo, si se mira el espectro del helio, se ve que el continuo comienza a una longitud de onda correspondiente a una energía de ionización de 2372 kJ/mol, o aproximadamente 90% del valor predicho.

¿Por qué los electrones en el helio están unidos con menos fuerza de lo que la carga nuclear +2 nos llevaría a esperar? La respuesta es que hay otro efecto a considerar: la repulsión entre los dos electrones; la repulsión electrón-electrón resultante resta de la fuerza que sostiene el electrón al núcleo, reduciendo la unión local de cada uno.
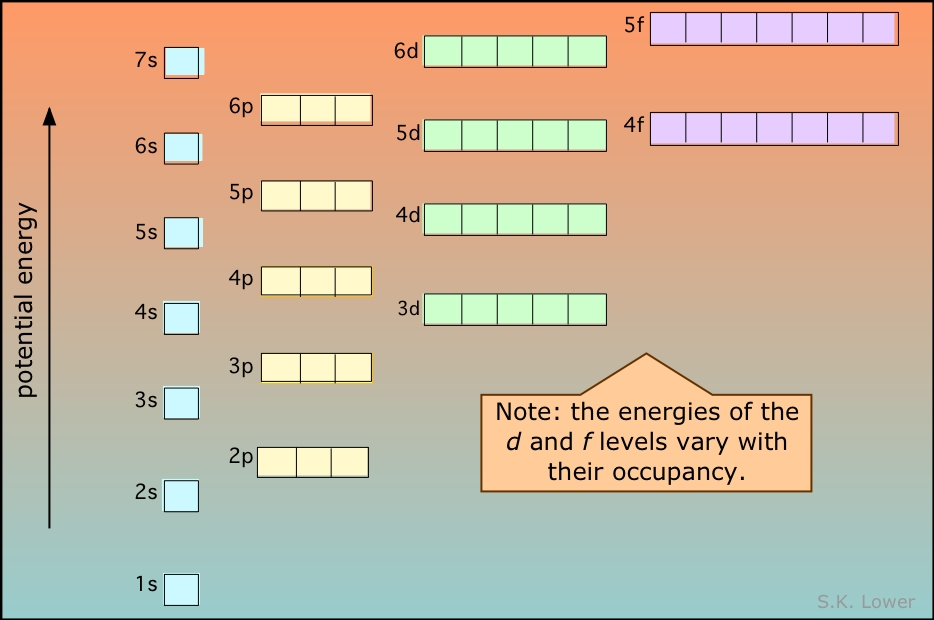
La repulsión electrón-electrón es un factor importante tanto en los espectros como en el comportamiento químico de los elementos más pesados que el hidrógeno. En particular, actúa para “romper la degeneración” (dividir las energías) de orbitales que tienen el mismo valor de n pero diferente l.

El siguiente diagrama muestra cómo las energías de los orbitales s y p de diferentes números cuánticos principales se dividen como resultado de la repulsión electrón-electrón. Observe el contraste con el diagrama similar para átomos de un electrón cerca de la parte superior de esta página. El hecho de que los electrones llenen preferentemente los orbitales vacíos de menor energía es la base de las reglas para determinar la configuración electrónica de los elementos y de la estructura de la tabla periódica.
Las reglas de Aufbau
La palabra alemana Aufbau significa “construir”, y este término se ha utilizado tradicionalmente para describir la manera en que los electrones son asignados a los orbitales a medida que llevamos a cabo la tarea imaginaria de construir los átomos de elementos que tienen números atómicos sucesivamente mayores. Al hacerlo, efectivamente estamos “construyendo” la tabla periódica de los elementos, como veremos en breve.
Cómo jugar el juego de Aufbau- Los electrones ocupan los orbitales de menor energía disponibles; los orbitales de menor energía se llenan antes que los más altos.
- No más de dos electrones pueden ocupar ningún orbital.
- Para los elementos más ligeros, los electrones llenarán orbitales del mismo tipo solo un electrón a la vez, de manera que sus espines estén todos desapareados. Comenzarán a emparejarse sólo después de que todos los orbitales estén medio llenos. Este principio, que es consecuencia de la repulsión electrostática entre electrones, se conoce como regla de Hund.
- Para los primeros 18 elementos, hasta el punto en que los niveles de 3 s y 3 p están completamente llenos, este esquema es completamente sencillo y conduce a configuraciones electrónicas que se espera que pueda elaborar para cada uno de estos elementos.
El diagrama anterior ilustra aquí la idea principal. Cada orbital se representa como una cajita que puede contener hasta dos electrones que tienen espines opuestos, que designamos por flechas que apuntan hacia arriba o hacia abajo. Los electrones llenan primero las cajas de menor energía, de modo que los electrones adicionales son forzados a patrones de onda correspondientes a energías más altas (menos negativas). Así, en el diagrama anterior, el “tercer” electrón de litio entra en el orbital 2s de mayor energía, dando a este elemento una configuración electrónica que escribimos 1s 2 2s 1.
¿Cuál es la configuración electrónica del átomo de fósforo, número atómico 15?
El número de electrones que llenan los orbitales de menor energía son:
1 s: 2 electrones, 2 s: 2 electrones; 2 p: 6 electrones, 3 s: 2 electrones. Esto suma 12 electrones. Los tres electrones restantes entran en el orbital de 3 p, por lo que la configuración electrónica completa de P es de 1 s 2 2 s 2 2 p 6 3 s 2 3 p 3.
Energías de los orbitales más altos ocupados de los elementos: Este diagrama ilustra las reglas de Aufbau a medida que se aplican a todos los elementos. Obsérvese especialmente cómo las energías de los orbitales nd caen entre los orbitales (n —1) s y (n —1) p así, por ejemplo los orbitales de 3 d comienzan a llenarse después de que se llene el orbital de 4 s, pero antes de que los electrones pueblen los 4 p orbitales. Existe una relación similar con los orbitales d - y f.
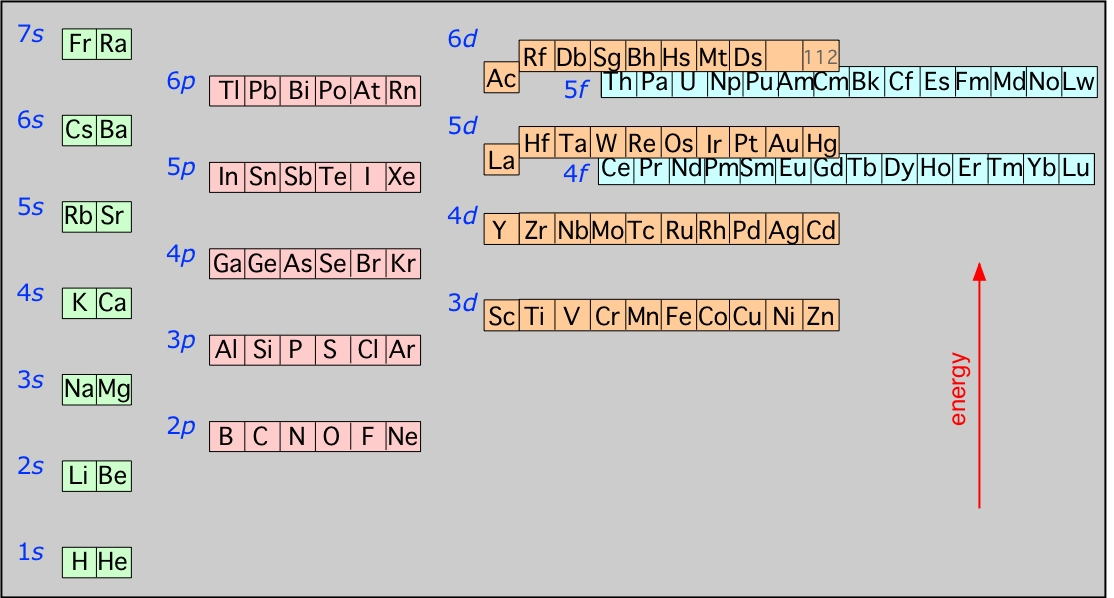
Es muy importante que entiendas este diagrama y cómo se desprende del principio de exclusión de Pauli: Deberías poder reproducirlo desde la memoria hasta el nivel 6 s, porque forma la base fundamental de la tabla periódica de los elementos.
Doblar las reglas
La inspección de una tabla de configuraciones electrónicas de los elementos revela algunas aparentes no uniformidades en el llenado de los orbitales, como se ilustra aquí para los elementos de la llamada primera serie de transición en la que se están poblando los orbitales de 3 d. Estas anomalías son consecuencia de las muy pequeñas diferencias de energía entre algunos de los orbitales, y de la repulsión electrón-electrón reducida cuando los electrones permanecen desapareados (regla de Hund), como es evidente en el cromo, que contiene seis electrones desapareados.
La otra anomalía aquí es el cobre, que “debería” tener la configuración de caparazón exterior 3 d 9 4 s 2. La configuración real del átomo de Cu parece ser 3 d 10 4 s 1. Aunque el orbital de 4 s normalmente está ligeramente por debajo de la energía orbital de 3 d, los dos son tan cercanos que las interacciones entre los dos cuando uno está vacío y el otro no lo está pueden llevar a una inversión. Los cálculos detallados en los que se consideran las formas y densidades de las distribuciones de carga predicen que las energías relativas de muchos orbitales pueden revertirse de esta manera. ¡Se pone aún peor cuando los f-orbitales comienzan a llenarse!
Debido a que estas energías relativas pueden variar incluso para un mismo átomo en diferentes ambientes químicos, la mayoría de los instructores no esperarán que las memorices.
Este diagrama muestra cómo los orbitales atómicos correspondientes a diferentes números cuánticos principales se intercalan entre sí a valores más altos de n. La situación real es más complicada que esto; los cálculos muestran que las energías de los orbitales d y f varían con el número atómico del elemento.
La Tabla Periódica
Las energías orbitales relativas ilustradas anteriormente y el principio de exclusión de Pauli constituyen la base fundamental de la tabla periódica de los elementos que, por supuesto, fue elaborada empíricamente a finales del siglo XIX, mucho antes de que se hubiera oído hablar de los electrones.
La tabla periódica de los elementos se divide convencionalmente en secciones llamadas bloques, cada una de las cuales designa el tipo de “suborbital” (s, p, d, f) que contiene los electrones de mayor energía en cualquier elemento en particular. Tenga en cuenta especialmente que
- Los elementos no metálicos ocurren solo en el bloque p;
- Los elementos del bloque d contienen los llamados elementos de transición;
- Los elementos del bloque f van entre los Grupos 3 y 4 del bloque d.
El diagrama anterior ilustra el vínculo entre las configuraciones electrónicas de los elementos y el diseño de la tabla periódica. Cada fila, también conocida como punto, comienza con dos elementos del bloque s y continúa a través del bloque p. Al final de las filas correspondientes a n >1 se encuentra un elemento que tiene una configuración p 6, un llamado elemento de gas noble. A valores de n de 2 y 3, se agregan secuencias de elementos d - y f -bloque.
A la tabla mostrada anteriormente se le llama la forma larga de la tabla periódica; para muchos propósitos, podemos usar una tabla de “forma corta” en la que el bloque d se muestra debajo del bloque s - y p - “elementos representativos” y el bloque f no aparece en absoluto. Tenga en cuenta que la “forma larga” sería aún más larga si se mostraran los elementos del bloque f donde realmente pertenecen, entre La-Hf y Ac-Db.


