9.2: Moléculas - Propiedades de los átomos unidos
- Page ID
- 70686
Asegúrese de comprender a fondo las siguientes ideas esenciales que se presentan a continuación.
- ¿Cómo definirías un enlace químico?
- ¿Qué se entiende por la conectividad de una molécula? ¿Qué información adicional podría ser necesaria para especificar su estructura?
- Explicar la diferencia entre estabilidad y reactividad, y cómo estos factores podrían impedir que una estructura dada exista el tiempo suficiente para calificarse como molécula.
- Dibuje una curva de energía potencial para una molécula diatómica típica y muestre cómo ilustra la energía del enlace y la longitud del enlace.
- Explicar cómo el calor liberado o absorbido en una reacción química puede relacionarse con las energías de enlace de los reactivos y productos.
- Exponer los principales factores que determinan la distancia entre dos átomos enlazados.
- Describir, de manera general, cómo el espectro infrarrojo de una sustancia puede revelar detalles sobre su estructura molecular.
El concepto de unión química se encuentra en el núcleo mismo de la Química; es lo que permite que alrededor de cien elementos formen los más de cincuenta millones de sustancias químicas conocidas que conforman nuestro mundo físico. Antes de entrar en la teoría de la unión química, necesitamos definir de qué estamos hablando: ¿Exactamente qué es un enlace químico? Y ¿qué propiedades observables podemos usar para distinguir un tipo de vínculo de otro? Esta es la primera de diez lecciones que te ayudarán a familiarizarte con los conceptos fundamentales de esta muy amplia asignatura.
¿Qué es un enlace químico?
Probablemente aprendiste hace algún tiempo que los enlaces químicos son los que mantienen unidos a los átomos para formar los agregados más complicados que conocemos como moléculas y sólidos extendidos. Los químicos hablan de vínculos todo el tiempo, y dibujan imágenes de ellos como líneas que unen símbolos atómicos. Los maestros suelen identificarlos como los pequeños palos que conectan las esferas que representan átomos en un modelo molecular plástico. Entonces no es de extrañar que a veces tendamos a pensar en los enlaces químicos como “cosas”. Pero nadie ha visto jamás un enlace químico, y no hay razón para creer que realmente existan incluso como objetos físicos.

“A VECES ME PARECE que un vínculo entre dos átomos se ha vuelto tan real, tan tangible, tan amable, que casi lo puedo ver. Entonces me despierto con un poco de shock, porque un enlace químico no es algo real. No existe. Nadie ha visto nunca a uno. Nadie puede nunca. Es producto de nuestra propia imaginación”. C.A. Coulson (1910-1974) fue un químico teórico inglés que desempeñó un papel central en el desarrollo de teorías cuánticas de unión química.
Es más útil considerar un enlace químico como un efecto que provoca que ciertos átomos se unan para formar estructuras perdurables que tienen propiedades físicas y químicas únicas.
Entonces, aunque el “enlace químico” no es más que una ficción conveniente, la unión química, que conduce al casi infinito de sustancias (31 millones a mediados de 2007), se encuentra en el núcleo mismo de la química. Las fuerzas que mantienen unidos los átomos unidos son básicamente los mismos tipos de atracciones electrostáticas que unen los electrones de un átomo a su núcleo cargado positivamente;
Bonos Químicos
La unión química ocurre cuando uno o más electrones son atraídos simultáneamente a dos (o más) núcleos.
Este es el dato más importante sobre la unión química que debes conocer, pero no es de por sí una teoría viable de la unión porque no describe las condiciones bajo las cuales se produce la unión, ni hace predicciones útiles sobre las propiedades de los átomos unidos.
¿Qué es una molécula?
Incluso a finales del siglo XIX, cuando los compuestos y sus fórmulas habían estado en uso durante mucho tiempo, algunos químicos destacados dudaban de que las moléculas (o átomos) fueran más que un modelo conveniente. Las moléculas de repente se hicieron realidad en 1905, cuando Albert Einstein demostró que el movimiento browniano, los movimientos microscópicos irregulares de pequeños granos de polen que flotan en el agua, podrían atribuirse directamente a colisiones con partículas del tamaño de una molécula.
La mayoría de la gente piensa en las moléculas como las partículas que resultan cuando los átomos se unen de alguna manera. Esto transmite el panorama general, pero una definición algo mejor que usaremos en estas lecciones es:
Una molécula es un agregado de átomos que posee propiedades observables distintivasUna definición más restrictiva distingue entre una molécula “verdadera” que existe como una partícula independiente, y un sólido extendido que solo puede ser representado por su fórmula más simple. El metano, CH 4, es un ejemplo del primero, mientras que el cloruro de sodio, que no contiene ninguna unidad discreta de NaCl, es el sólido extendido más conocido. Pero debido a que queremos ver la unión química de la manera más general, evitaremos hacer esta distinción aquí excepto en algunos casos especiales. Para enfatizar esta definición de “agregado de átomos”, a menudo usaremos términos como “especies químicas” y “estructuras” en lugar de “moléculas” en esta lección.
La definición escrita anteriormente es operativa; es decir, depende de nuestra capacidad de observar y medir las propiedades de la molécula. Claramente, esto significa que la molécula debe conservar su identidad por un periodo de tiempo lo suficientemente largo como para llevar a cabo las mediciones. Para la mayoría de las moléculas con las que se ocupa la química, esto no presenta ninguna dificultad. Pero sí sucede que algunas estructuras para las que podemos escribir fórmulas, como He 2, tienen vidas tan breves que no se han observado propiedades significativas. Entonces, hasta cierto punto, lo que consideramos una molécula depende de la tecnología que usemos para observarlas, y esto necesariamente cambiará con el tiempo.
¡Estructura, estructura, estructura!
¿Y cuáles son esas propiedades que caracterizan a un tipo particular de molécula y la distinguen de otras? Así como los bienes raíces se juzgan por “ubicación, ubicación, ubicación”, la identidad de una especie química se define por su estructura. En su sentido más fundamental, la estructura de una molécula se especifica por la identidad de sus átomos constituyentes y la secuencia en la que se unen, es decir, por la conectividad de unión. Esto, a su vez, define la geometría de unión, la relación espacial entre los átomos unidos.
La importancia de la conectividad de unión está muy bien ilustrada por las estructuras de los dos compuestos etanol y dimetil éter, ambos de los cuales tienen la fórmula más simple C 2 H 6 O. Las fórmulas estructurales revelan lo muy diferente conectividades de estas dos moléculas cuyas propiedades físicas y químicas son bastante diferentes:
Estructuras sin moléculas: estabilidad y reactividad
La definición precisa de energía de unión se describe en otra lección y aquí no es importante. Por el momento solo hace falta saber que en cualquier estructura estable, la energía potencial de sus átomos es menor que la de los átomos aislados individuales. Así, la formación de metano a partir de sus átomos gaseosos (reacción que no se puede observar en condiciones ordinarias pero para la que se conoce la energética a partir de evidencias indirectas)
\[ \ce{ 4 H(g) + C(g) → CH4}\]
se acompaña de la liberación de calor, y por lo tanto es un proceso exotérmico. La cantidad de calor liberado está relacionada con la estabilidad de la molécula. Cuanto menor sea la cantidad de energía liberada, más fácilmente podrá la molécula absorber la energía térmica del ambiente, impulsando la reacción anterior a la inversa y conduciendo a la descomposición de la molécula. Una molécula altamente estable como el metano debe ser sometida a temperaturas superiores a 1000°C para que se produzca una descomposición significativa. Pero la molécula de gas noble-gas KrF 2 está tan débilmente unida que se descompone incluso a 0°C, y la estructura He 2 nunca se ha observado. Si una disposición particular de átomos es demasiado inestable para revelar sus propiedades a cualquier temperatura alcanzable, entonces no califica para ser llamada molécula.
Hay muchas moléculas que son lo suficientemente estables energéticamente como para cumplir con el criterio anterior, pero son tan reactivas que sus vidas son demasiado breves para hacer posible su observación. La molécula CH 3, metilo, es un buen ejemplo: se puede formar por descarga eléctrica en CH 4 gaseoso, pero es tan reactiva que se combina con casi cualquier molécula que golpee (incluso otra CH 3) dentro de unas pocas colisiones. No fue hasta el desarrollo de métodos espectroscópicos (en los que una molécula se caracteriza por las longitudes de onda de la luz que absorbe o emite) que el metilo fue reconocido como una molécula estable aunque descaradamente promiscua que es un intermedio importante en muchos procesos químicos que van desde llamas hasta química atmosférica.
Cómo representamos las estructuras químicas
Las especies químicas están representadas tradicionalmente por fórmulas estructurales como la del ácido ascórbico (vitamina C) que mostramos aquí. Las líneas, por supuesto, representan los “enlaces químicos” de la molécula. Más importante aún, la fórmula estructural de una molécula define su conectividad, como se ilustró en la comparación de etanol y éter dimetílico mostrada anteriormente.
|
metano |
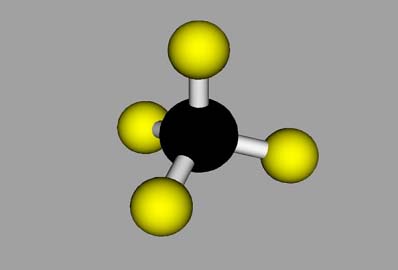 |
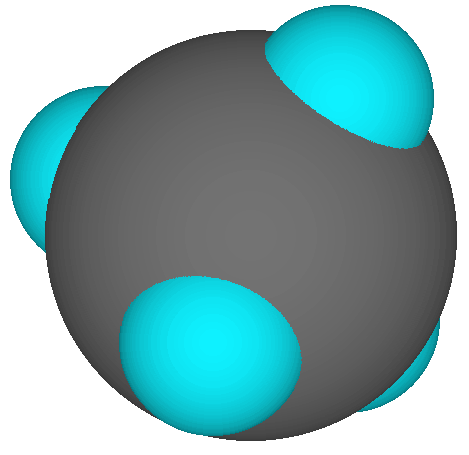 Observe cómo esto muestra que CH 4 es aproximadamente esférico. |
|
Fórmula estructural ordinaria, mostrando solo conectividad.
|
Modelo de bola y varilla, que muestra los “enlaces químicos” y la geometría de unión, pero con los átomos individuales separados de manera irrealista.
|
Modelo de relleno de espacio, que muestra los tamaños relativos de los átomos y la forma general de la molécula, pero no todos los átomos visibles. ¡Aquí no hay “enlaces químicos” obvios!
|
Una limitación de tales fórmulas es que se dibujan en un papel o pantalla bidimensional, mientras que la mayoría de las moléculas tienen una forma tridimensional. Las líneas en forma de cuña en la fórmula estructural son una forma de indicar qué enlaces se extienden por encima o por debajo del plano de visión. Probablemente te librarás de tener que aprender esta convención hasta que entres en Química de segundo año. Los modelos tridimensionales (ya sean plásticos reales o imágenes que incorporan perspectiva y sombreado) revelan mucho más sobre la estructura de una molécula. Las representaciones de bola y palo y relleno de espacio son ampliamente empleadas, pero cada una tiene sus limitaciones, como se ve en los siguientes ejemplos:
Pero, ¿cómo sería “realmente” una molécula si pudieras verla a través de algún tipo de microscopio mágico? Una posible respuesta sería esta visión generada por computadora de la nicotina. Al principio se podría pensar que se parece más a una pieza de escultura abstracta que a una molécula, pero sí revela la forma de la nube de carga negativa que envuelve la colección de núcleos atómicos y núcleos ocultos en su interior. Esto puede ser muy importante para entender cómo la molécula interactúa con las nubes de carga similares que visten las moléculas de solventes y biorreceptores.
Por último, ¡llegamos a ver uno! En 2009, científicos de IBM en Suiza lograron obtener imágenes de una molécula real, utilizando una técnica conocida como microscopía de fuerza atómica en la que una sonda metálica delgada de átomos se dibuja ligeramente por encima de la superficie de una molécula de pentaceno inmovilizada enfriada a casi cero absoluto. Para mejorar la calidad de la imagen, se colocó una molécula de monóxido de carbono en el extremo de la sonda. La imagen producida por la sonda AFM se muestra en la parte inferior. Lo que realmente se está imaginando es la superficie de las nubes de electrones de la molécula, que consiste en cinco anillos hexagonales fusionados de átomos de carbono con hidrógenos en su periferia. Las pequeñas protuberancias que corresponden a estos átomos de hidrógeno dan fe de la notable resolución de este experimento.
Visualización de estructuras moleculares
El propósito de renderizar una estructura molecular de una manera particular no es lograr el “realismo” (sea lo que sea), sino transmitir información útil de algún tipo. El software moderno de renderizado por computadora toma sus datos básicos de varios tipos de bases de datos estructurales estándar que se compilan a partir de datos experimentales de dispersión de rayos X o se calculan a partir de la teoría.
Como se mencionó anteriormente, a menudo es deseable mostrar la “superficie molecular”, el velo de carga negativa que se origina en los electrones de valencia de los átomos pero que tiende a extenderse por toda la molécula a una distancia que puede afectar significativamente las interacciones de van der Waals con moléculas vecinas. A menudo es útil superponer imágenes que representan los átomos dentro de la molécula, escaladas a sus radios covalentes promedio, y dibujar las “líneas de unión” que expresan su conectividad.
Conocer las propiedades de las superficies moleculares es de vital importancia para entender cualquier proceso que dependa de que una molécula permanezca en contacto físico con otra. La catálisis es un ejemplo, pero uno de los principales intereses en la actualidad es la señalización biológica, en la que una molécula relativamente pequeña se une o se “acopla” con un sitio receptor en uno mucho más grande, a menudo una proteína. Sofisticado software de modelado molecular como el que se utilizó para producir estas imágenes es ahora una herramienta importante en muchas áreas de la biología de la investigación.
Visualizar moléculas muy grandes como carbohidratos y proteínas que pueden contener decenas de miles de átomos presenta problemas obvios. La técnica habitual es simplificar las partes principales de la molécula, representando los principales tipos de unidades estructurales extendidas mediante formas como cintas o tubos que son retorcidos o doblados para aproximarse a sus conformaciones. Estos se reúnen para revelar las relaciones geométricas de las diversas unidades dentro de la estructura general. Los átomos individuales, si se muestran en absoluto, están restringidos a los de especial interés.
El estudio de las propiedades superficiales de moléculas grandes es crucial para comprender cómo las proteínas, los carbohidratos y el ADN interactúan con moléculas más pequeñas, especialmente aquellas involucradas en el transporte de iones y moléculas pequeñas a través de las membranas celulares, el comportamiento del sistema inmunológico y los procesos de transducción de señales como el” encendido” de genes.
Propiedades observables de pares de átomos unidos
Cuando hablamos de las propiedades de un enlace químico particular, realmente estamos discutiendo la relación entre dos átomos adyacentes que forman parte de la molécula. Las moléculas diatómicas son, por supuesto, las más fáciles de estudiar, y la información que obtenemos de ellas nos ayuda a interpretar diversos tipos de experimentos que llevamos a cabo en moléculas más complicadas.
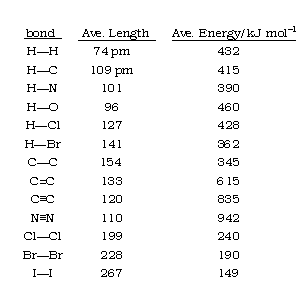
Es importante tener en cuenta que las propiedades exactas de un tipo específico de enlace estarán determinadas en parte por la naturaleza de los otros enlaces en la molécula; así la energía y la longitud del enlace C-H dependerán algo de qué otros átomos estén conectados al átomo de carbono. De manera similar, la longitud del enlace C-H puede variar tanto en un 4 por ciento entre diferentes moléculas. Por esta razón, los valores enumerados en las tablas de energía de enlace y longitud de enlace suelen ser promedios tomados sobre una variedad de compuestos que contienen un par de átomos específico.
En algunos casos, como C—O y C-C, las variaciones pueden ser mucho mayores, acercándose al 20 por ciento. En estos casos, los valores caen en grupos que interpretamos como representativos de enlaces simples y múltiples: dobles y triples.
Curvas de energía potencial
La energía de un sistema de dos átomos depende de la distancia entre ellos. A grandes distancias la energía es cero, lo que significa “sin interacción”. A distancias de varios diámetros atómicos dominan fuerzas atractivas, mientras que a aproximaciones muy cercanas la fuerza es repulsiva, haciendo que la energía suba. Los efectos atractivos y repulsivos se equilibran en el punto mínimo de la curva. Las parcelas que ilustran esta relación se conocen como curvas Morse, y son bastante útiles para definir ciertas propiedades de un enlace químico.

La distancia internuclear a la que se produce el mínimo de energía potencial define la longitud del enlace. Esto se conoce más correctamente como la longitud del enlace de equilibrio, porque el movimiento térmico hace que los dos átomos vibren alrededor de esta distancia. En general, cuanto más fuerte sea el enlace, menor será la longitud del enlace.
Las fuerzas atractivas operan entre todos los átomos, pero a menos que el mínimo de energía potencial sea al menos del orden de RT, los dos átomos no podrán resistir la influencia disruptiva de la energía térmica el tiempo suficiente para dar como resultado una molécula identificable. Así podemos decir que existe un enlace químico entre los dos átomos en\(\ce{H2}\). La débil atracción entre los átomos de argón no\(\ce{Ar2}\) permite existir como molécula, pero sí da lugar a la fuerza van Der Waals que mantiene unidos los átomos de argón en sus formas líquida y sólida.
Energía potencial y energía cinética La teoría cuántica nos dice que un electrón en un átomo posee energía cinética K así como energía potencial P, por lo que la energía total E es siempre la suma de los dos: E = P + K. La relación entre ellos es sorprendentemente simple: K = —0.5 P. Esto significa que cuando se forma un enlace químico (un proceso exotérmico con ΔE < 0), la disminución de la energía potencial va acompañada de un aumento en la energía cinética (encarnada en el impulso de los electrones de unión), pero la magnitud de este último cambio es sólo la mitad, por lo que el cambio en la energía potencial siempre domina. La energía de enlace —ΔE tiene la mitad de la magnitud de la caída de la energía potencial.
Energías de enlace
La energía de enlace es la cantidad de trabajo que se debe hacer para separar dos átomos por completo; es decir, es lo mismo que la profundidad del “pozo” en la curva de energía potencial mostrada anteriormente. Esto es casi, pero no exactamente lo mismo que la energía de disociación del enlace realmente requerida para romper el enlace químico; la diferencia es la energía de punto cero muy pequeña. Esta relación se aclarará a continuación en el apartado sobre frecuencias vibracionales de enlace. Las energías de enlace generalmente se determinan indirectamente a partir de datos termodinámicos, pero hay dos formas experimentales principales de medirlas directamente:
1. El método termoquímico directo consiste en separar los dos átomos por una descarga eléctrica o algún otro medio, y luego medir el calor desprendido cuando se recombinan. Así, la energía del enlace sencillo C—C puede estimarse a partir del calor de la reacción de recombinación entre radicales metilo, produciendo etano:\[CH_3 + CH_3 → H_3C–CH_3\] Aunque este método es simple en principio, no es fácil de llevar a cabo experimentalmente. Los componentes altamente reactivos deben prepararse en alta pureza y en una corriente de gas en movimiento.
2. El método espectroscópico se basa en el principio de que la absorción de luz cuya longitud de onda corresponde a la energía del enlace a menudo conducirá a la ruptura del enlace y la disociación de la molécula. Para algunos enlaces, esta luz cae en las regiones verde y azul del espectro, pero para la mayoría de los enlaces se requiere luz ultravioleta. El experimento se lleva a cabo observando la absorción de luz por la sustancia en estudio a medida que disminuye la longitud de onda. Cuando la longitud de onda es suficientemente pequeña para romper el enlace, se observa un cambio característico en el patrón de absorción.
La espectroscopia se realiza con bastante facilidad y puede producir resultados altamente precisos, pero este método solo es aplicable a un número relativamente pequeño de moléculas simples. El principal problema es que la luz primero debe ser absorbida por la molécula, y relativamente pocas moléculas pasan a absorber luz de una longitud de onda que corresponde a una energía de enlace.
Los experimentos realizados en moléculas diatómicas como O 2 y CS producen valores inequívocos de energía de enlace, pero para moléculas más complejas existen complicaciones. Por ejemplo, el calor desprendido en la reacción de combinación de CH 3 escrita anteriormente también incluirá un pequeño componente que representa las diferencias en las energías de los enlaces C-H en metilo y en etano. Estos pueden ser corregidos por datos experimentales sobre reacciones como
\[CH_3 + H → CH_4\]
\[CH_2 + H → CH_3\]
Al ensamblar una gran cantidad de información experimental de este tipo, se puede obtener un conjunto consistente de energías de enlace promedio (ver tabla a continuación). Las energías de los dobles enlaces son mayores que las de los enlaces simples, y las de los enlaces triples son aún mayores.
Uso de energías de enlace en la estimación de calores de reacción
A menudo se puede tener una muy buena idea de cuánto calor se absorberá o emitirá en una reacción simplemente encontrando la diferencia en las energías de enlace totales contenidas en los reactivos y productos. La fuerza de un enlace individual como O—H depende en cierta medida de su entorno en una molécula (es decir, en este ejemplo, de qué otro átomo está conectado al átomo de oxígeno), pero las tablas de energías “promedio” de los diversos tipos de enlaces comunes están ampliamente disponibles y pueden proporcionar estimaciones útiles de la cantidad de calor absorbido o liberado en muchas reacciones químicas.
| Bonos Individuales | Bonos Múltiples | ||||||
|---|---|---|---|---|---|---|---|
| H—H |
432
|
N—H |
391
|
I—I |
149
|
C = C |
614
|
| H—F |
565
|
N—N |
160
|
I—Cl |
208
|
C ≡ C |
839
|
| H—Cl |
427
|
N—F |
272
|
I—Br |
175
|
O = O |
495
|
| H—Br |
363
|
N—Cl |
200
|
C = O* |
745
|
||
| H—I |
295
|
N—Br |
243
|
S—H |
347
|
C ≡ O |
1072
|
| N—O |
201
|
S—F |
327
|
N = O |
607
|
||
| C—H |
413
|
O—H |
467
|
S—Cl |
253
|
N = N |
418
|
| C—C |
347
|
O—O |
146
|
S-Br |
218
|
N ≡ N |
941
|
| C—N |
305
|
O—F |
190
|
S-S |
266
|
C ≡ N |
891
|
| C—O |
358
|
O—Cl |
203
|
C = N |
615
|
||
| C—F |
485
|
O—I |
234
|
Si—Si |
340
|
||
| C—Cl |
339
|
Si—H |
393
|
||||
| C—Br |
276
|
F—F |
154
|
Si—C |
360
|
||
| C—I |
240
|
F—Cl |
253
|
Si—O |
452
|
||
| C—S |
259
|
F—Br |
237
|
||||
| Cl—Cl |
239
|
||||||
| Cl—Br |
218
|
||||||
| Br—Br |
193
|
||||||
|
*C == O (CO 2) = 799
|
|||||||
Las energías de enlace promedio son los promedios de las energías de disociación de enlaces (consulte la Tabla T3 para obtener una lista más completa). Por ejemplo, la energía de enlace promedio de O-H en H 2 O es 464 kJ/mol. Esto se debe a que el enlace H-OH requiere 498.7 kJ/mol para disociarse, mientras que el enlace O-H necesita 428 kJ/mol. \[\dfrac{498.7\; kJ/mol + 428\; kJ/mol}{2}=464\; kJ/mol\]
Considere la reacción del cloro con metano para producir diclorometano y cloruro de hidrógeno:
\[\ce{CH4(g) + 2 Cl2(g) → CH2Cl2(g) + 2 HCl(g)}\]
En esta reacción, se rompen dos enlaces C—Cl y dos enlaces H—Cl, y se forman dos nuevos enlaces C—Cl y H—Cl. El cambio neto asociado con la reacción es
2 (C—H) + 2 (Cl—Cl) — 2 (C—Cl) — 2 (H—Cl) = (830 + 486 —660 — 864) kJ
que llega a —208 kJ por mol de metano; esto concuerda bastante bien con el calor de reacción observado, que es —202 kJ/mol.
Longitudes y ángulos de unión
La longitud de un enlace químico es la distancia entre los centros de los dos átomos unidos (la distancia internuclear). Las longitudes de unión se han expresado tradicionalmente en unidades Ångstrom, pero ahora se prefieren los picometros (1Å = 10 -8 cm = 100pm). Las longitudes de unión están típicamente en el intervalo de 1-2 Å o 100-200pm. Aunque el enlace esté vibrando, las longitudes de enlace de equilibrio se pueden determinar experimentalmente dentro de ±1 pm.
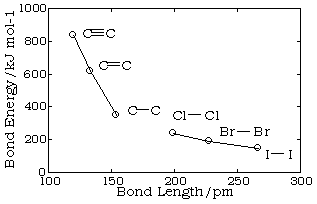
Las longitudes de los enlaces dependen principalmente de los tamaños de los átomos, y secundariamente de las fuerzas de enlace, los enlaces más fuertes tienden a ser más cortos. Los enlaces que involucran hidrógeno pueden ser bastante cortos; El enlace más corto de todos, H—H, es de solo 74 pm. Los átomos con enlaces múltiples están más cercanos entre sí que los unidos por simple; este es un criterio importante para determinar experimentalmente la multiplicidad de un enlace. Esta tendencia es claramente evidente en la gráfica anterior que representa la secuencia de enlaces simples, dobles y triples carbono-carbono.
El método más común para medir longitudes de enlace en sólidos es mediante el análisis de la difracción o dispersión de rayos X cuando pasan a través de los átomos regularmente espaciados en el cristal. Para moléculas gaseosas, también se puede usar difracción de neutrones o electrones.
La estructura completa de una molécula requiere una especificación de las coordenadas de cada uno de sus átomos en el espacio tridimensional. Estos datos pueden ser utilizados por programas de computadora para construir visualizaciones de la molécula como se discutió anteriormente. Aquí se muestra una visualización de la molécula de agua, con distancias de enlace y el ángulo de enlace HOH superpuesto en un modelo de relleno de espacio. (Se toma de una excelente fuente de referencia sobre el agua). Los colores muestran los resultados de cálculos que representan la forma en que la carga de electrones se distribuye alrededor de los tres núcleos.
Estiramiento de unión y absorción infrarroja
Cuando un átomo es desplazado de su posición de equilibrio en una molécula, está sujeto a una fuerza restauradora que aumenta con el desplazamiento. Un resorte sigue la misma ley (la ley de Hooke); por lo tanto, un enlace químico es formalmente similar a un resorte que tiene pesos (átomos) unidos a sus dos extremos. Un sistema mecánico de este tipo posee una frecuencia vibratoria natural que depende de las masas de los pesos y de la rigidez del resorte. Estas vibraciones son iniciadas por la energía térmica del entorno; los átomos unidos químicamente nunca están en reposo a temperaturas superiores al cero absoluto.
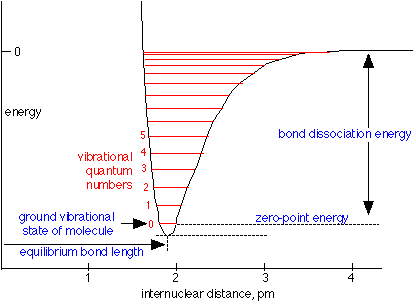
En la escala atómica en la que se cuantifican todos los movimientos, un sistema vibratorio puede poseer una serie de frecuencias vibratorias, o estados. Estas son representadas por las líneas horizontales en la curva de energía potencial que se muestra aquí. Observe que el fondo mismo de la curva no corresponde a un estado permitido porque en este punto se especifican con precisión las posiciones de los átomos, lo que violaría el principio de incertidumbre. El estado vibracional más bajo permitido, o tierra, es el denotado por 0, y normalmente es el único estado que se encuentra significativamente poblado en la mayoría de las moléculas a temperatura ambiente. Para saltar a un estado superior, la molécula debe absorber un fotón cuya energía sea igual a la distancia entre los dos estados.
Para los enlaces químicos ordinarios, las diferencias de energía entre estas frecuencias vibracionales naturales corresponden a las de la luz infrarroja. Cada longitud de onda de luz infrarroja que excita el movimiento vibratorio de un enlace particular será absorbida por la molécula. En general, cuanto más fuerte sea el enlace y más ligeros sean los átomos que conecta, mayor será su frecuencia de estiramiento natural y más corta será la longitud de onda de la luz absorbida por él. Los estudios sobre una amplia variedad de moléculas han permitido determinar las longitudes de onda absorbidas por cada tipo de enlace. Al trazar el grado de absorción en función de la longitud de onda, se obtiene el espectro infrarrojo de la molécula que permite “ver” qué tipos de enlaces están presentes.
Espectro infrarrojo del alcohol Los puntos bajos en la gráfica de abajo indican las frecuencias de luz infrarroja que son absorbidas por etanol (alcohol etílico), CH 3 CH 2 OH. Observe cómo las frecuencias de estiramiento que involucran hidrógeno son más altas, reflejando la masa más pequeña de ese átomo. Aquí solo se anotan las bandas de absorción más prominentes.
Los espectros infrarrojos reales se complican por la presencia de movimientos más complejos (tramos que involucran más de dos átomos, meneo, etc.), y absorción a estados cuánticos más altos (armónicos), por lo que los espectros infrarrojos pueden volverse bastante complejos. Esto no es necesariamente una desventaja, sin embargo, porque tales espectros pueden servir como una “huella dactilar” que es única para una molécula en particular y puede ser útil para identificarla. En gran parte por esta razón, los espectrómetros infrarrojos son equipos estándar en la mayoría de los laboratorios de química Ahora que sabes algo sobre las vibraciones de estiramiento de enlaces, ¡puedes impresionar a tus amigos diciéndoles por qué el agua es azul!
Absorción infrarroja y calentamiento global
El aspecto de las frecuencias de estiramiento y flexión de enlaces que impacta más directamente en nuestras vidas es la forma en que algunos de los gases de la atmósfera absorben la luz infrarroja y así afectan el balance térmico de la Tierra. Debido a sus formas simétricas, los componentes atmosféricos principales N 2 y O 2 no absorben la luz infrarroja, pero los componentes menores vapor de agua y dióxido de carbono son absorbentes fuertes, especialmente en la región de longitud de onda larga del infrarrojo. La absorción de la luz infrarroja por un gas provoca que su temperatura suba, por lo que cualquier fuente de luz infrarroja tenderá a calentar la atmósfera; este fenómeno se conoce como el efecto invernadero.
La radiación entrante del Sol (que contiene relativamente poca luz infrarroja de onda larga) pasa libremente a través de la atmósfera y es absorbida por la superficie de la Tierra, calentándola y provocando que vuelva a emitir parte de esta energía como infrarrojo de longitud de onda larga. La mayor parte de este último es absorbido por el H 2 O y el CO 2, el principal gas de efecto invernadero se encuentra en la atmósfera no contaminada, atrapando efectivamente la radiación como calor. Así la atmósfera es calentada por la Tierra, más que por la luz solar directa. Sin los “gases de efecto invernadero” en la atmósfera, el calor de la Tierra se irradiaría al espacio, y nuestro planeta estaría demasiado frío para la vida.
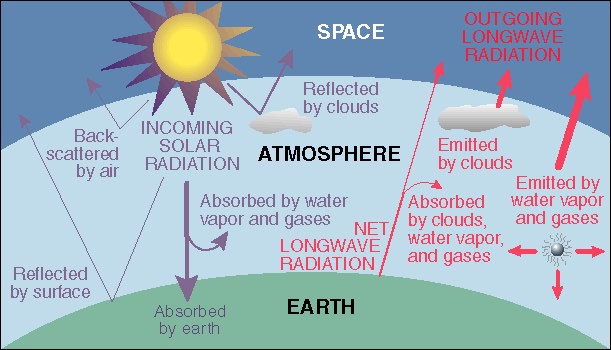
Balance de radiación de la Tierra Para mantener una temperatura promedio constante, la cantidad de radiación (luz solar) absorbida por la superficie debe equilibrarse exactamente con la cantidad de infrarrojos de longitud de onda larga emitida por la superficie y la atmósfera e irradiada de regreso al espacio. Los gases atmosféricos que absorben esta luz infrarroja (representada en rojo en la parte derecha de este diagrama) bloquean parcialmente esta emisión y se vuelven más cálidos, elevando la temperatura de la Tierra. Este diagrama es de la página web de la U. de Oregon referenciada a continuación.
Desde el inicio de la Revolución Industrial en el siglo XIX, grandes cantidades de gases de efecto invernadero adicionales se han ido acumulando en la atmósfera. El dióxido de carbono de la combustión de combustibles fósiles ha sido la principal fuente, pero la agricultura intensiva también aporta cantidades significativas de metano (CH 4) y óxido nitroso (N 2 O) que también son absorbentes eficientes del infrarrojo lejano. Muchos creen que el aumento medible de estos gases es responsable del aumento en la temperatura promedio de la Tierra que se ha observado en los últimos 50 años, tendencia que podría iniciar inundaciones generalizadas y otros desastres si continúa.