9.10: Adhesión en Metales
- Page ID
- 70649
- Explicar la diferencia fundamental entre la unión en sólidos metálicos en comparación con la de otros tipos de sólidos y dentro de moléculas. Nombra algunas propiedades físicas de los metales que reflejen esta diferencia.
- Esboce un diagrama que ilustra cómo un simple enfoque molecular-orbital para la unión en metales de los Grupos 1 y 2 siempre deja vacíos algunos MO superiores.
- Describir, al nivel más simple, el origen de las “bandas” de electrones en los metales.
- Describir cómo se puede explicar la conductividad eléctrica y térmica de los metales de acuerdo con la teoría de bandas.
- Explicar por qué la conductividad eléctrica de un metal disminuye con la temperatura, mientras que la de un semiconductor aumenta.
La mayoría de los elementos químicos conocidos son metales, y muchos de estos se combinan entre sí para formar una gran cantidad de compuestos intermetálicos. Las propiedades especiales de los metales, su aspecto brillante y lustroso, sus altas conductividades eléctricas y térmicas, y su maleabilidad, sugieren que estas sustancias están unidas de una manera muy especial.
Propiedades de los metales
El hecho de que los elementos metálicos se encuentren en el lado izquierdo de la tabla periódica ofrece una pista importante sobre la naturaleza de cómo se unen para formar sólidos.
- Todos estos elementos poseen bajas electronegatividades y forman fácilmente iones positivos M n +. Debido a que no muestran tendencia a formar iones negativos, se puede descartar inmediatamente el tipo de unión presente en los sólidos iónicos.
- Los elementos metálicos tienen p -orbitales exteriores vacíos o casi vacíos, por lo que nunca hay suficientes electrones de capa externa para colocar un octeto alrededor de un átomo.
Estos puntos nos llevan a la imagen más simple de los metales, que los considera como una red de iones positivos inmersos en un “mar de electrones” que puede migrar libremente por todo el sólido. En efecto, la naturaleza electropositiva de los átomos metálicos permite que sus electrones de valencia existan como un fluido móvil que puede ser desplazado por un campo eléctrico aplicado, dando lugar a sus altas conductividades eléctricas. Debido a que cada ion está rodeado por el fluido electrónico en todas las direcciones, la unión no tiene propiedades direccionales; esto explica la alta maleabilidad y ductilidad de los metales.
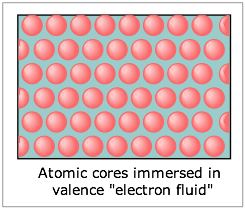
Esta visión es una simplificación excesiva que no logra explicar los metales de manera cuantitativa, ni puede dar cuenta de las diferencias en las propiedades de los metales individuales. Un tratamiento más detallado, conocido como la teoría del enlace de los metales, aplica la idea de híbridos de resonancia a las celosías metálicas. En el caso de un metal alcalino, por ejemplo, esto implicaría un gran número de estructuras híbridas en las que un átomo de Na dado comparte su electrón con sus diversos vecinos.
Orbitales moleculares en metales
se verá. Todos estos se construyen combinando los AtomicMO individuales que están tan estrechamente espaciados en energía que forman lo que se conoce como una banda de energías permitidas. En litio metálico solo se ocupa la mitad inferior de esta banda.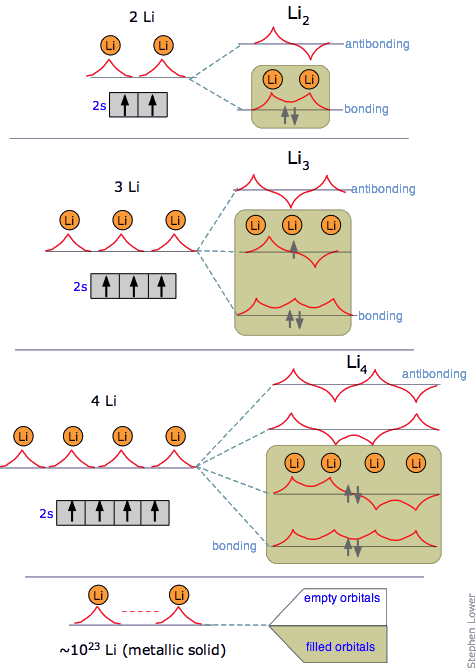
Origen de Propiedades Metálicas
Los sólidos metálicos poseen propiedades especiales que los diferencian de otras clases de sólidos y los hacen fáciles de identificar y familiares para todos. Todas estas propiedades derivan de la liberación de los electrones de valencia del control de átomos individuales, lo que les permite comportarse como un fluido altamente móvil que llena toda la red cristalina. Lo que antes eran orbitales de valencia-concha de átomos individuales se dividen en un gran número de niveles muy espaciados conocidos como bandas que se extienden por todo el cristal.
Punto de fusión y resistencia
La fuerza de un metal deriva de la atracción electrostática entre la red de iones positivos y el fluido de electrones de valencia en el que están sumergidos. Cuanto mayor sea la carga nuclear (número atómico) del núcleo atómico y cuanto menor sea su tamaño, mayor será esta atracción. Al igual que con muchas otras propiedades periódicas, estas funcionan de manera opuesta, como se ve al comparar los puntos de fusión de algunos de los metales del Grupo 1-3 (derecha). Otros factores, particularmente la geometría reticular también son importantes, por lo que excepciones como las que se ve en el Mg no son sorprendentes.
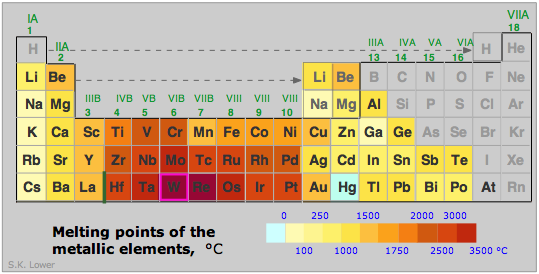
En general, los metales de transición con sus electrones de nivel de valencia d son más fuertes y tienen puntos de fusión más altos: Fe, 1539°C; Re 3180, Os 2727; W 3380°C.
Maleabilidad y ductilidad
Estos términos se refieren respectivamente a la facilidad con la que se puede conformar un sólido mediante presión (forjado, martilleo, laminado en una lámina) y al ser estirado en un alambre. Los sólidos metálicos son conocidos y valorados por estas cualidades, que derivan de la naturaleza no direccional de las atracciones entre los átomos del núcleo y el fluido de electrones. El enlace dentro de sólidos iónicos o covalentes puede ser más fuerte, pero también es direccional, haciendo que estos sólidos estén sujetos a fractura (quebradizos) cuando se golpean con un martillo, por ejemplo. Un metal, por el contrario, tiene más probabilidades de ser simplemente deformado o abollado.
Conductividad eléctrica: ¿por qué los metales son buenos conductores?
Para que una sustancia conduzca la electricidad, debe contener partículas cargadas (portadores de carga) que sean lo suficientemente móviles para moverse en respuesta a un campo eléctrico aplicado. En el caso de las soluciones iónicas y fundidos, los propios iones cumplen esta función. (Los sólidos iónicos contienen los mismos portadores de carga, pero debido a que están fijos en su lugar, estos sólidos son aislantes). En los metales los portadores de carga son los electrones, y debido a que se mueven libremente a través de la red, los metales son altamente conductores. La muy baja masa e inercia de los electrones les permite conducir corrientes alternas de alta frecuencia, algo que las soluciones electrolíticas son incapaces de hacer. En términos de la estructura de bandas, la aplicación de un campo externo simplemente eleva algunos de los electrones a niveles previamente desocupados que poseen mayor impulso.
La conductividad de una solución electrolítica disminuye a medida que baja la temperatura debido a la disminución de la “viscosidad” que inhibe la movilidad iónica. La movilidad del fluido electrónico en los metales prácticamente no se ve afectada por la temperatura, pero los metales sí sufren una ligera disminución de la conductividad (opuesta a las soluciones iónicas) a medida que aumenta la temperatura; esto sucede porque los movimientos térmicos más vigorosos de los iones del núcleo alteran la estructura reticular uniforme que se requiere para el libre movimiento de los electrones dentro del cristal. La plata es el metal más conductor, seguido por el cobre, el oro y el aluminio.
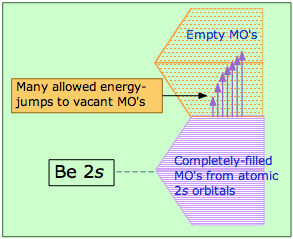
Los metales conducen la electricidad fácilmente debido al suministro esencialmente infinito de MOs vacíos de mayor energía que los electrones pueden poblar a medida que adquieren energías cinéticas más altas. Este diagrama ilustra la estructura de bandas superpuestas (explicada más adelante) en berilio. Los niveles de MO están tan espaciados que incluso las energías térmicas pueden proporcionar excitación y hacer que el calor se propague rápidamente a través del sólido.
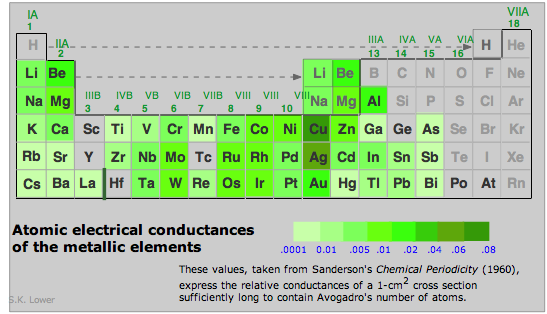
Las conductividades eléctricas de los elementos metálicos varían en un amplio rango. Observe que los de plata y cobre (los más altos de cualquier metal) están en clases por sí mismos. Oro y aluminio siguen de cerca.
Conductividad térmica: ¿por qué los metales conducen el calor?
Todo el mundo sabe que tocar una superficie metálica a temperatura ambiente produce una sensación más fría que tocar una pieza de madera o plástico a la misma temperatura. La muy alta conductividad térmica de los metales les permite extraer calor de nuestros cuerpos de manera muy eficiente si están por debajo de la temperatura corporal. De la misma manera, una superficie metálica que está por encima de la temperatura corporal se sentirá mucho más cálida que una hecha de algún otro material. La alta conductividad térmica de los metales se atribuye a las excitaciones vibracionales de los electrones similares a fluidos; esta excitación se propaga a través del cristal mucho más rápidamente que en sólidos no metálicos que dependen de movimientos vibratorios de átomos que son mucho más pesados y poseen mayor inercia.
Apariencia: ¿Por qué los metales son brillantes?
Habitualmente reconocemos un metal por su “lustre metálico”, que se refiere a su capacidad de reflejar la luz. Cuando la luz cae sobre un metal, su campo electromagnético que cambia rápidamente induce movimientos similares en los electrones más flojamente unidos cerca de la superficie (esto no podría suceder si los electrones estuvieran confinados a las conchas de valencia atómica). Una carga vibratoria es en sí misma un emisor de radiación electromagnética, por lo que el efecto es hacer que el metal reemita, o refleje, la luz incidente, produciendo la apariencia brillante. ¿De qué color es un metal? Con las dos excepciones del cobre y el oro, los niveles muy espaciados en las bandas permiten que los metales absorban todas las longitudes de onda igualmente bien, por lo que la mayoría de los metales son básicamente negros, pero esto es comúnmente evidente solo cuando las partículas metálicas son tan pequeñas que no se establece la estructura de la banda.
El color distintivo del oro es una consecuencia de la teoría de la relatividad especial de Einstein que actúa sobre el impulso extremadamente alto de los electrones de la capa interna, aumentando su masa y haciendo que los orbitales se contraigan. Los electrones externos (5d) se ven menos afectados, y esto da lugar a una mayor absorción de luz azul, lo que resulta en una mayor reflexión de la luz amarilla y roja.
Efecto Termiónico
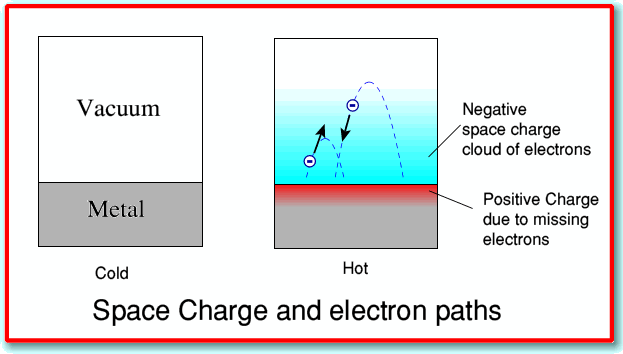
Los electrones dentro del fluido electrónico tienen una distribución de velocidades muy parecida a la de las moléculas en un gas. Cuando un metal se calienta suficientemente, una fracción de estos electrones adquirirá suficiente energía cinética para escapar del metal por completo; algunos de los electrones son esencialmente “evaporados” del metal. Este efecto termiónico, que fue observado por primera vez por Thomas Edison, fue utilizado en tubos de vacío que sirvieron como base de la electrónica desde su inicio alrededor de 1910 hasta que los semiconductores se volvieron dominantes en la década de 1960.
Estructura de Banda de Metales
La mayoría de los metales están hechos de átomos que tienen una configuración externa de s 2, que esperaríamos que llenaran completamente la banda de MO que hemos descrito. Con la banda completamente llena y sin niveles vacíos por encima, no esperaríamos que elementos como el berilio fueran metálicos. Lo que sucede es que los orbitales p vacíos también se dividieron en una banda. Aunque la energía del orbital 2 p de un átomo de Be aislado es aproximadamente 160 kJ mayor que la del orbital de 2 s, la parte inferior de la banda de 2 p se solapa con la parte superior de la banda de 2 s, produciendo una banda de conducción continua que tiene abundancia de orbitales desocupados. Es sólo cuando estas bandas se llenan de electrones de 2 p que los elementos pierden su carácter metálico.
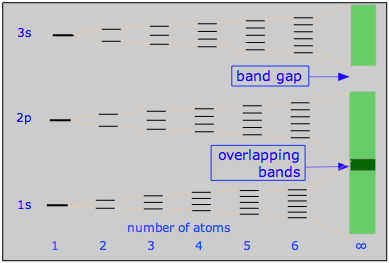
Este diagrama ilustra la estructura de bandas en un metal de 3 filas como Na o Mg, y cómo surge de la división MO en unidades muy pequeñas M 2 - M 6. Las bandas de conducción para la molécula “infinita” M N están sombreadas.
En la mayoría de los metales habrá bandas derivadas de los niveles atómicos s -, p - y d más externos, conduciendo a un sistema de bandas, algunas de las cuales se superpondrán como se describió anteriormente. Donde no se produce solapamiento, los niveles de energía casi continuos de las bandas están separados por una zona prohibida, o banda prohibida. Solo los orbitales atómicos más externos forman bandas; los orbitales internos permanecen localizados en los átomos individuales y no están involucrados en la unión.
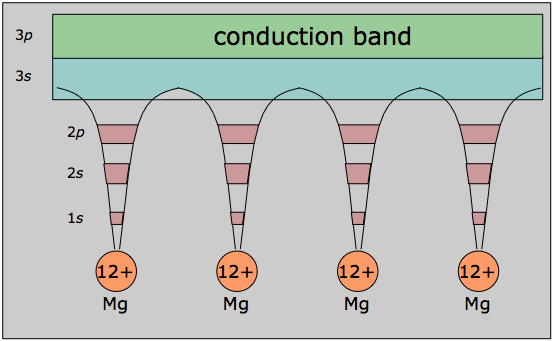
En su desarrollo matemático, el modelo de banda se basa fuertemente en la forma en que los electrones libres dentro del metal interactúan con la regularidad ordenada de la red cristalina. La visión alternativa aquí mostrada enfatiza este aspecto al mostrar los orbitales internos como localizados en los núcleos atómicos, mientras que los electrones de valencia están deslocalizados y pertenecen al metal en su conjunto, que en cierto sentido constituye una enorme molécula por derecho propio.


