9.9: Vinculación en Complejos de Coordinación
- Page ID
- 70650
Asegúrese de comprender a fondo las siguientes ideas esenciales:
- Definir los términos complejo de coordinación, ligando, polidentado y quelato.
- Explicar los orígenes de la división d -orbital; es decir, por qué las energías de ciertos orbitales atómicos son más afectadas por algunos ligandos que por otros en un complejo octaédrico.
- ¿Por qué muchos complejos de coordinación son altamente coloreados?
- Explicar el significado de los complejos de alto y bajo espín, e ilustrar de manera general cómo un conjunto particular de ligandos puede cambiar un tipo a otro. Además, describa cómo se observan estas diferencias experimentalmente.
- Describir el papel del hierro en el hemo y los componentes estructurales generales de la hemoglobina.
Complejos como el Cu (NH 3) 6 2+ se conocen y estudian desde mediados del siglo XIX. y sus estructuras habían sido elaboradas en su mayoría hacia 1900. Aunque el modelo orbital híbrido pudo explicar cómo las moléculas neutras como el agua o el amoníaco podían unirse a un ion de metal de transición, no pudo explicar muchas de las propiedades especiales de estos complejos. Finalmente, en 1940-60, se desarrolló un modelo conocido como teoría de campo de ligandos que es capaz de organizar y explicar la mayoría de las propiedades observadas de estos compuestos. Desde entonces, los complejos de coordinación han desempeñado un papel importante en la bioquímica celular y la catálisis inorgánica.
¿Qué es un Complejo?
Si has tomado un curso de laboratorio de química, es muy probable que hayas admirado el color azul profundo de los cristales de sulfato de cobre, CuSO 4 ·5H 2 O. El nombre propio de esta sustancia es sulfato de cobre (II) pentahidrato, y es típico de muchas sales que incorporan aguas de hidratación en sus estructuras cristalinas. También es un complejo, término utilizado por los químicos para describir una sustancia compuesta por otras dos sustancias (en este caso, CuSO 4 y H 2 O) cada una de las cuales es capaz de una existencia independiente.


La unión entre los componentes de un complejo suele ser más débil que un enlace químico regular; así, la mayoría de los hidratos sólidos se pueden descomponer calentando, expulsando el agua y produciendo la sal anhidra:
\[\underbrace{\ce{CuSO4 \cdot 5 H2O}}_{\text{blue}} \rightarrow \underbrace{\ce{CuSO_{4 (s)}}}_{\text{white}} + 5 H_2O\]
Alejarse del agua de esta manera también destruye el color, convirtiéndolo de un hermoso azul profundo a un blanco anodino. Si la sal anhidra ahora se disuelve en agua, el color azul ahora invade toda la solución. Es evidente que la presencia de agua es de alguna manera necesaria para que el ion cobre (II) adquiera un color azul, pero ¿por qué debería ser esto?
-sulfate.jpg)
Un experimento de laboratorio muy común que la mayoría de los estudiantes realizan es agregar algo de amoníaco diluido a una solución de sulfato de cobre. Al principio, la solución se vuelve lechosa ya que el amoníaco alcalino provoca la precipitación de hidróxido de cobre:
\[\ce{Cu^{2+} + 2 OH^{–} \rightarrow Cu(OH)2 (s)}\]
Sin embargo, si se agrega más amoníaco, la turbidez desaparece y la solución asume un intenso color azul profundo que hace que la solución original parezca pálida en comparación. La ecuación para esta reacción generalmente se da como
\[\ce{Cu^{2+} + 6 NH3 \rightarrow Cu(NH3)6^{2+} } \label{ammine}\]
El nuevo producto se conoce comúnmente como el ion complejo cobre-amoniaco, o más oficialmente, ion complejo hexammino-cobre (II).
\(\ref{ammine}\)La ecuación es algo engañosa, sin embargo, ya que implica la formación de un nuevo complejo donde ninguno existía antes. De hecho, desde alrededor de 1895, se sabe que los iones de la mayoría de los metales de transición se disuelven en agua para formar complejos con el agua misma, por lo que una mejor representación de la reacción del cobre disuelto con amoníaco sería
\[\ce{Cu(H2O)6^{2+} + 6 NH3 \rightarrow Cu(NH3)6^{2+} + 6 H2O}\]
En efecto, el amoníaco se une más fuertemente al ion cobre que el agua, y así desplaza a este último cuando entra en contacto con el ion hexaacuocobre (II), ya que la forma disuelta de Cu 2 + se conoce adecuadamente.
La mayoría de los metales de transición se disuelven en agua para formar complejos con el agua misma
Los fundamentos de los Complejos de Coordinación
Si bien nuestro enfoque principal en esta unidad es el vínculo, el tema de los complejos de coordinación es tan importante en química y bioquímica que merece la pena conocer algunas de sus características básicas, aunque su química detallada esté más allá del alcance de este curso. Estos complejos juegan un papel especialmente crucial en fisiología y bioquímica. Así hemo, el componente portador de oxígeno de los glóbulos rojos (y la fuente del color rojo) es básicamente un complejo de hierro, y la parte de la clorofila que convierte la luz solar en energía química dentro de las plantas verdes es un complejo de magnesio.
Algunas Definiciones
Ya hemos definido un complejo como una sustancia compuesta por dos o más componentes capaces de una existencia independiente. Un complejo de coordinación es aquel en el que un átomo o ion central se une a uno o más ligandos (ligare latino, para atar) a través de lo que se denomina un enlace covalente coordinado en el que ambos electrones de unión son suministrados por el ligando. En tal complejo el átomo central actúa como un aceptor de pares de electrones (ácido de Lewis —piense en H + que no tiene electrones en absoluto, pero puede aceptar un par de algo así como Cl —) y el ligando como un donador de pares de electrones (base de Lewis). El átomo central y los ligandos coordinados al mismo constituyen la esfera de coordinación. Así, la sal [Co (NH 3) 5 Cl] Cl 2 está compuesta por el ion complejo [Co (NH 3) 5 Cl] 2+ y dos iones Cl —; los componentes dentro de los corchetes se encuentran dentro de la esfera de coordinación, mientras que los dos iones cloruro están situado fuera de la esfera de coordinación. Estos dos últimos iones podrían ser reemplazados por otros iones como el NO 3 —sin cambiar materialmente de otra manera la naturaleza de la sal.

Los átomos centrales de los complejos de coordinación suelen ser cationes (iones positivos), pero en algunos casos pueden ser átomos neutros, como en el níquel carbonilo Ni (CO) 4.
Los ligandos compuestos por iones como F —o moléculas pequeñas como H 2 O o CN — poseen más de un conjunto de electrones de pares solitarios, pero solo uno de estos pares puede coordinarse con un ion central. Se dice que tales ligandos son monodentados (“un diente”.) Los ligandos más grandes pueden contener más de un átomo capaz de coordinarse con un solo ion central, y se describen como polidentados. Así, la etilendiamina (que se muestra a continuación) es un ligando bidentado. Los ligandos polidentados cuya geometría les permite ocupar más de una posición coordinante de un ion central actúan como agentes quelantes (griego χελος, chelos, garra) y tienden a formar complejos extremadamente estables conocidos como quelatos.
La quelación es ampliamente empleada en medicina, tratamiento de agua, química analítica e industria para unir y eliminar iones metálicos de tipos particulares. Algunos de los ligandos más comunes (agentes quelantes) se muestran aquí: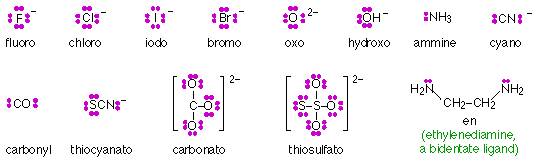
Estructura y unión en complejos de metales de transición
Complejos como Cu (NH 3) 6 2+ se conocen y estudian desde mediados del siglo XIX. Por qué deberían formarse, o cuáles podrían ser sus estructuras, eran misterios completos. En ese momento se pensaba que todos los compuestos inorgánicos se mantenían unidos por cargas iónicas, pero los ligandos como el agua o el amoníaco son, por supuesto, eléctricamente neutros. Se inventaron diversas teorías como la existencia de “valencias secundarias”, y se propusieron diversas estructuras en forma de cadena como CuNH 3 -NH 3 -NH 3 -NH 3 -NH 3 -NH 3 -NH 3 -NH 3. Finalmente, a mediados de la década de 1890, después de una serie de minuciosos experimentos, el químico Alfred Werner (suizo, 1866-1919) presentó la primera teoría viable de estructuras iónicas complejas.
Werner afirmó que su teoría le llegó por primera vez en un instante después de una noche de sueño reparador; al final del día siguiente había escrito su artículo histórico que finalmente le valió el Premio Nobel de Química de 1913.
Werner pudo demostrar, a pesar de una considerable oposición, que los complejos de metales de transición consisten en un ion central rodeado por ligandos en una disposición cuadrado-planar, tetraédrica u octaédrica. Este fue un logro especialmente impresionante en un tiempo mucho antes de que la difracción de rayos X y otros métodos estuvieran disponibles para observar estructuras directamente. Su método básico fue hacer inferencias de las estructuras a partir de un cuidadoso examen de la química de estos complejos y particularmente de la existencia de isómeros estructurales. Por ejemplo, la existencia de dos compuestos distintos AX 4 que tienen la misma composición muestra que su estructura debe ser cuadrado-planar en lugar de tetraédrica.
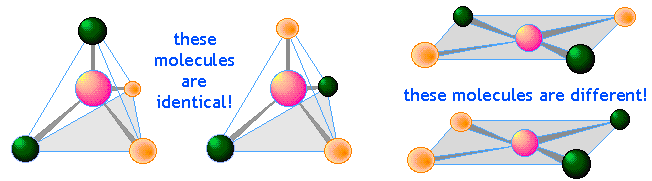
¿Qué los mantiene unidos?
Una comprensión de la naturaleza del enlace entre el ion central y sus ligandos tendría que esperar el desarrollo de la teoría de pares de electrones compartidos de Lewis y la imagen de enlace de valencia de Pauling. Ya hemos mostrado cómo la hibridación de los orbitales d del ion central crea vacantes capaces de acomodar uno o más pares de electrones no compartidos en los ligandos. Aunque estos modelos predicen correctamente las estructuras de muchos complejos de metales de transición, son por sí mismos incapaces de dar cuenta de varias de sus propiedades especiales:
- Los enlaces metal a ligando son generalmente mucho más débiles que los enlaces covalentes ordinarios;
- Algunos complejos utilizan orbitales d “internos” del ion central, mientras que otros son complejos “orbitales externos”;
- Los iones de metales de transición tienden a ser intensamente coloreados.
Paramagnetismo de los complejos de coordinación
Los electrones desapareados actúan como pequeños imanes; si una sustancia que contiene electrones desapareados se coloca cerca de un imán externo, sufrirá una atracción que tiende a atraerla hacia el campo. Se dice que tales sustancias son paramagnéticas, y el grado de paramagnetismo es directamente proporcional al número de electrones desapareados en la molécula. Los estudios magnéticos han desempeñado un papel especialmente destacado en la determinación de cómo se distribuyen los electrones entre los diversos orbitales en los complejos de metales de transición.
Los estudios de este tipo se llevan a cabo colocando una muestra que consiste en una solución del complejo entre los polos de un electroimán. La muestra se suspende del brazo de una balanza sensible, y el cambio de peso aparente se mide con el imán encendido y apagado. Un aumento en el peso cuando se enciende el imán indica que la muestra es atraída hacia el imán (paramagnetismo) y por lo tanto debe poseer uno o más electrones desapareados. El número preciso se puede determinar calibrando el sistema con una sustancia cuya configuración electrónica es conocida.
Teoría de campos cristalinos
El modelo actual de vinculación en complejos de coordinación se desarrolló gradualmente entre 1930-1950. En sus etapas iniciales, el modelo era puramente electrostático conocido como teoría del campo cristalino que trata a los iones ligandos como simples cargas puntuales que interactúan con los cinco orbitales d atómicos del ion central. Es esta teoría la que describimos a continuación.
Es notable que este modelo bastante primitivo, bastante inocente de la mecánica cuántica, haya funcionado tan bien. Sin embargo, un modelo mejorado y más completo que incorpora la teoría orbital molecular se conoce como teoría de campo de ligandos. En un átomo aislado de metal de transición, los cinco orbitales d más exteriores tienen la misma energía que depende únicamente del campo eléctrico esféricamente simétrico debido a la carga nuclear y a los otros electrones del átomo. Supongamos ahora que este átomo se convierte en un catión y se coloca en solución, donde forma una especie hidratada en la que seis moléculas de H 2 O se coordinan al ion central en una disposición octaédrica. Un ejemplo de tal ion podría ser hexaaquotitanio (III), Ti (H 2 O) 6 3+.
Los ligandos (H 2 O en este ejemplo) están unidos al ion central por pares de electrones aportados por cada ligando. Debido a que los seis ligandos están ubicados en las esquinas de un octaedro centrado alrededor del ion metálico, estos pares de electrones son equivalentes a nubes de carga negativa que se dirigen desde cerca del ion central hacia las esquinas del octaedro. Llamaremos a esto un campo eléctrico octaédrico, o el campo ligando.
división orbital d
Las diferentes formas de los cinco tipos de orbitales d hacen que interactúen de manera diferente con los campos eléctricos creados por los ligandos coordinados. Este diagrama (de un sitio químico de Purdue U.) muestra contornos de cinco tipos de orbitales d.
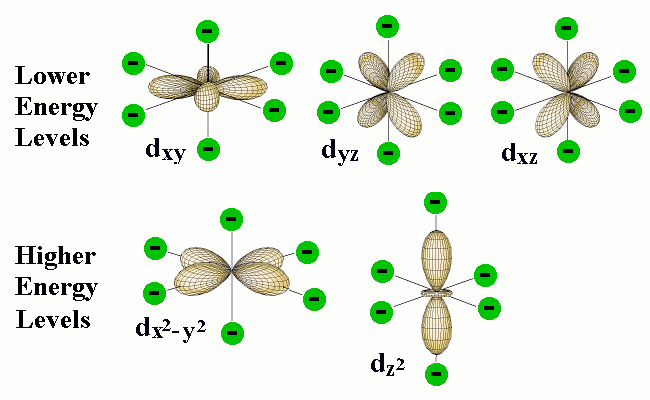
Los círculos verdes representan los pares de electrones coordinantes de los ligandos ubicados en las seis esquinas del octaedro alrededor del átomo central. Los dos orbitales d en la parte inferior tienen regiones de alta densidad de electrones que apuntan directamente hacia los orbitales del ligando; la repulsión electrón-electrón resultante eleva la energía de estos orbitales d.
Aunque los cinco d orbitales del átomo central tienen todos la misma energía en un campo esféricamente simétrico, sus energías no serán todas las mismas en el campo octaédrico impuesto por la presencia de los ligandos. La razón de esto es evidente cuando consideramos las diferentes propiedades geométricas de los orbitales de cinco d. Dos de los orbitales d, designados d x 2 y d x 2 - y 2, tienen sus nubes de electrones apuntando directamente hacia los átomos del ligando. Esperaríamos que cualquier electrón que ocupe estos orbitales estaría sujeto a repulsión por los pares de electrones que unen los ligandos que están situados en las esquinas correspondientes del octaedro. Como consecuencia, las energías de estos dos d orbitales se elevarán en relación con los otros tres d orbitales cuyos lóbulos no están dirigidos hacia las posiciones octaédricas.
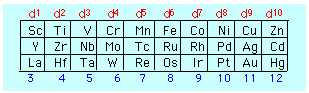
El número de electrones en el orbital d del átomo central se determina fácilmente a partir de la ubicación del elemento en la tabla periódica, tomando en cuenta, por supuesto, el número de electrones eliminados para formar el ion positivo.
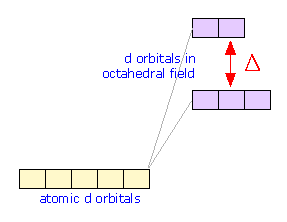
El efecto del campo de ligando octaédrico debido a los pares de electrones del ligando es dividir los orbitales d en dos conjuntos cuyas energías difieren en una cantidad denotada por Δ (“delta”) que se conoce como la energía de división orbital d. Tenga en cuenta que ambos conjuntos de orbitales d de iones centrales son repelidos por los ligandos y ambos se elevan en energía; el conjunto superior simplemente se eleva en una mayor cantidad. Tanto el desplazamiento energético total como Δ son fuertemente dependientes de los ligandos particulares.
¿Por qué los complejos de metales de transición suelen ser altamente coloreados
Volviendo a nuestro ejemplo de Ti (H 2 O) 6 3+, observamos que Ti tiene una configuración externa de 4s 2 3d 2, por lo que Ti 3 + será un ion d 1. Esto significa que en su estado fundamental, un electrón ocupará el grupo inferior de d orbitales, y el grupo superior estará vacío. La división d -orbital en este caso es de 240 kJ por mol lo que corresponde a luz de color azul-verde; la absorción de esta luz promueve el electrón al conjunto superior de orbitales d, lo que representa el estado de salida del complejo. Si iluminamos una solución de Ti (H 2 O) 6 3+ con luz blanca, se absorbe la luz azul-verde y la solución aparece de color violeta.
.gif)
_complexes_in_aqueous_solution.jpg)
Complejos de espín alto y bajo
La magnitud de la división orbital d depende fuertemente de la naturaleza del ligando y en particular de cuán fuerte es producido un campo electrostático por su enlace de par de electrones al ion central.
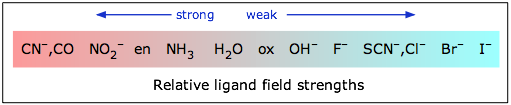
Si Δ no es demasiado grande entonces los electrones que ocupan los orbitales d lo hacen con sus espines desapareados hasta que se alcanza una configuración d 5, tal como ocurre en la secuencia normal de Aufbau para las configuraciones de electrones atómicos. Así, un ligando de campo débil como H 2 O conduce a un complejo de “alto espín” con Fe (II).
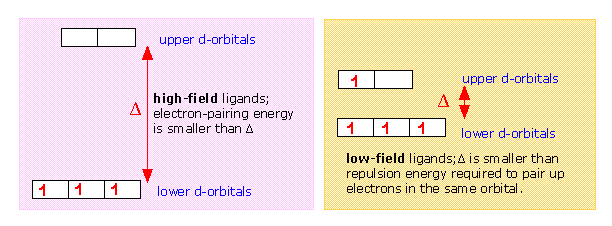
En contraste con esto, el ion cianuro actúa como un ligando de campo fuerte; la división orbital d es tan grande que es energéticamente más favorable para que los electrones se emparejen en el grupo inferior de orbitales d en lugar de ingresar al grupo superior con espines desapareados. Así, el hexacianohierro (II) es un complejo de “bajo giro”, en realidad cero, en este caso particular.
Diferentes patrones de división orbital d ocurren en geometrías de coordinación plana cuadrada y tetraédrica, por lo que es posible un gran número de arreglos. En la mayoría de los complejos el valor de Δ corresponde a la absorción de luz visible, teniendo en cuenta la naturaleza coloreada de muchos de estos compuestos en solución y en sólidos como\(\ce{CuSO4·5H2O}\) () Figura\(\PageIndex{1}\).
Complejos de Coordinación en Bioquímica
Aproximadamente un tercio de los elementos químicos están presentes en organismos vivos. Muchos de estos son iones metálicos cuya función dentro de la célula depende de la formación de complejos de coordinación d -orbitales con moléculas pequeñas como las porfirinas (ver más adelante). Estos complejos están unidos en sí mismos dentro de proteínas (metaloproteínas) que proporcionan un ambiente local que es esencial para su función, que es transportar o almacenar moléculas diatómicas (oxígeno u óxido nítrico), transferir electrones en procesos de oxidación-reducción, o catalizar un reacción química. Los más comunes utilizan complejos de Fe y Mg, pero otros metales micronutrientes como Cu, Mn, Mo, Ni, Se y Zn también son importantes.
Hemoglobina
La hemoglobina es una de un grupo de proteínas hemo que incluye mioglobina, citocromo-C y catalasa. La hemoglobina realiza la tarea esencial de transportar moléculas de dioxígeno desde los pulmones hasta los tejidos en los que se utiliza para oxidar la glucosa, sirviendo esta oxidación como fuente de energía requerida para los procesos metabólicos celulares.
La hemoglobina consiste en cuatro subunidades de proteína globina (representadas por diferentes colores en este diagrama) unidas por fuerzas intermoleculares débiles. Cada una de estas subunidades contiene, enterrada en su interior, una molécula de hemo, que sirve como sitio activo de transporte de oxígeno. La presencia de hemoglobina aumenta la capacidad de transporte de oxígeno de 1 litro de sangre de 5 a 250 ml. La hemoglobina también está involucrada en la regulación del pH sanguíneo y el transporte de CO 2.
El hemo en sí consiste en un átomo de hierro coordinado a una porfirina tetradentada. Cuando está en el ferroso (estado Fe 2+) el hierro se une al oxígeno y se convierte en Fe 3 +. Debido a que una molécula de hemo desnudo se oxidaría por el oxígeno sin unirse a él, el aducto debe ser estabilizado por la proteína globina circundante. En este ambiente, el hierro se coordina octaédrialmente a través de la unión a un componente de la proteína en una quinta posición, y en la sexta posición ya sea por una molécula de oxígeno o por una molécula de agua, dependiendo de si la hemoglobina está en su estado oxigenado (en arterias) o estado desoxigenado (en venas).
La molécula hemo (púrpura) está enplegada dentro de la cadena polipeptídica como se muestra aquí. La molécula de hemoglobina completa contiene cuatro de estas subunidades, y las cuatro deben estar presentes para que funcione. La unión de O 2 al hemo en la hemoglobina no es un simple equilibrio químico; la eficiencia de unión está regulada por las concentraciones de H +, CO 2 y fosfatos orgánicos. Es notable que los sitios de unión para estas sustancias están en las partes externas de las unidades de globina, muy alejadas del hemo. El mecanismo de este exquisito control molecular a distancia surge del hecho de que el ion Fe 2+ es demasiado grande para caber dentro de la porfirina, por lo que se asienta ligeramente fuera del plano de la porfirina. Este radio de Fe disminuye cuando se oxigena, lo que le permite moverse hacia el plano. Al hacerlo, tira del componente proteico al que se une con él, desencadenando una secuencia de cambios estructurales que se extienden por toda la proteína.
La mioglobina es otra proteína hemo importante que se encuentra en los músculos. A diferencia de la hemoglobina, que consta de cuatro subunidades proteicas, la mioglobina se compone de una sola unidad. Su función principal es actuar como reservorio de almacenamiento de oxígeno, permitiendo una actividad muscular vigorosa a un ritmo que no podría ser sostenido por la entrega de oxígeno a través del torrente sanguíneo. La mioglobina es la responsable del color rojo de la carne. La cocción de la carne libera el O 2 y oxida el hierro al estado +3, cambiando el color a marrón.
Intoxicación por monóxido
Otros ligandos, notablemente el ion cianuro y el monóxido de carbono, son capaces de unirse a la hemoglobina mucho más fuertemente que el hierro, desplazándola y haciendo que la hemoglobina sea incapaz de transportar oxígeno. El aire que contiene tan poco como 1 por ciento de CO convertirá la hemoglobina en carboxihemoglobina en pocas horas, lo que lleva a la pérdida del conocimiento y la muerte. Incluso pequeñas cantidades de monóxido de carbono pueden conducir a reducciones sustanciales en la disponibilidad de oxígeno. La concentración de 400 ppm de CO en el humo del cigarrillo amarrará alrededor del 6% de la hemoglobina en los fumadores empedernidos; se cree que el aumento del estrés que esto coloca en el corazón ya que trabaja más duro para compensar el déficit de oxígeno es una de las razones por las que los fumadores tienen un mayor riesgo de sufrir ataques cardíacos. El CO se une a la hemoglobina 200 veces más fuertemente que lo hace\(O_2\).
Clorofila
La clorofila es el pigmento de recolección de luz presente en las plantas verdes. Su nombre proviene de la palabra griega χλορος (cloros), que significa “verde” - la misma raíz de la que el cloro recibe su nombre. La clorofila consiste en un ligando tetradentado en forma de anillo conocido como porfina coordinado con un ion magnesio central. Un residuo de histidina de uno de varios tipos de proteínas asociadas forma un quinto enlace coordinado con el átomo de Mg.
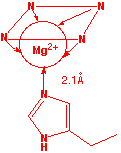
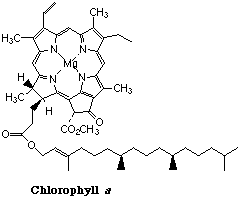
La energía luminosa atrapada por la clorofila es utilizada para impulsar una secuencia de reacciones cuyo efecto neto es lograr la reducción de CO 2 a glucosa (C 6 H 12 O 6) en un proceso conocido como fotosíntesis que sirve como combustible para todos los procesos de vida en ambos plantas y animales.


