10.1: Introducción a los ácidos y bases
- Page ID
- 70839
Asegúrese de comprender a fondo las siguientes ideas esenciales que se han presentado anteriormente.
- Sugiera pruebas simples que podrías realizar para determinar si una sustancia desconocida es un ácido o una base.
- Indicar las definiciones químicas de un ácido y una base en términos de su comportamiento en el agua.
- Escribe la fórmula de la sal que se forma cuando se combinan un ácido y una base dados.
Los conceptos de un ácido, una base y una sal son muy antiguos que han experimentado varios refinamientos importantes a medida que la ciencia química ha evolucionado. Nuestro tratamiento del tema en esta etapa será principalmente conceptual y cualitativo, enfatizando las definiciones e ideas fundamentales asociadas a ácidos y bases. No cubriremos cálculos que involucren equilibrios ácido-base en estas lecciones.
1 Ácidos
El término ácido se utilizó por primera vez en el siglo XVII; proviene de la raíz latina ac -, que significa “agudo”, como en el acetum, vinagre. Algunos autores tempranos sugirieron que las moléculas ácidas podrían tener esquinas afiladas o proyecciones similares a las espinas que irritan la lengua o la piel. Los ácidos han sido reconocidos desde hace mucho tiempo como una clase distintiva de compuestos cuyas soluciones acuosas exhiben las siguientes propiedades:
- Un sabor agrio característico (¡piensa en el jugo de limón!) ;
- capacidad de cambiar el color de tornasol de azul a rojo;
- reaccionar con ciertos metales para producir H 2 gaseoso;
- reaccionar con bases para formar una sal y agua.
Nota: Litmas
El tornasol es un tinte natural que se encuentra en ciertos líquenes. El nombre es de origen escandinavo, por ejemplo lit (color) + mosi (musgo) en islandés. “Prueba de tornasol” ha adquirido un significado que trasciende tanto a la Química como a la ciencia para denotar cualquier tipo de prueba dando una respuesta de sí/no.
Cómo se llamó mal el oxígeno
La primera definición de ácido basada en la química resultó ser errónea: en 1787, Antoine Lavoisier, como parte de su magistral clasificación de sustancias, identificó a los ácidos conocidos como un grupo separado de las “sustancias complejas” (compuestos). Su carácter especial, postuló, derivaba de la presencia de algún elemento común que encarna el principio de “acidez”, al que denominó oxígeno, derivado del griego por “formador ácido”.
Nota
Lavoisier había asignado recientemente este nombre al nuevo elemento gaseoso que José Sacerdotal había descubierto unos años antes como la sustancia esencial que soporta la combustión. Muchos productos de combustión (óxidos) dan soluciones ácidas, y el oxígeno de hecho está presente en la mayoría de los ácidos, por lo que el error de Lavoisier es comprensible. En 1811 Humphrey Davy demostró que el ácido muriático (clorhídrico) (que Lavoisier había considerado como un elemento) no contiene oxígeno, pero esto simplemente convenció a algunos de que el cloro no era un elemento sino un compuesto que contenía oxígeno. Aunque en 1830 se habían descubierto una docena de ácidos libres de oxígeno, no fue hasta alrededor de 1840 que la teoría del hidrógeno de los ácidos llegó a ser generalmente aceptada. Para entonces, el nombre inapropiado de oxígeno estaba demasiado bien establecido como un nombre para ser cambiado. La raíz oxy proviene de la palabra griega ονς, que significa “agrio”.
2 Ácidos y el ión hidrógeno
La clave para comprender los ácidos (así como las bases y sales) tuvo que esperar el descubrimiento de Michael Faraday a mediados del siglo XIX de que las soluciones de sales (conocidas como electrolitos) conducen la electricidad. Esto implica la existencia de partículas cargadas que pueden migrar bajo la influencia de un campo eléctrico. Faraday nombró a estas partículas iones (“vagabundos”). Estudios posteriores sobre soluciones electrolíticas sugirieron que las propiedades que asociamos con los ácidos se deben a la presencia de un exceso de iones de hidrógeno en la solución. Para 1890 el químico sueco Svante Arrhenius (1859-1927) pudo formular la primera teoría útil de los ácidos:
Arrhenius Definición
“una sustancia ácida es aquella cuya unidad molecular contiene al menos un átomo de hidrógeno que puede disociarse, o ionizarse, cuando se disuelve en agua, produciendo un ión hidrógeno hidratado y un anión”.
| ácido clorhídrico | HCl → H + (aq) + Cl — (aq) |
| ácido sulfúrico | H 2 SO 4 → H + (aq) + HSO 4 — (aq) |
| ion de sulfito de hidrógeno | HSO 3 — (aq) → H + (aq) + SO 3 2— (aq) |
| ácido acético | H 3 CCOOH → H + (aq) + H 3 CCOO — (aq) |
Estrictamente hablando, un “ácido de Arrhenius” debe contener hidrógeno. Sin embargo, hay sustancias que por sí mismas no contienen hidrógeno, pero que aún producen iones hidrógeno cuando se disuelven en agua; los iones hidrógeno provienen del agua misma, por reacción con la sustancia.
Definición de un ácido
Un ácido es una sustancia que produce un exceso de iones de hidrógeno cuando se disuelve en agua.Hay tres puntos importantes que hay que entender sobre el hidrógeno en los ácidos:
- Aunque todos los ácidos de Arrhenius contienen hidrógeno, no todos los átomos de hidrógeno de una sustancia son capaces de disociarse; así los hidrógenos —CH 3 del ácido acético son “no ácidos”. Una parte importante de conocer la química es poder predecir qué átomos de hidrógeno en una sustancia podrán disociarse en iones de hidrógeno.
- Aquellos hidrógenos que sí se disocian pueden hacerlo en diferentes grados. Los ácidos fuertes como HCl y HNO 3 están efectivamente disociados al 100% en solución. La mayoría de los ácidos orgánicos, como el ácido acético, son débiles; solo una pequeña fracción del ácido se disocia en la mayoría de las soluciones. El HF y el HCN son ejemplos de ácidos inorgánicos débiles.
- Los ácidos que poseen más de un átomo de hidrógeno disociable se conocen como ácidos polipróticos; H 2 SO 4 y H 3 PO 4 son ejemplos bien conocidos. Las formas intermedias como la HPO 4 2—, que son capaces tanto de aceptar como de perder protones, se llaman anfolitos.
| H 2 SO 4 ácido sulfúrico |
→ | HSO 4 — ion sulfato de hidrógeno (“bisulfato”) | → | SO 4 2— ion sulfato |
||
Ácido hidrosulfúrico H 2 S |
→ | HS — ion hidrosulfuro |
→ |
S 2— ion |
||
| H 3 PO 4 ácido fosfórico |
→ | H 2 PO 4 — ion dihidrógeno fosfato |
→ | HPO 4 2— ión fosfato de hidrógeno |
→ | PO 4 3— ion fosfato |
| Ácido oxálico HOOC-COOH |
→ | HOOC-COO — ion de oxalato de hidrógeno |
→ | — OOC-COO — ion oxalato |
Descubrirás en una sección posterior de esta lección que los iones de hidrógeno no pueden existir como tales en el agua, ¡pero no entres en pánico! Resulta que a los químicos todavía les resulta conveniente fingir como si estuvieran presentes, y escribir reacciones que los incluyan.
3 Bases
El nombre base se ha asociado durante mucho tiempo con una clase de compuestos cuyas soluciones acuosas se caracterizan por:
- un sabor amargo;
- una sensación “jabonosa” cuando se aplica a la piel
- capacidad para restaurar el color azul original del tornasol que se ha vuelto rojo por los ácidos
- capacidad de reaccionar con ácidos para formar sales.
- reaccionar con ciertos metales para producir H 2 gaseoso
Nota
Así como un ácido es una sustancia que libera iones de hidrógeno en solución, una base produce iones hidróxido cuando se disuelve en agua:
NaOH (s) → Na + (ac) + OH — (aq)
El hidróxido de sodio es una base de Arrhenius porque contiene iones hidróxido. Sin embargo, otras sustancias que no contienen iones hidróxido pueden producirlos por reacción con el agua y, por lo tanto, también se clasifican como bases. Dos clases de tales sustancias son los óxidos metálicos y los compuestos de hidrógeno de ciertos no metales:
Na 2 O (s) + H 2 O → [2 NaOH] → 2 Na + (aq) + 2 OH — (aq)
NH 3 + H 2 O → NH 4 + (aq) + OH — (aq)
Definición de una base
Una base es una sustancia que produce un exceso de iones hidróxido cuando se disuelve en agua.4 Neutralización
Los ácidos y bases reaccionan entre sí para producir dos productos: agua y un compuesto iónico conocido como sal. Este tipo de reacción se llama reacción de neutralización.
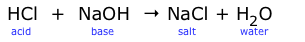
Esta ecuación “molecular” es conveniente de escribir, pero necesitamos re-lanzarla como una ecuación iónica neta para revelar lo que realmente está sucediendo aquí cuando la reacción tiene lugar en el agua, como es casi siempre el caso.
H + Cl — + Na + + OH — → Na + + Cl — + H 2 O
Si cancelamos los iones que aparecen en ambos lados (y por lo tanto no participamos realmente en la reacción), nos quedamos con la ecuación neta
H + (aq) + OH — (aq) → H 2 O (1)
que es el proceso fundamental que se da en todas las reacciones de neutralización.
Nota
La confirmación de que esta ecuación describe todas las reacciones de neutralización que tienen lugar en el agua es proporcionada por experimentos que indican que no importa qué ácido y base se combinen, todas liberan la misma cantidad de calor (57.7 kJ) por mol de H + neutralizado.
En el caso de un ácido débil, o una base que no sea muy soluble en agua, podría requerirse más de un paso. Por ejemplo, una reacción similar puede ocurrir entre el ácido acético y el hidróxido de calcio para producir acetato de calcio:
2 CH 3 COOH + Ca (OH) 2 → CH 3 COOCA + 2 H 2 O
Si esto ocurre en solución acuosa, la reacción es realmente entre las cantidades muy pequeñas de H + y OH —resultantes de la disociación del ácido y la disolución de la base, por lo que la reacción es idéntica a la Ecuación 1:
H + (aq) + OH — (aq) → H 2 O
Si, por otro lado, añadimos hidróxido de calcio sólido al ácido acético líquido puro, la reacción neta incluiría ambos reactivos en sus formas “moleculares”:
2 CH 3 COOH (l) + Ca (OH) 2 (s) → 2 CH 3 COO — + Ca 2 + + 2 H 2 O
La “sal” que se produce en una reacción de neutralización consiste simplemente en el anión y catión que ya estaban presentes. La sal se puede recuperar como un sólido evaporando el agua.


