10.2: Soluciones Acuosas- pH y Titulación
- Page ID
- 70864
Asegúrese de comprender a fondo las siguientes ideas esenciales que se han presentado anteriormente. Es especialmente importante que conozcas los significados precisos de todos los términos resaltados en el contexto de este tema.
- Definir el producto iónico del agua y conocer su valor de temperatura ambiente.
- Indicar los criterios, en términos de concentraciones de H + y OH —, de una solución ácida, alcalina y neutra.
- Dada la concentración efectiva de iones hidrógeno en una solución, calcular el pH. Por el contrario, encontrar la concentración de iones hidrógeno o hidróxido en una solución que tenga un pH dado.
- Encuentre el pH o PoH de una solución cuando se conozca cualquiera de ellos.
- Describir el proceso de titulación ácido-base y explicar la significación del punto de equivalencia.
- Esboce una curva de valoración típica para un ácido monoprótico o poliprótico.
Como verás en la lección que sigue a esta, el agua juega un papel esencial en la química ácido-base tal como la conocemos ordinariamente. Incluso a quienes saben muy poco de química, el término pH se reconoce como una medida de “acidez”, por lo que la mayor parte de esta unidad se dedica a la definición de pH y de la escala de pH. Pero dado que estos temas dependen íntimamente de las propiedades del agua y su capacidad sí se disocian en iones hidrógeno e hidroxilo, comenzamos nuestra discusión con este tema. Terminamos esta lección con una breve discusión sobre la valoración ácido-base, probablemente la operación de laboratorio de química más frecuentemente realizada en el mundo.
Disociación del agua
La capacidad de los ácidos para reaccionar con bases depende de la tendencia de los iones hidrógeno a combinarse con iones hidróxido para formar agua:
H + (aq) + OH — (aq) → H 2 O (1)
Esta tendencia pasa a ser muy grande, por lo que la reacción es prácticamente completa —pero no “completamente” completa; siempre estarán presentes algunos iones dispersos de H + y OH —. Y lo que es más, esto es cierto aunque comiences con el agua más pura que se pueda alcanzar. Esto significa que en agua pura, la reacción inversa, la “disociación” del agua
H 2 O → H + (aq) + OH — (aq) (2)
procederá en una medida muy leve. Ambas reacciones tienen lugar simultáneamente, pero (1) es mucho más rápido que (2) que solo se disocian una fracción minúscula de las moléculas de H 2 O.
Los líquidos que contienen iones son capaces de conducir una corriente eléctrica. El agua pura es prácticamente un aislante, pero experimentos cuidadosos muestran que incluso el agua más altamente purificada exhibe una conductividad muy ligera que corresponde a una concentración tanto del ion H + como de los iones OH — de casi exactamente 1.00 × 10 —7 mol L —1 a 25° C.
Todas las reacciones químicas que tienen lugar en una sola fase (como en una solución) son teóricamente “incompletas” y se dice que son reversibles.
Qué fracción de moléculas de agua en un litro de agua se disocian
Solución: 1 L de agua tiene una masa de 1000 g. El número de moles en 1000 g de H 2 O es
(1000 g)/(18 g mol —1) = 55.5 mol. Esto corresponde a (55.5 mol) (6.02E23 mol-1) = 3.34E25 H 2 O moléculas.
Un promedio de 10 -7 moles, o (10 -7) (6.02E23) = 6.0E16 H 2 O moléculas se disociarán en cualquier momento. Por lo tanto, la fracción de moléculas de agua disociadas es (6.0E16)/(3.3E25) = 1.8E—9.
Así podemos decir que sólo alrededor de dos de cada mil millones (10 9) de moléculas de agua serán disociadas.
Ion Producto del agua
El grado de disociación del agua es tan pequeño que quizás te preguntes por qué incluso se menciona aquí. La razón proviene de una importante relación que gobierna las concentraciones de iones H + y OH — en soluciones acuosas:
[H +] [OH —] = 1.00 × 10 —14 (3)
debe saber esto!
en el que los corchetes [] se refieren a las concentraciones (en moles por litro) de las sustancias que encierran.
Nota
La cantidad 1.00 x 10 —14 se denota comúnmente por K w. Su valor varía ligeramente con la temperatura, la presión y la presencia de otros iones en la solución.
Esta expresión se conoce como el producto iónico del agua, y se aplica a todas las soluciones acuosas, no solo al agua pura. Las consecuencias de esto son de largo alcance, porque implica que si la concentración de H + es grande, la de OH —será pequeña, y viceversa. Esto significa que los iones H + están presentes en todas las soluciones acuosas, no solo las ácidas.
Esto lleva a las siguientes definiciones importantes, que debes conocer:
| solución ácida | [H +] > [OH —] |
| solución alcalina (“básica”) | [H +] < [OH —] |
| solución neutra | [H +] = [OH —] = 1.00×10 —7 mol L —1 |
Tome nota especial de la siguiente definición:
Una solución neutra es aquella en la que las concentraciones de iones H + y OH — son idénticas.Los valores de estas concentraciones están restringidos por la Ec. 3. Así, en una solución neutra, tanto las concentraciones de iones hidrógeno como de hidróxido son 1.00 × 10 —7 mol L —1:
[H +] [OH —] = [1.00 × 10 —7] [1.00 × 10 —7] =1.00 × 10 —14
El ácido clorhídrico es un ácido fuerte típico que está totalmente disociado en solución:
HCl → H + (ac) + Cl — (aq)
Por lo tanto, una solución 1.0 M de HCl en agua no contiene realmente ninguna concentración significativa de moléculas de HCl; es una solución de H + y Cl —en la que las concentraciones de ambos iones son 1.0 mol L —1. La concentración de ión hidróxido en dicha solución, de acuerdo con la Ec 2, es
[OH —] = (K w)/[H +] = (1.00 x 10 —14)/(1 mol L —1) = 1.00 x 10 —14 mol L —1.
De igual manera, la concentración de ión hidrógeno en una solución hecha al disolver 1.0 mol de hidróxido de sodio en agua será de 1.00 x 10 —14 mol L —1.
2 pH
Cuando se trata de un rango de valores (como la variedad de concentraciones de iones de hidrógeno que se encuentran en la química) que abarca muchas potencias de diez, es conveniente representarlos en una escala logarítmica más comprimida. Por convención, utilizamos la escala de pH para denotar concentraciones de iones de hidrógeno:
pH = — log 10 [H +] (4) ¡debe saber esto!
o a la inversa, [H +] = 10 —pH.
 Esta notación fue ideada por el químico danés Soren Sorenson (1868-1939) en 1909. Hay varios relatos de por qué eligió “pH”; uno probable es que las letras significan el término francés pouvoir hydrogène, que significa “poder de hidrógeno "— “poder” en el sentido de un exponente. Desde entonces se ha vuelto común representar otras pequeñas cantidades en “notación p”. Dos que debes conocer en este curso son los siguientes:
Esta notación fue ideada por el químico danés Soren Sorenson (1868-1939) en 1909. Hay varios relatos de por qué eligió “pH”; uno probable es que las letras significan el término francés pouvoir hydrogène, que significa “poder de hidrógeno "— “poder” en el sentido de un exponente. Desde entonces se ha vuelto común representar otras pequeñas cantidades en “notación p”. Dos que debes conocer en este curso son los siguientes:
PoH = — log 10 [OH —]
p K w = — log K w (= 14 cuando K w = 1.00 × 10 —14)
Tenga en cuenta que el pH y el pOH se expresan como números sin ninguna unidad, ya que los logaritmos deben ser adimensionales.
Recordemos de la Eq. 3 que [H +] [OH —] = 1.00 × 10 —14; si escribimos esto en “p-notación” se convierte
pH + PoH = 14
(5) debe saber esto!
En una solución neutra a 25°C, pH = PoH = 7.0. A medida que aumenta el pH, el PoH disminuye; un pH mayor corresponde a una solución alcalina, un pH menor a una solución ácida. En una solución con [H +] = 1 M, el pH sería 0; en una solución 0.00010 M de H +, sería 4.0. De igual manera, una solución 0.00010 M de NaOH tendría un PoH de 4.0, y por lo tanto un pH de 10.0. Es muy importante que entiendas a fondo la escala de pH, y sea capaz de convertir entre [H +] o [OH —] y pH en ambas direcciones.
El pH de la sangre debe mantenerse muy cerca de 7.40. Encuentra la concentración de iones hidróxido que corresponde a este pH.
Solución: El PoH será (14.0 — 7.40) = 6.60.
[OH —] = 10 —PoH = 10 —6.6 = 2.51 x 10 —7 M
La escala de pH
El rango de posibles valores de pH va de aproximadamente 0 a 14.
La palabra “aproximadamente” en el enunciado anterior refleja el hecho de que a concentraciones muy altas (ácido clorhídrico 10 M o hidróxido de sodio, por ejemplo,) una fracción significativa de los iones se asociará en pares neutros como H + ·Cl —, reduciendo así la concentración de iones “disponibles” a un valor menor que llamaremos la concentración efectiva. Es la concentración efectiva de H + y OH —la que determina el pH y el PoH. Para soluciones en las que las concentraciones de iones no superan 0.1 M, las fórmulas pH = —log [H +] y pOH = —log [OH —] son generalmente confiables, ¡pero no esperes que una solución 10.0 M de un ácido fuerte tenga un pH exactamente de —1.00!

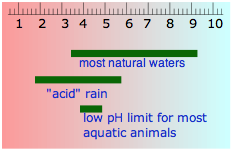
La tabla que se muestra aquí te ayudará a darte una sensación general de dónde caen las sustancias comunes en la escala de pH. Observe especialmente que
- la mayoría de los alimentos son ligeramente ácidos;
- los principales “fluidos corporales” son ligeramente alcalinos, al igual que el agua de mar, no es sorprendente, ya que la vida animal temprana comenzó en los océanos.
- el pH del agua recién destilada se desplazará hacia abajo a medida que absorba el dióxido de carbono del aire; el CO 2 reacciona con el agua para producir ácido carbónico, H 2 CO 3.
- el pH del agua que ocurre en la naturaleza varía en un amplio rango. Las aguas subterráneas suelen recoger CO 2 adicional respirado por los organismos en el suelo, pero también pueden llegar a ser alcalinas si están en contacto con sedimentos que contienen carbonato. La lluvia “ácida” es por definición más ácida que el agua pura en equilibrio con el CO 2 atmosférico, debido principalmente a los ácidos sulfúrico y nítrico que se originan a partir de las emisiones de combustibles fósiles de óxidos de nitrógeno y SO 2.
Indicadores de pH
Los colores de muchos compuestos similares a colorantes dependen del pH, y pueden servir como indicadores útiles para determinar si el pH de una solución está por encima o por debajo de cierto valor.
Tintes indicadores naturales
|
|
 Muchos pigmentos florales también dependen del pH. Es posible que hayas notado que las flores de algunas especies de arbustos de hortensias son azules cuando se cultivan en suelos ácidos, y blancas o rosadas en suelos alcalinos. Muchos pigmentos florales también dependen del pH. Es posible que hayas notado que las flores de algunas especies de arbustos de hortensias son azules cuando se cultivan en suelos ácidos, y blancas o rosadas en suelos alcalinos. |
El repollo rojo es un indicador popular de hágalo usted mismo.
Indicadores universales
La mayoría de los colorantes indicadores muestran solo un cambio de color, y por lo tanto solo son capaces de determinar si el pH de una solución es mayor o menor que el valor que es característico de un indicador en particular. Al combinar una variedad de tintes cuyos cambios de color ocurren a diferentes pH, se puede hacer un indicador “universal”. Los papeles de prueba de pH preparados comercialmente de este tipo están disponibles para rangos de pH amplios y estrechos.

Titulación
Dado que los ácidos y las bases reaccionan fácilmente entre sí, es experimentalmente bastante fácil encontrar la cantidad de ácido en una solución determinando cuántos moles de base se requieren para neutralizarla. Esta operación se llama titulación, y ya debes estar familiarizado con ella desde tu trabajo en el Laboratorio.
Podemos valorar un ácido con una base, o una base con un ácido. La sustancia cuya concentración estamos determinando (el analito) es la sustancia que se está valorando; la sustancia que estamos agregando en cantidades medidas es la titulante. La idea es agregar valorante hasta que el valorante haya reaccionado con todo el analito; en este punto, el número de moles de titulante añadido nos indica la concentración de base (o ácido) en la solución que se está valorando.
Se valoraron 36.00 ml de una solución de HCl con KOH 0.44 M. El volumen de solución de KOH requerido para neutralizar la solución ácida fue de 27.00 ml. ¿Cuál fue la concentración del HCl?
Solución: El número de moles de titulante agregado fue
(.027 L) (.44 mol L —1) = .0119 mol. Debido a que un mol de KOH reacciona con un mol de HCl, este es también el número de moles de HCl; por lo tanto, su concentración es de
(.0119 mol) ÷ (.036 L) = 0.33 M.
Curvas de valoración
El curso de una titulación se puede seguir trazando el pH de la solución en función de la cantidad de valorante añadido. La figura muestra dos curvas de este tipo, una para un ácido fuerte (HCl) y la otra para un ácido débil, ácido acético, denotado por Hac. Mirando primero la curva de HCl, observe cómo el pH cambia muy ligeramente hasta que el ácido está casi neutralizado. En ese punto, que corresponde a la parte vertical de la parcela, solo una gota adicional de solución de NaOH hará que el pH salte a un valor muy alto, casi tan alto como el de la solución de NaOH puro.
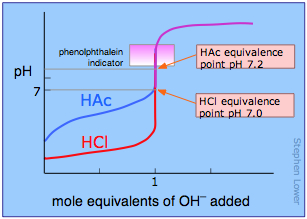
Comparar la curva para HCl con la de HAC. Para un ácido débil, el salto de pH cerca del punto de neutralización es menos empinado. Observe también que el pH de la solución en el punto de neutralización es mayor a 7. Estas dos características de la curva de titulación para un ácido débil son muy importantes para que las conozcas.
Si el ácido o base es poliprótico, habrá un salto en el pH por cada protón que se titule. En el ejemplo aquí mostrado, una solución de ácido carbónico H 2 CO 3 se titula con hidróxido de sodio. El primer punto de equivalencia (en el que el H 2 CO 3 se ha convertido completamente en ion bicarbonato HCO 3 —) ocurre a pH 8.3. La solución ahora es idéntica a la preparada disolviendo una cantidad idéntica de bicarbonato de sodio en agua.
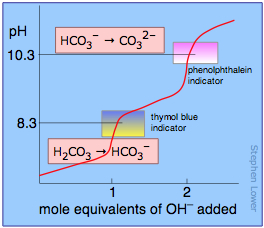
La adición de otro equivalente molar de ion hidróxido convierte el bicarbonato en ion carbonato y se completa a pH 10.3; se podría preparar una solución idéntica disolviendo la cantidad apropiada de carbonato de sodio en agua.
Encontrar el punto de equivalencia: indicadores
Cuando se ha agregado suficiente base para reaccionar completamente con los hidrógenos de un ácido monoprótico, se ha alcanzado el punto de equivalencia. Si se valoran un ácido fuerte y una base fuerte, el pH de la solución será 7.0 en el punto de equivalencia. Sin embargo, si el ácido es débil, el pH será mayor a 7; la solución “neutralizada” no será “neutra” en términos de pH. Para un ácido poliprótico, habrá un punto de equivalencia para cada hidrógeno valorable en el ácido. Estos suelen ocurrir a valores de pH que están separados entre 4 y 5 unidades, pero ocasionalmente están más cerca, en cuyo caso pueden no ser fácilmente evidentes en la curva de titulación.
La clave para una valoración exitosa es saber cuándo se ha alcanzado el punto de equivalencia. La forma más fácil de encontrar el punto de equivalencia es usar un tinte indicador; esta es una sustancia cuyo color es sensible al pH. Uno de esos indicadores que se encuentra comúnmente en el laboratorio es la fenolftaleína; es incolora en solución ácida, pero se vuelve intensamente roja cuando la solución se vuelve alcalina. Si se va a valorar un ácido, se agregan unas gotas de fenolftaleína a la solución antes de comenzar la titulación. A medida que se agrega el valorante, aparece un color rojo local, pero rápidamente se disipa a medida que la solución se agita o se agita. Poco a poco, a medida que se acerca el punto de equivalencia, el color se disipa más lentamente; el truco es detener la adición de base después de una sola gota da como resultado una solución permanentemente rosa.
Diferentes indicadores cambian de color a diferentes valores de pH. Dado que el pH del punto de equivalencia varía con la fuerza del ácido que se valora, se intenta ajustar el indicador al ácido particular. Se pueden valorar los ácidos polipróticos usando una combinación adecuada de varios indicadores, como se ilustra anteriormente para el ácido carbónico.



 El más conocido de estos es, por supuesto, el
El más conocido de estos es, por supuesto, el