10.4: Reacciones ácido-Base
- Page ID
- 70852
Es especialmente importante que conozcas los significados precisos de todos los términos resaltados en el contexto de este tema.
- Esboce un diagrama de energía protónica para un ácido fuerte, un ácido o base débil y para una base fuerte.
- Describir cómo el pH afecta las concentraciones relativas de un par ácido base conjugado.
¿Reaccionará este ácido con esa base? Y si es así, ¿en qué medida? Estas preguntas pueden ser respondidas cuantitativamente realizando los cálculos detallados de equilibrio que aprenderás en otra lección. Sin embargo, la química ácido-base moderna ofrece algunos principios simples que pueden permitirle tomar una decisión cualitativa de un vistazo. Más importante aún, las ideas que desarrollamos en esta sección están garantizadas para brindarle una comprensión conceptual mucho mejor de las reacciones ácido-base basadas en protones en general.
¿Qué base obtiene el protón?
¿El ácido HA reaccionará con la base B? Declaramos anteriormente que el resultado de cualquier reacción ácido-base depende de qué tan bien dos bases diferentes puedan competir en el tira y afloja por el protón
\[A^– \leftarrow H^+\rightarrow B^– \label{9.4.1}\]
El protón siempre irá a la base más fuerte. Se puede tener alguna idea de esto al pensar que el protón tiene diferentes energías potenciales cuando está ligado a diferentes aceptores. Podemos trazar una analogía útil con los electrones en un átomo, que, recordarán, caerán siempre en los orbitales de energía de menor potencial disponibles, llenándolos de abajo hacia arriba. De manera similar, los protones “caerán” en los puntos vacíos de menor energía (bases) que puedan encontrar.
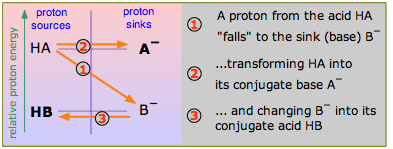
Consideremos el esquema aquí mostrado, que representa dos pares hipotéticos conjugados ácido-base. Tome nota cuidadosa del etiquetado de este diagrama: los ácidos HA y HB son fuentes de protones y las bases conjugadas A —y B — son sumideros de protones. Esta terminología de “fuente-sumidero” es sinónimo del lenguaje “donador-aceptor” que Brønsted nos enseñó, pero también conlleva una implicación sobre las energías relativas del protón tal como existe en las dos moléculas HA y HB. Si, como se indica aquí, el protón se encuentra a una “energía potencial” mayor cuando está en forma de HA que en HB, se favorecerá la reacción HA + B — → HB + A — en comparación con el proceso inverso HB + A — → HA + B —, lo que requeriría elevar el protón hasta el nivel A —. En este ejemplo, el HA es el ácido más fuerte porque su protón puede caer a una energía potencial menor cuando se une con B, para formar HB.
Nos referiremos a diagramas como el de Figura\(\PageIndex{1}\) como “diagramas de protón-energía”, lo cual no es del todo correcto, pero no queremos adentrarnos en la termodinámica en este punto. (Si ya sabes algo de termodinámica química, realmente nos estamos refiriendo a la energía Gibbs. )
Se deduce, entonces, que si podemos disponer todos los pares de conjugados ácido-base comunes en este tipo de escala, podemos predecir la dirección de cualquier reacción ácido-base simple sin recurrir a números. Esto se ilustrará más adelante, pero para mantener las cosas simples, veamos algunos diagramas de protón-energía que ilustran parte de la química ácido-base que discutimos en la sección anterior.
Ácidos fuertes y ácidos débiles
El ion hidronio es la línea divisoria; un ácido fuerte, recordarás, es aquel cuya base conjugada A — pierde ante la base “más fuerte” H 2 O en la competencia por el protón:
\[A^– \leftarrow H^+ \rightarrow H_2O \label{9.4.2}\]
Un ácido que es un donante de protones más fuerte que el ion hidronio es un ácido “fuerte”; si es un donante de protones más débil que H 3 O +, es por definición “débil”. Esto se ve más claramente en el diagrama aquí, que contrasta el ácido fuerte HA con el ácido débil HB. HB “disocia” en una pequeña medida porque es energéticamente desfavorable para promover su protón hasta el nivel H 2 O-H 3 O + (proceso 3 en el diagrama).
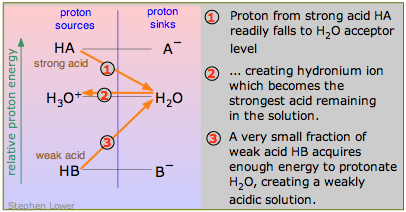
Ácidos fuertes y nivelación
Un ácido fuerte, recordarás, es aquel cuya base conjugada A —pierde ante la base “más fuerte” H 2 O en la competencia por el protón:
\[A^- ← H^+→ H_2O \label{9.4.3}\]
Porque la reacción
\[HA + H_2O \rightarrow A^–+ H_3O^+ \label{9.4.4}\]
para cualquier ácido fuerte HA es prácticamente completo, todos los ácidos fuertes parecen ser igualmente fuertes en el agua (el efecto nivelador.)
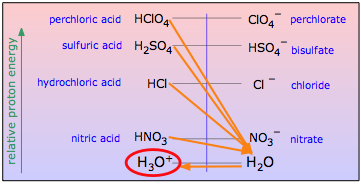
Desde el punto de vista de la energía protónica, un ácido fuerte es aquel en el que la energía del protón es sustancialmente mayor cuando se une al anión A —que cuando está unido a H 2 O. Agregar un ácido fuerte HA al agua lo pondrá en contacto con un enorme sumidero de protones que drena los protones de cualquiera de tales ácidos, dejando la base conjugada A —junto con el ion hidronio, el ácido más fuerte que puede existir en el agua.
Bases débiles
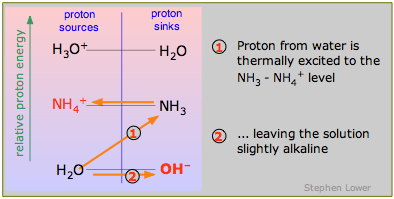
Las bases conjugadas de ácidos débiles tienden a aceptar protones del agua, dejando un pequeño exceso de OH — iones y por lo tanto una solución alcalina. Como puede ver en el diagrama, el amoníaco base débil acepta un protón del agua:
\[NH_3 + H_2O \rightarrow NH_4^+ + OH^– \label{9.4.6}\]
La “debilidad” de tal base es consecuencia del proceso energéticamente desfavorable (1) en el que un protón debe elevarse desde el nivel bajo H 2 O-OH —. Desde el punto de vista de la columna “fuentes de protones” de la izquierda, se puede pensar en esto como similar a la situación para los ácidos débiles que discutimos anteriormente; puede considerarse un caso especial en el que el ácido débil es H 2 O.
El ácido más débil y la base más fuerte
Durante mucho tiempo, los químicos habían considerado el metano, CH 4, como el ácido más débil, haciendo que el ion metido CH 3 —( que también es el carbanión más simple) sea la base más fuerte. El metano aún mantiene su posición como el ácido más débil, pero en 2008, el ion LiO —se encontró que era una base aún más fuerte que CH 4 —. Debido a que ambas bases son observables solo en fase gaseosa, estos hechos tienen poca importancia obvia en la química de la solución acuosa.
Autoprotólisis
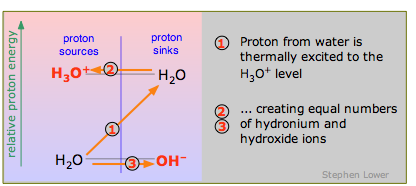
Debido a que el agua es anfiprótica, una molécula H 2 O puede donar un protón a otra, como se explicó anteriormente. En este caso el protón tiene que adquirir considerable energía para hacer el salto (1) del nivel H 2 O-OH — al nivel H 3 O + -H 2 O, por lo que la reacción
\[2 H_2O \rightarrow H_3O^++ OH^– \label{9.4.7}\]
ocurre sólo en una medida de un minuto. Piense en esto como el caso especial del ácido “más débil” H 2 O reaccionando con la base “más débil” H 2 O.
Bases fuertes
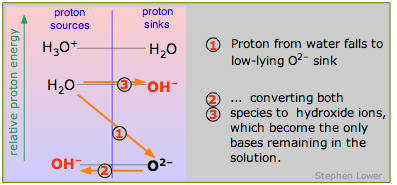
Por último, ¿qué es una base fuerte? Así como un ácido fuerte se encuentra por encima del nivel H 3 O + -H 2 O, también lo hace una base fuerte por debajo del nivel H 2 O-OH —. Y por la misma razón que H 3 O + es el ácido más fuerte que puede existir en el agua, OH — es la base más fuerte que puede existir en el agua. Aquí se muestra el ejemplo del ion óxido O 2—. El óxido de sodio Na 2 O es un polvo blanco que se disuelve en agua para dar iones de óxido que se descomponen inmediatamente en iones hidróxido
\[O^{2–} + H_2O \rightarrow 2 OH^– \label{9.4.8}\]
Poniéndolo todo junto, y el significado de pH
Esta tabla combina ejemplos comunes que cubren todo el rango de fuerzas ácido-base, desde las fuertes hasta las muy débiles. La escala de energía de la izquierda le da una idea de los niveles relativos de protón-energía para cada par conjugado; observe que el cero se establece arbitrariamente al del par H 3 O + -H 2 O.
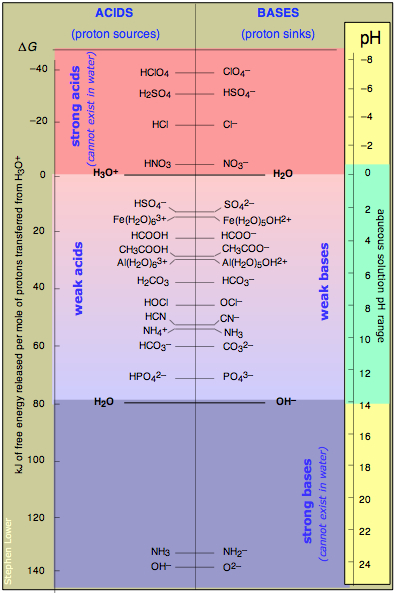
De mayor importancia es la escala de pH a la derecha. El pH que corresponde a cualquier par conjugado es el pH al que concentraciones iguales de ese par están en sus formas ácida y base. Por ejemplo, el ácido acético CH 3 COOH está “semiionizado” a un pH de 4.7. Si se agrega otro ácido fuerte como HCl para reducir el pH, la proporción de ion acetato disminuye, mientras que si se agrega hidróxido de sodio para forzar el pH más alto, se “disociará” una fracción mayor del ácido acético.
Esto ilustra otro aspecto del pH: en su nivel más fundamental, el pH es una medida inversa de la “intensidad de protones” en la solución. Cuanto menor sea el pH, mayor será la intensidad de protones y mayor será la fracción de niveles de protones de mayor energía poblada, lo que se traduce en mayores proporciones de concentración de ácido a base conjugada. Es fácil ver por qué ácidos como H 2 SO 4 y bases como el ion amida NH 2 — no pueden existir en solución acuosa; el pH tendría que estar en el nivel imposible de —6 para el primero y +23 para el segundo!
Por qué los ácidos se valoran con iones hidróxido
Cuando se valora un ácido con una base, se quiere que prácticamente todas las moléculas del ácido reaccionen con la base. En el caso de un ácido débil como hipocloroso, la reacción sería
\[HOCl + OH^– \rightarrow OCl^– + H_2O \label{9.4.9}\]
Debido a que el nivel de protones en HOCl es considerablemente superior al de H 2 O, la titulación con solución de NaOH asegurará que hasta el último protón sea consumido por el ion hidróxido. Si, en cambio, usaras amoníaco NH 3 como valorante, la cercanía de los dos niveles de protones provocaría que la reacción fuera incompleta, dando un punto de equivalencia menos distinto. Y, por supuesto, la titulación con una base que es más débil que el ion hipoclorito (como el bicarbonato de sodio) sería desesperada.
Como cuestión práctica, generalmente se puede estimar que cuando el pH difiere en más de aproximadamente dos unidades del valor que corresponde al par conjugado para un ácido monoprótico, la concentración de las especies no favorecidas disminuirá en un factor de alrededor de 1000.
Colaborador
Stephen Lower, Professor Emeritus (Simon Fraser U.) Chem1 Virtual Textbook


