10.6: Tipos de ácidos y bases
- Page ID
- 70840
- Dada la fórmula de un compuesto binario de hidrógeno con un elemento de Z<18, predecir si su solución acuosa es ácida o básica, y escribir una ecuación apropiada.
- Haga lo mismo para un compuesto de oxígeno o hidroxi de un elemento similar.
- Definir un oxiácido, y explicar por qué muchos de estos son ácidos muy fuertes.
- Escriba una ecuación que describa la naturaleza anfótera del hidróxido de zinc o aluminio.
- Definir un anhídrido de ácido y escribir una ecuación que describa su comportamiento.
- Explique cómo los cationes metálicos pueden dar soluciones ácidas.
- Escribir ecuaciones que muestren por qué las soluciones acuosas de algunas sales son ácidas, mientras que otras son alcalinas.
- Escribir las fórmulas de un ácido orgánico y una base orgánica, y escribir una ecuación que muestre por qué este último da una solución alcalina en agua.
Ya habrás notado que no todos los compuestos que contienen átomos de hidrógeno son ácidos; el amoníaco NH 3, por ejemplo, da una solución acuosa alcalina. De igual manera, algunos compuestos que contienen el grupo -OH son básicos, pero otros son ácidos. Una parte importante de entender la química es poder reconocer qué sustancias exhibirán propiedades ácidas y básicas en solución acuosa. Afortunadamente, la mayoría de los ácidos y bases comunes caen en un pequeño número de grupos bastante bien definidos, por lo que esto no es particularmente difícil.
Hidruros binarios
Estrictamente hablando, el término hidruro se refiere a compuestos iónicos de hidrógeno con los metales electropositivos de los Grupos 1-2; estos contienen el ion hidruro, H —, y a menudo se les conoce como hidruros “verdaderos”. Sin embargo, el término se suele utilizar en su sentido más general para referirse a cualquier compuesto binario MH n en el que M representa cualquier elemento. El ion hidruro es una base tan fuerte que no puede existir en el agua, por lo que sales como el hidruro de sodio reaccionan con agua para producir gas hidrógeno y una solución alcalina:
\[NaH + H_2O \rightarrow Na^+ + OH^– + H_2\]
Los elementos más electronegativos forman hidruros covalentes que generalmente reaccionan como ácidos, siendo un ejemplo bien conocido el cloruro de hidrógeno, un gas que se disuelve fácilmente en agua para dar la solución que conocemos como ácido clorhídrico
\[HCl_{(g)} + H_2O_{(l)} \rightarrow H_3O^+ + Cl^–\]
La mayoría de los compuestos covalentes de hidrógeno son ácidos débiles, en algunos casos, como el metano, CH 4, tan débiles que sus propiedades ácidas rara vez son evidentes. Muchos, como H 2 O y NH 3, son anfipróticos. Este último compuesto, el amoníaco, es un ácido más débil que el H 2 O, por lo que exhibe propiedades básicas en el agua
\[NH_3 + H_2O \rightarrow NH_4^+ + OH^–\]
pero se comporta como un ácido en disolventes no acuosos como el propio amoníaco líquido:
\[NH_3 + NH_3 \rightarrow NH_4^+ + NH_2^–\]
En general, la acidez de los hidruros no metálicos aumenta con el número atómico del elemento al que está conectado. Así, a medida que el elemento M se mueve de izquierda a derecha a través de la tabla periódica o hacia abajo dentro de un grupo, los ácidos MH se vuelven más fuertes, como lo indican las constantes de disociación ácida que se muestran a la derecha. Tenga en cuenta que
- Las fórmulas mostradas en rojo representan ácidos “fuertes” (es decir, ácidos más fuertes que H 3 O +.)
- El ácido fluorhídrico es el único miembro débil de los ácidos hidrohalógenos.
- Los ácidos más débiles que el agua no se comportan como ácidos en solución acuosa. Así, para la mayoría de los propósitos prácticos, el metano y el amoníaco no son comúnmente considerados como ácidos. El H 2 O en sí se trata como un ácido solo en el contexto estrecho de la química de la solución acuosa.
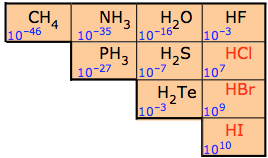
Los intentos de explicar estas tendencias en términos de un solo parámetro como la electronegatividad de M tienden a no ser muy útiles. La razón es que las fuerzas ácidas dependen de una serie de factores tales como la fuerza del enlace M-H y la energía liberada cuando los iones resultantes se hidratan en solución. Este último factor juega un papel importante en hacer que la HF sea una anomalía entre los ácidos fuertes del Grupo 17.

El amoníaco es un ácido tan débil que su base conjugada, el ion amida NH 2 —, no puede existir en el agua. En solución acuosa, NH 3 actúa como una base débil, aceptando un protón del agua y dejando un ion OH —. Una solución acuosa de NH 3 a veces se llama “hidróxido de amonio”. Este nombre erróneo refleja la visión pre-Brønsted de que todas las bases contienen unidades —OH que producen iones hidróxido en la disociación de acuerdo con el esquema de Arrhenius
\[NH_4OH \rightleftharpoons NH_4^+ + OH^–\]
Una solución de amoníaco en agua se conoce más correctamente como “amoníaco acuoso” y se representa por la fórmula NH 3 (ac). No hay evidencia física de la existencia de NH 4 OH, pero el nombre parece permanecer para siempre grabado en botellas de reactivos en laboratorios químicos y en los vocabularios de químicos.
Compuestos Hidroxiados
Los compuestos que contienen el grupo hidroxilo —OH constituyen la categoría más grande de ácidos, especialmente si se incluyen los ácidos orgánicos (discutidos por separado más adelante). Los compuestos M—OH también incluyen muchas de las bases más comunes.
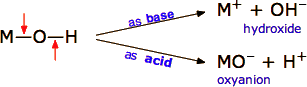
Si un compuesto del tipo general M—O—H actuará como un ácido o una base depende depende de las tendencias relativas de los enlaces M—O y O-H a romperse en el agua. Si el enlace M—O se escinde más fácilmente, entonces la parte —OH tenderá a retener su individualidad y con su carga negativa se convertirá en un ion hidróxido. Si el enlace O—H se rompe, la parte MO de la molécula permanecerá intacta como un oxianión MO, y la liberación del protón hará que el compuesto MOH actúe como un ácido.
Esto no es solo una cuestión de las fuerzas relativas de los dos enlaces; el cambio de energía que se produce cuando los iones resultantes interactúan con las moléculas de agua también es un factor importante.
En general, si M es un elemento metálico, el compuesto de hidróxido metálico\(\ce{MOH}\) será básico. El caso de los elementos altamente electropositivos de los Grupos 1 y 2 es algo especial ya que sus compuestos sólidos de MOH existen como redes interpenetrantes de cationes metálicos e iones OH —, por lo que aquellos que pueden disolverse fácilmente en agua forman soluciones fuertemente alcalinas; KOH y NaOH son ejemplos bien conocidos de bases fuertes. Desde el punto de vista de Brønsted, estas diferentes “bases” son realmente solo fuentes diferentes para la única base fuerte OH —. A medida que uno pasa al Grupo 2 de la tabla periódica los compuestos de M-OH se vuelven menos solubles; por lo tanto, una solución saturada de Ca (OH) 2 (comúnmente conocida como agua de cal) es solo débilmente alcalina. Los hidróxidos de los elementos metálicos del bloque p y de los metales de transición son tan insolubles que sus soluciones no son alcalinas en absoluto. Sin embargo, estos sólidos se disuelven fácilmente en soluciones ácidas para dar una sal más agua, por lo que son formalmente bases.
El carácter ácido de los compuestos hidroxi de los no metales, conocidos colectivamente como oxiácidos, se atribuye al desplazamiento de la carga negativa del átomo de oxígeno hidroxílico por el átomo central electronegativo. El efecto neto es hacer que el oxígeno sea ligeramente más positivo, facilitando así la salida del hidrógeno como H +. La presencia de otros grupos atrayentes de electrones en el átomo central tiene un marcado efecto sobre la fuerza de un oxiácido. De especial importancia es el átomo de oxígeno doblemente unido. A excepción de los haluros halógenos, todos los ácidos fuertes comunes contienen uno o más de estos oxígenos, como en el ácido sulfúrico SO 2 (OH), el ácido nítrico NO 2 (OH) y el ácido fosfórico PO (OH) 3. En general las fortalezas de estos ácidos dependen más del número de oxígenos que de cualquier otro factor, por lo que las tendencias periódicas no son tan importantes.
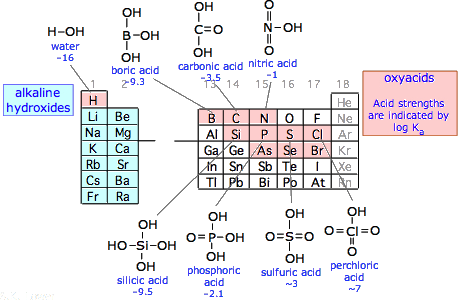
La mayoría de los elementos halógenos forman más de un oxiácido. El flúor es una excepción; al ser más electronegativo que el oxígeno, no se conocen oxiácidos de este elemento. El cloro es el único halógeno para el que se conocen los cuatro oxiácidos, y los valores K a de esta serie muestran cuán poderosamente los átomos de oxígeno Cl—O afectan la fuerza del ácido.
Compuestos de oxígeno
Los óxidos binarios que no contienen átomos de hidrógeno pueden exhibir un comportamiento ácido-base cuando reaccionan con el agua. La división entre los óxidos de oxígeno ácidos y básicos es en gran medida paralela a la que existe entre los compuestos hidroxi. Los compuestos de oxígeno de los metales altamente electropositivos de los Grupos 1-2 en realidad contienen el ion óxido O —. Este ion es otro caso de un aceptor de protones que es más fuerte que el OH —, y por lo tanto no puede existir en solución acuosa. Por lo tanto, los óxidos iónicos tienden a dar soluciones fuertemente alcalinas:
\[\ce{O^{-} + H2O -> 2OH^{-} (aq)}\]
En algunos casos, como el del MgO, el sólido es tan insoluble que se nota poco cambio en el pH cuando se coloca en agua. El CaO, sin embargo, que se conoce como cal viva, es suficientemente soluble para formar una solución fuertemente alcalina con la evolución de calor considerable; el resultado es la cal apagada ligeramente soluble, Ca (OH) 2. Los compuestos de oxígeno de los metales de transición son generalmente sólidos insolubles que tienen estructuras extendidas bastante complejas. Aunque algunos se disolverán en ácidos, no muestran propiedades ácidas en el agua.
Óxidos e hidróxidos anfóteros
Los óxidos e hidróxidos de los metales del Grupo 3 y superiores tienden a ser solo débilmente básicos, y la mayoría presentan una naturaleza anfótera. La mayoría de estos compuestos son tan ligeramente solubles en agua que su carácter ácido o básico solo es obvio en sus reacciones con ácidos o bases fuertes. En general, estos compuestos tienden a ser más básicos que ácidos; así los óxidos e hidróxidos de aluminio, hierro y zinc se disuelven en soluciones ligeramente ácidas, mientras que requieren tratamiento con soluciones concentradas de iones hidróxido para reaccionar como ácidos.
| Al (OH) 3 +3 H + → Al 3 + (aq) +3H 2 O | Al (OH) 3 (s) +OH — → Al (OH) 3 — 3 (aq) |
| Zn (OH) 2 +3 H + → Zn 2 + (aq) +2H 2 O | Zn (OH) 2 (s) +2 OH — → Zn (OH) 3 4— (aq) |
| FeO (OH) + 3 H + → Fe 3 + (aq) +3H 2 O | Fe 2 O 3 (s) + 3 OH — → 2 FeO 2 + (aq) +3 H 2 O |
Los iones producto en la segunda columna se conocen como aluminato, zincato y ferrato. También se forman otros productos, en los que solo algunos de los grupos —OH de los hidróxidos progenitores son desprotonados, por lo que en realidad hay series enteras de estos oxianiones para la mayoría de los metales.
Anfiprótico vs anfótero: ¿cuál es la diferencia?
Una sustancia anfótera es aquella que puede actuar como un ácido o una base. Una sustancia anfiprótica puede actuar como donante de protones o aceptor de protones. Por lo que todos los compuestos anfipróticos también son anfóteros. Un ejemplo de un compuesto anfótero que no es anfiprótico es el ZnO, que puede actuar como un ácido aunque no tenga protones para donar:
\[\ce{ZnO(s) + 4 OH^{-} (aq) -> Zn(OH)^{2-}4 (aq)}\]
Como base, “acepta” protones pero no los retiene:
\[\ce{ZnO(s) + 2H^{+} <=> Zn^{2+} + H_2O}\]
Se pueden hacer las mismas observaciones sobre los demás compuestos mostrados en la tabla anterior. Para la mayoría de los propósitos prácticos, no vale la pena preocuparse por la distinción entre anfiprótico y anfótero.
Anhídridos de ácido
Los compuestos binarios de oxígeno de los elementos no metálicos tienden a producir soluciones ácidas cuando se agregan al agua. Tales compuestos a veces se denominan anhidridos de ácido (“ácidos sin agua”).
\[CO_2 + H_2O \rightarrow H_2CO_3\]
\[SO_2 + H_2O \rightarrow [H_2SO_3]\]
\[SO_3 + H_2O \rightarrow H_2SO_4\]
\[P_4O_{10} + 6 H_2O \rightarrow 4 H_3PO_4\]
En algunos casos, la reacción implica más que simplemente incorporar los elementos del agua. Así, el dióxido de nitrógeno, utilizado en la preparación comercial de ácido nítrico, no es un anhídrido en sentido estricto:
\[3 NO_2 + H_2O \rightarrow 2 HNO+3 + NO\]
Cationes metálicos como ácidos
Cuando el cloruro de sodio se disuelve en agua pura, el pH permanece sin cambios porque ninguno de los iones reacciona con el agua. Sin embargo, una solución de cloruro de magnesio será débilmente ácida, y una solución de cloruro de hierro (III) FeCl 3 será claramente así. ¿Cómo puede ser esto? Dado que ninguno de estos cationes contiene hidrógeno, sólo podemos concluir que los protones provienen del agua.
Las moléculas de agua en cuestión son aquellas que se encuentran cercanas a cualquier catión en solución acuosa; el campo positivo del ión metálico interactúa con la molécula polar H 2 O a través de la atracción ión-dipolo, y al mismo tiempo aumenta la acidez de estas aguas poco unidas al hacer facilitando la salida del ion H +. En general, cuanto más pequeño y con mayor carga sea el catión, más ácido será; la acidez de los metales alcalinos y de iones como Ag + (aq) es insignificante, pero para iones más altamente cargados como Mg 2 +, Pb 2 + y Al 3 +, el efecto es bastante notorio.
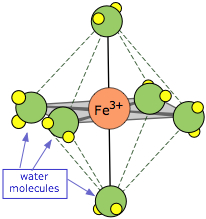
La mayoría de los cationes de metales de transición forman complejos de coordinación organizados en los que cuatro o seis moléculas de H 2 O están químicamente unidas al ión metálico donde están bien dentro de la influencia del campo culómbico del catión, y por lo tanto están sujetas a la pérdida de un protón. Así, una solución acuosa de “Fe 3+" es realmente una solución del ion hexaaquo hierro III, cuya primera etapa de “disociación” puede representarse como
\[Fe(H_2O)_6^{3+} + H_2O \rightarrow Fe(H_2O)_5(OH)^{2+} + H_3O^+\]
Como consecuencia de esta reacción, una solución de FeCl 3 resulta ser un ácido más fuerte que una solución equimolar de ácido acético. Una solución de FeCl 2, sin embargo, será un ácido mucho más débil; la carga +2 es considerablemente menos efectiva para facilitar la pérdida del protón.
Debería ser posible que un catión hidratado pierda más de un protón. Por ejemplo, un ion Al (H 2 O) 6 3+ debería formar, sucesivamente, las siguientes especies:
AlOH (H 2 O) 5 2+ → Al (OH) 2 (H 2 O) 4 + → Al (OH) 3 (H 2 O) 3 0 → Al (OH) 4 (H 2 O) 2 — → Al (OH) 5 (H 2 O) 2— → Al (OH) 6 3—
Sin embargo, la remoción de protones se vuelve progresivamente más difícil a medida que la carga disminuye de un alto valor positivo a uno negativo; las tres últimas especies no han sido detectadas en solución. En soluciones diluidas de cloruro de aluminio las especies principales son en realidad Al (H 2 O) 6 3+ (comúnmente representado simplemente como Al 3+) y AlOH (H 2 O) 5 2+ (“AlOH 2+ “).
Sales
Cuando las sales se disuelven en agua, producen soluciones de aniones y cationes, por lo que sus efectos sobre el pH de la solución dependerán de las propiedades del par particular de iones. Para una sal como el cloruro de sodio, la solución permanecerá neutra debido a que los iones de sodio no tienen propiedades ácidas y los iones cloruro, al estar conjugados con el ácido fuerte HCl tienen tendencias insignificantes a aceptar protones. Los iones de este tipo a menudo se denominan iones “fuertes” (es decir, derivados de un ácido fuerte y una base fuerte: HCl y NaOH en el caso del NaCl). A continuación se muestran los posibles resultados para las otras tres posibilidades.
| sal derivada de | ejemplo | pH | reacción |
|---|---|---|---|
| ácido débil + base fuerte | \(\ce{NaF}\) | >7 | F — + H 2 O → HF + OH — |
| ácido fuerte+ base débil | \(\ce{NH4Cl}\) | <7 | NH 4 + + H 2 O → NH 3 + H 3 O + |
| ácido débil + base débil | \(\ce{NH4F}\) | ? | depende de la competencia entre las dos reacciones anteriores; necesidad de hacer el cálculo |
Las reacciones que hacen que las soluciones salinas tengan valores de pH no neutros a veces todavía son referidas por el término más antiguo de hidrólisis (“división de agua”), un recordatorio de tiempos antes de que se hubiera desarrollado el concepto de reacciones ácido-base de transferencia de protones.
Ácidos y Bases Orgánicos
El grupo carboxilo —CO (OH) es el grupo funcional característico de los ácidos orgánicos. La acidez del átomo de hidrógeno carboxílico se debe casi en su totalidad a la extracción de electrones por parte del átomo de oxígeno no hidroxílico; si no estuviera presente, tendríamos un alcohol —COH cuya acidez es menor incluso que la de H 2 O. Esta retirada parcial de electrones de un átomo puede afectar no solo a átomo vecino, pero el vecino de ese átomo también. Así, la fuerza de un ácido carboxílico se verá afectada por el ambiente de unión del átomo de carbono al que está conectado. Esta propagación de la extracción parcial de electrones a través de varios átomos adyacentes se conoce como el efecto inductivo y es extremadamente importante en la química orgánica.
Un muy buen ejemplo del efecto inductivo producido por el cloro (otro átomo altamente electronegativo) se ve comparando las fuerzas del ácido acético y de los ácidos cloroacéticos sucesivamente más altamente sustituidos:
|
CH 3 —COOH ácido |
ClCH 2 —COOH ácido
monocloroacético 0.0014 |
Cl 2 CH—COOH ácido |
Cl 3 Ácido |
Fenoles
El carácter ácido del grupo carboxilo es realmente una consecuencia de la mayor acidez del grupo —OH influenciado por el segundo átomo de oxígeno que compone el grupo —COOH. El anillo de benceno tiene un efecto de extracción de electrones similar aunque más débil, por lo que los grupos hidroxilo que están unidos a los anillos de benceno también actúan como ácidos. El ejemplo más conocido de dicho ácido es el fenol, C 6 H 5 OH, también conocido como ácido carbólico. En comparación con los ácidos carboxílicos, los ácidos fenólicos son bastante muy débiles, como lo indican las constantes de disociación ácida enumeradas a continuación:
|
CH 3 —COOH ácido
acético 1.8 × 10 —5 |
C 6 H 5 —OH
fenol 1.1× 10 —10 |
C 6 H 5 —COOH ácido
benzoico 6.3 × 10 —5 |
Amina y bases orgánicas
Ya hemos hablado de los ácidos orgánicos, así que quizás estaría en orden una palabra sobre bases orgánicas. El grupo -OH, cuando está unido al carbono, es ácido más que básico, por lo que los alcoholes no son los análogos de los compuestos hidroxi inorgánicos. Las aminas, que consisten en el grupo -NH 2 unido a un átomo de carbono, son la clase más común de bases orgánicas. Las aminas dan soluciones débilmente alcalinas en agua:
\[CH_3NH_2 + H_2O \rightarrow CH_3NH_3^+ + OH^–\]
Las aminas son productos finales de la degradación bacteriana de sustancias orgánicas nitrogenadas como las proteínas. Suelen tener olores bastante desagradables de “pescado podrido”. Esto no es casualidad, ya que los mariscos contienen especialmente grandes cantidades de compuestos que contienen nitrógeno que comienzan a descomponerse muy rápidamente. La metilamina CH 3 NH 2, al ser un gas a temperatura ambiente, es especialmente apta para darse a conocer a nosotros. La adición de jugo de limón o alguna otra sustancia ácida a los peces convertirá la metilamina en el ion metilaminio CH 3 NH 3 +. Debido a que los iones no son volátiles no tienen olor.


