10.7: Galería Ácido-Base
- Page ID
- 70865
Asegúrese de comprender a fondo las siguientes ideas esenciales que se han presentado anteriormente. Es especialmente importante que conozcas los significados precisos de todos los términos resaltados en el contexto de este tema.
- Describir algunas de las propiedades especiales del ácido sulfúrico que lo hacen especialmente importante tanto en el laboratorio como en la industria.
- Nombrar los principales ácidos y bases que son importantes para la industria de fertilizantes
- Nombrar las fuentes naturales de cualquiera de los tres principales ácidos orgánicos.
- ¿Qué son los ácidos grasos? ¿De qué manera principal difieren las propiedades físicas de los ácidos grasos saturados e insaturados?
- Describir la estructura general de un aminoácido, y exponer por qué son importantes.
Los ácidos y las bases son de interés no sólo para los inclinados químicamente; juegan un papel importante en nuestra sociedad industrial moderna —por lo que cualquiera que participe en ella, o que esté interesado en su historia y desarrollo, necesita saber algo sobre ellos. Cinco de los principales ácidos y bases caen dentro de los “Top 20" químicos industriales fabricados en el mundo. La siguiente tabla muestra las cifras del año 2000 para Estados Unidos:
| cal y rango |
Ácido sulfúrico - 1 |
Lima (CaO) |
Ácido fosfórico - 4 |
Amoníaco |
Hidróxido de sodio - 9 |
Ácido nítrico - 11 |
|---|---|---|---|---|---|---|
| producción en 10 9 kg | 40 | 20 | 16 | 15 | 11 | 8 |
| uso mayor | productos químicos | cemento | fertilizantes | fertilizantes | productos químicos | productos químicos |
Los ácidos minerales
Este término se refiere a cualquier ácido inorgánico, pero su uso común suele estar limitado a los principales ácidos fuertes más el ácido fosfórico. Los principales ácidos minerales —sulfúrico, nítrico y clorhídrico— se conocen desde la época medieval. Su descubrimiento suele ser acreditado al alquimista persa Abu Musa Jabir ibn Hayyan, conocido en Occidente por su nombre latinizado Geber. Jabir también inventó el aqua regia, la mezcla de ácidos nítrico y clorhídrico que tiene la capacidad única de disolver el oro.
Ácido sulfúrico
Se fabrica más ácido sulfúrico que cualquier otro químico industrial, y es el ácido industrial más barato a nivel mundial. Se ha fabricado continuamente en Estados Unidos desde 1793 y en Europa por mucho más tiempo.

Lo que debes saber al respecto
- El H 2 SO 4 anhidro puro es un líquido denso y viscoso que se funde a 10.4°C y hierve a aproximadamente 300°C, descomponiéndose de nuevo en sus constituyentes, H 2 O y SO 3.
- El ácido se somete a autoprotólisis
2 H 2 SO 4 → H 3 SO 4 + + HSO 4 —
H 2 SO 4 + 2 NaCl → 2 Na + + SO 4 2— + HCl (g)
C 12 H 22 O 11 (s) → 12 C (s) + 11 H 2 O
H 2 SO 4 + H 2 SO 4 → HS 2 O 7 — + H 3 O +
- Su alto punto de ebullición hace que el ácido sea ideal para elaborar otros ácidos, como el nítrico y el clorhídrico, que son más volátiles; la eliminación del producto gaseoso conduce la reacción a la derecha como predice el Principio de Le Chatelier:
- El ácido sulfúrico tiene un apetito voraz por el agua, y por lo tanto es un excelente agente deshidratante. Esto se ve más espectacularmente si se vierte algo de ácido concentrado sobre una pequeña pila de azúcar de mesa; después de poco tiempo, se produce una reacción vigorosa que resulta en una pila de carbón poroso y humeante
- ¡El ácido sulfúrico puede incluso deshidratarse solo! , algunas de las cuales han sido detectadas en la superficie de la luna de Júpiter Europa.
- Debido a las reacciones de autoprotólisis y autodeshidratación descritas anteriormente, el ácido sulfúrico “puro” contiene al menos seis especies minoritarias además de H 2 SO 4.

Cómo se hace
El trióxido de azufre, el anhídrido del ácido sulfúrico, es el precursor inmediato. El SO 3 gaseoso reacciona vigorosamente con el agua, liberando mucho calor en el proceso:
\[SO_{3(g)} + H_2O_{(l)} → H_2SO_{4(l)}\]
La fabricación industrial del ácido comienza con dióxido de azufre, preparado a partir de la quema de azufre elemental u obtenido como subproducto de la tostación de minerales de sulfuro. La oxidación de SO 2 a SO 3 parece simple
\[SO_{2(g)} + ½ O_{2(g)} → SO_{3(g)}\]
pero hay varias complicaciones:
- Todas las reacciones químicas tienen lugar más rápidamente a temperaturas más altas, pero debido a que esta reacción es altamente exotérmica, elevar la temperatura disminuye el rendimiento.
- Debido a la disminución de volumen (1.5 moles de gases a 1 mol), elevar la presión aumentará el rendimiento, por lo que la reacción se lleva a cabo a una temperatura por debajo de 600°C pero a presión muy alta.
- Se utilizan catalizadores especializados para acelerar la reacción a estas temperaturas más bajas.
- Disolver el SO 3 directamente en agua liberaría grandes cantidades de calor, creando una niebla de finas gotas de ácido que escaparían a la atmósfera. El SO 3 se disuelve en su lugar en ácido sulfúrico para formar ácido pirosulfúrico u óleum, a veces conocido como ácido sulfúrico fumante:
\[H_2SO_{4(l)} + SO_{3(g)} → H_2S_2O_{7(l)}\]
\[H_2S_2O_{7(l)} + H_2O_{(l)} → 2 H_2SO_{4(l)}\]
- El óleum se trata entonces con agua para formar ácido sulfúrico de grado industrial (96-98%):
Para qué se utiliza
El ácido sulfúrico tiene un amplio espectro de usos industriales, y el tonelaje anual sigue muy de cerca el ciclo económico.
- El sesenta por ciento del producto mundial se destina a la fabricación de ácido fosfórico H 3 PO 4 que se utiliza para elaborar fertilizantes fosfatados y detergentes domésticos a base de fosfato.
- Un importante fertilizante nitrogenado, el sulfato amónico (NH 4) 2 SO 4, se elabora haciendo reaccionar ácido sulfúrico con amoníaco, este último a menudo obtenido de la descomposición térmica del carbón.
- El ácido sulfúrico es el componente principal del ácido decapante que se utiliza para eliminar las incrustaciones de óxido superficiales del acero antes de que se fabrique en productos de acero para el automóvil y otras industrias.
- El sulfato de aluminio (hecho de bauxita Al 2 O 3 con H 2 SO 4), es ampliamente utilizado en la industria de fabricación de papel para coagular las fibras de celulosa, produciendo una superficie de papel suave y dura. Otro uso importante es hacer hidróxido de aluminio que se utiliza para filtrar la materia particulada en las instalaciones de tratamiento de agua.
- La familiar batería de almacenamiento de plomo-ácido emplea ácido sulfúrico como electrolito. A medida que la batería se descarga, la concentración de ácido sulfúrico en el electrolito disminuye a medida que los iones sulfato se toman como PbSO 4. Debido a la alta densidad del ácido, el estado de carga de la batería se puede medir por medio de un hidrómetro.
Ácido sulfúrico en el medio ambiente
Lluvia ácida - La combustión de combustibles fósiles que contienen compuestos orgánicos de azufre libera SO 2 a la atmósfera. La oxidación fotoquímica de este compuesto a SO 3, que absorbe rápidamente la humedad, conduce a la formación de H 2 SO 4, un componente principal de la lluvia ácida.
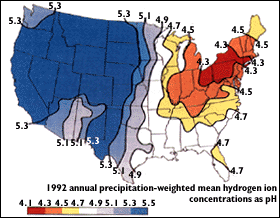
El drenaje ácido de la mina resulta cuando los sedimentos de la muy común pirita de hierro, FeS2, se exponen al aire y se oxidan:
FeS 2 (s) + 7/2 O 2 + H 2 O → Fe 2 + 2 SO 4 2— + 2 H +
la oxidación adicional del hierro a Fe 3 + da como resultado reacciones adicionales. El líquido de drenaje resultante suele ser de color naranja-marrón y puede tener un pH por debajo de cero.
Ácido nítrico
El HNO 3 anhidro es un líquido incoloro que hierve a 82.6°C, pero el HNO 3 “puro” solo existe como el sólido que se funde a -41.6°C. En sus estados líquido y gaseoso, el ácido siempre se descompone parcialmente en dióxido de nitrógeno:
2 HNO 3 → 2 NO 2 + ½ O 2 + H 2 O
Esta reacción, que es catalizada por la luz, explica el color parduzco de las soluciones de HNO 3.
Lo que debes saber al respecto
- El HNO 2 se somete a autoprotólisis en mayor medida que cualquier otro líquido. Otras reacciones del conjugado ácido H 2 NO 3 + con HNO 3 conducen a una complicada mezcla de especies en el líquido.
- El ácido nítrico diluido se puede concentrar por destilación hasta un máximo de 68%, momento en el que forma una mezcla de ebullición constante (azeotrópica) con agua. Las concentraciones más altas requieren deshidratación con ácido sulfúrico; el resultado es ácido nítrico fumante.
- El “ácido nítrico concentrado” se vende como una solución al 70% en agua, correspondiente a una concentración de aproximadamente 16M.
- El ácido nítrico es un agente oxidante muy fuerte, lo que se suma a su comportamiento corrosivo con materiales orgánicos incluyendo, por supuesto, la piel, que se vuelve amarilla debido a una reacción con la proteína queratina. Las reacciones con muchos compuestos orgánicos son altamente exotérmicas y a menudo violentas. La conocida reacción del ácido nítrico con cobre metálico produce copiosas cantidades de gas dióxido de nitrógeno marrón.

Cómo se hace
El método más simple, que se utilizó industrialmente antes de 1900, fue mediante el tratamiento del nitrato de sodio (“salitre de Chile”, NaNO 3) con ácido sulfúrico. La síntesis directa del ácido a partir del nitrógeno atmosférico y el oxígeno es termodinámicamente favorable
½ N 2 + 5/4 O 2 + ½ H 2 O → HNO 3
pero está cinéticamente obstaculizado por una energía de activación extremadamente alta, hecho por el que podemos estar muy agradecidos (ver barra lateral.) El primer proceso industrial de fijación de nitrógeno, desarrollado en 1903, utilizó esta reacción para producir ácido nítrico, pero requirió el uso de un arco eléctrico para suministrar la energía de activación y, por lo tanto, fue demasiado intensivo en energía para ser económico.
Nota
Si no fuera por la alta energía de activación requerida para sostener esta reacción, se consumiría todo el oxígeno de la atmósfera y los océanos serían una solución diluida de ácido nítrico.
El proceso moderno de Ostwald implica la oxidación catalítica del amoníaco a óxido nítrico NO, el cual se oxida en un paso adicional a NO 2; la reacción de este último con agua produce HNO 3. Esta ruta, desarrollada por primera vez en 1901, no se hizo práctica hasta la producción a gran escala de amoníaco por el proceso Haber-Bosch en 1910.
Para qué se utiliza
Los principales usos industriales del ácido nítrico son para la producción de fertilizantes de nitrato de amonio, y en la fabricación de explosivos. En una escala muy pequeña, el ácido se utiliza en decapado de metales, grabado de semiconductores y placas de circuitos electrónicos, y en la fabricación de fibras acrílicas.
En el laboratorio, el ácido encuentra uso en una amplia variedad de roles.
En el medio ambiente
Los procesos de combustión a alta temperatura (en motores de combustión interna, centrales eléctricas e incineradores) pueden oxidar el nitrógeno atmosférico a óxido nítrico (NO) y otros óxidos (“NO x “); el NO se fotooxida a NO 2, que reacciona con agua para formar HNO 3 que es un componente importante de la lluvia ácida. El NO 2 es el principal precursor del smog fotoquímico.
Ácido clorhídrico
A diferencia de los otros ácidos principales, no existe tal sustancia como el ácido clorhídrico “puro”; lo que llamamos “ácido clorhídrico” es solo una solución acuosa de gas de cloruro de hidrógeno (pb —84°C). Pero en cierto sentido es más “puro” que los ácidos discutidos anteriormente, ya que no hay autoprotólisis; los iones hidronio y cloruro son las únicas especies significativas en la solución. El ácido clorhídrico generalmente se vende como una solución 32-38% (12M) de HCl en agua; concentraciones mayores que esta se conocen como ácido clorhídrico fumante.
Nota
El ácido clorhídrico todavía se vende a veces bajo su antiguo nombre ácido muriático para limpiar ladrillos y otros fines domésticos. El nombre proviene de la misma raíz que marina, reflejando su preparación a partir de la sal.
El ácido ha sido conocido por los químicos (y alquimistas), y utilizado con fines industriales desde la Edad Media. Su composición HCl fue demostrada por Humphrey Davy en 1816.
Lo que debes saber al respecto
- El ácido clorhídrico es el menos peligroso de los ácidos minerales fuertes para trabajar porque a diferencia de los demás, no es un agente oxidante. Por lo general, es el ácido de elección para titulaciones y otras operaciones en las que el requisito principal es simplemente una fuente fuerte de iones hidronio.
- El ácido concentrado hierve a 48°C, a medida que continúa la ebullición, pierde HCl y el punto de ebullición se eleva a 109°C, punto en el que queda una solución de ebullición constante (azeotrópica), que consiste en 20.2% de HCl.

Para qué se utiliza
Los usos del ácido clorhídrico son demasiados para enumerarlos individualmente, pero destacan los siguientes:
- Un uso industrial importante es eliminar las incrustaciones superficiales del hierro o el acero (“decapado”) antes de que se procese en láminas u otras formas, o galvanizado o recubierto.
- La producción de productos químicos orgánicos clorados, particularmente cloruro de vinilo, poliuretanos y otros polímeros de construcción, consume grandes cantidades de HCl.
- El ácido es ampliamente utilizado para el control del pH del agua, incluida la neutralización de corrientes de aguas residuales y para la regeneración de ablandantes de agua de intercambio iónico.
Cómo se hace
El antiguo método de tratar la sal con ácido sulfúrico para liberar HCl ha sido suplantado desde hace mucho tiempo por procesos más eficientes, incluida la síntesis directa al “quemar” gas hidrógeno en cloro:
\[H_{2(g)} + Cl_{2(g)} \rightarrow 2 HCl_{(g)}\]
La mayor parte de la producción de ácido clorhídrico ahora proviene de la recuperación del subproducto de cloruro de hidrógeno gaseoso de otros procesos, especialmente los asociados con la producción de compuestos orgánicos industriales.
2 Los metales alcalinos
El término álcali generalmente significa una sal básica de un metal del Grupo 1 o 2 (“alcalino” o “alcalinotérreo”). Todos los álcalis son, por supuesto, bases, pero este último término es mucho más general, ya sea definido de acuerdo con los conceptos Arrhenius, Brønsted-Lowry o Lewis. La palabra álcali proviene del árabe al-qali, que hace referencia a las cenizas de las que se extrajeron hidróxidos de sodio y potasio (potasa, “cenizas que quedan en la olla”, y el origen del elemento nombre potasio) como paso en la elaboración del jabón.
Hidróxido de sodio
El hidróxido de sodio puro es un sólido blanco que consiste en iones Na + y OH — en una red cristalina. Aunque es ampliamente considerado como un sólido iónico, las fuerzas de van der Waals hacen una contribución sustancial a su estabilidad.
Lo que debes saber al respecto
- Debido a su delicuescencia (capacidad de absorber humedad) y su tendencia a reaccionar con el dióxido de carbono, el sólido debe almacenarse en un recipiente cerrado.
- En la industria, el hidróxido de sodio se conoce comúnmente como sosa cáustica o simplemente como cáustica; el NaOH que se vende para fines domésticos generalmente se conoce como lejía.
- El hidróxido de sodio ataca lentamente el vidrio para formar silicato de sodio. Los recipientes de vidrio utilizados para almacenar soluciones concentradas desarrollan gradualmente una capa turbia en el interior.
- Algunos metales, en particular el aluminio, el zinc y el titanio, reaccionan con soluciones fuertemente alcalinas, pero el hierro y el cobre son inmunes a este tipo de ataques.
- Las soluciones altamente alcalinas también suavizan y disuelven la piel, lo que explica la sensación resbaladiza asociada con bases fuertes. El hidróxido de sodio se utilizó una vez para deshacerse de los cadáveres de animales, digeriéndolos en forma líquida fácilmente desechable.
Cómo se hace
El hidróxido de sodio ahora se fabrica mediante la electrólisis de soluciones de salmuera, y junto con el cloro, es uno de los dos principales productos de la industria de los clorálcalis.
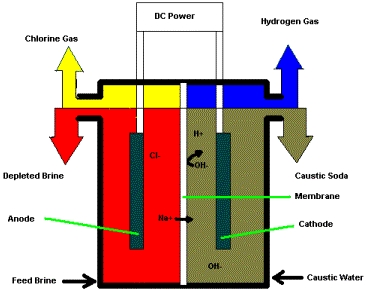
La electrólisis de NaCl acuoso produce Cl 2 en el ánodo, pero debido a que H 2 O puede reducirse más fácilmente que Na +, el agua se descompone a H 2 y OH —en el cátodo, dejando una solución de NaOH. Un proceso de celda de mercurio más antiguo reduce el Na + a Na dentro de una amalgama de mercurio (aleación), y el sodio metálico se combina luego con agua para producir NaOH e hidrógeno. La reacción neta para la etapa de reducción es la misma para ambos métodos:
\[2 Na^+ + 2 H_2O + 2e^– \rightarrow H_{2(g)] + 2 NaOH\]
La solución resultante generalmente se evapora a una concentración tan alta que solidifica a temperaturas ordinarias. Comúnmente se envía en vagones o barcazas que se pueden calentar con vapor para licuar la mezcla para su eliminación. (¡Obviamente es antieconómico enviar grandes cantidades de agua por todo el país!)
Para qué se utiliza
- El hidróxido de sodio es uno de los químicos industriales más diversos en cuanto a sus aplicaciones. La mayoría de los hogares lo conocen como el ingrediente activo de los agentes de limpieza de desagües.
- Grandes cantidades son consumidas por la industria de pulpa y papel, que es probablemente su aplicación industrial específica más grande. Se utiliza para eliminar el componente de lignina de la pulpa de madera de la celulosa para que esta última pueda procesarse en papel.
- Aproximadamente la mitad de la producción de NaOH se destina a la producción de una amplia variedad de otros productos químicos industriales, y al desengrasado de tambores de acero y otras superficies industriales.
- “Lye” juega un papel en el procesamiento de muchos tipos de alimentos, incluyendo chocolate, aceitunas, pretzels y los productos de maíz “maíz” y “sésamo” utilizados en el sur de Estados Unidos. También actúa como un agente químico para pelar frutas y verduras.

El empuje económico del cáustico y el cloro
En contraste con las aplicaciones extremadamente diversas del hidróxido de sodio que hace que la demanda de este producto sea relativamente inmune a los altibajos del ciclo económico, el consumo de cloro depende directamente de la economía como se refleja en la demanda de productos de cloruro de polivinilo que ahora son ampliamente utilizado en las industrias de construcción y muebles para el hogar. Debido a que el cloro, al ser un gas, es caro de almacenar, la producción de la industria de los clorálcalis se rige en gran medida por la demanda de este producto básico. Cuando los tiempos son buenos esto no presenta ningún problema; el cáustico es entonces en gran parte un subproducto y se puede almacenar fácilmente si la oferta excede la demanda. Pero durante una recesión económica, la demanda de cloro disminuye, limitando su producción junto con la del cáustico. Pero debido a que la demanda de cáusticos tiende a disminuir mucho menos, se vuelve escasa y su precio sube, tendiendo así a llevar a la economía industrial a problemas aún más profundos.
Carbonato de sodio
Este compuesto se conoce industrialmente como carbonato de sodio, y a nivel nacional como sosa de lavado. La forma común es el heptahidrato, Na 2 CO 3 ·7 H 2 O. Los cristales blancos de esta sustancia pierden espontáneamente agua (efloresce) cuando se exponen al aire, formando el monohidrato.
Para qué se utiliza
- Si bien los carbonatos son bases mucho más débiles que los hidróxidos, una solución de carbonato de sodio aún puede tener un pH de 11 aproximadamente, lo suficientemente alto como para permitirle sustituir al hidróxido de sodio en muchas aplicaciones, especialmente cuando el precio del cáustico es alto.
- El único uso más importante de la ceniza de sosa es en la fabricación de vidrio, donde sirve para disminuir el punto de fusión del componente principal, SiO 2.
- Otro uso importante emergente es neutralizar las emisiones de SO 2 de las centrales eléctricas que queman combustibles fósiles.
- El uso más antiguo del carbonato de sodio como agente de limpieza (de ahí el nombre de sosa de lavado) se basó en parte en la capacidad de sus soluciones alcalinas para emulsionar grasa, pero principalmente como medio de precipitar los carbonatos insolubles de calcio y magnesio ante estos iones (comúnmente presentes en agua dura) podrían formar precipitados indeseables con jabones. El uso de detergentes modernos ha eliminado en gran medida este mercado que alguna vez fue importante.

Cómo se hace
La mayor parte del carbonato de sodio del mundo está hecho por el proceso de amoníaco y soda “Solvay” desarrollado en 1861 por el químico belga Ernest Solvay (1838-1922) cuyas patentes lo convirtieron en un importante industrial y un rico filántropo. Este proceso implica un conjunto de reacciones simples que esencialmente convierten la piedra caliza (CaCo 3), amoníaco NH 3 y salmuera (NaCl) en bicarbonato de sodio NaHCO 3 y eventualmente Na 2 CO 3, reciclando varios de los productos intermedios de una manera ingeniosa.

Una fuente menor de ceniza de sosa (pero bastante significativa en algunos países, como Estados Unidos) es la extracción de evaporitas naturales (los restos de lagos antiguos), como la trona que se encuentra en el sur de California.
Amoníaco
Amoníaco NH 3, por supuesto, no es un verdadero álcali, pero está convenientemente incluido en esta sección para fines de discusión. La mayoría de las personas están familiarizadas con el olor acre de este gas, que puede detectarse en concentraciones tan bajas como 20-50 ppm.
La tradición muere lentamente: ¡un químico inexistente disponible en botellas!
Lo que debes saber al respecto
- Se fabrican más moles de amoníaco que de cualquier otro químico industrial.
- El amoníaco es extremadamente soluble en agua. Una solución acuosa de amoníaco todavía se conoce a veces en el comercio como “hidróxido de amonio”, pero este término ya no es favorecido por los químicos porque nunca se ha demostrado que exista ningún compuesto como NH 4 OH. A pH neutro, alrededor del 99% del amoníaco en el agua existe como iones NH 4 +.
- El amoníaco es un producto final del metabolismo del nitrógeno en la mayoría de los organismos. Una fuente que puede ser familiar para los padres de bebés es la descomposición bacteriana del contenido de los pañales.
- El amoníaco líquido (bp —33°C) se utiliza a menudo como solvente ionizante de laboratorio.
Para qué se utiliza
- El mayor uso del amoníaco (aproximadamente 80%) es como fertilizante, más comúnmente como amoníaco anhidro (el gas se inyecta directamente en el suelo) o después de la conversión a (NH 4) 2 SO 4, NH 4 NO 3, o urea O—C (NH 3) 2.
- El amoníaco se utiliza en la producción de numerosos polímeros, incluyendo nylons y poliuretanos.
- La fabricación de explosivos representa alrededor del 5% de la producción de amoníaco.
- Más allá de estos, hay cientos de usos menores, entre ellos como agente de limpieza doméstico (amoníaco acuático). un refrigerante, y como reactivo de laboratorio.
Cómo se hace
El amoníaco se elabora mediante síntesis directa a partir de los elementos:
\[N_{2(g)} + 3 H_{2(g)} \rightarrow 2 NH_{3(g)}\]
... una reacción de aspecto simple, pero que requirió de un trabajo muy creativo para implementar; el proceso Haber-Bosch es considerado como la síntesis química más importante del siglo XX.
3 Algunos ácidos orgánicos importantes
La mayoría de los ácidos son orgánicos, hay millones de ellos. La función ácida suele ser un grupo hidroxilo conectado a un carbono que está unido a un átomo de oxígeno aceptor de electrones; la combinación es el conocido grupo carboxilo, —COOH. Aquí hay algunos que forman parte de la vida de todos.
Ácido acético
Esto está al lado del ácido fórmico por ser el más simple de los ácidos orgánicos, y en forma de vinagre (una solución al 5-8% en agua) su olor característico es conocido por todos. El ácido puro es un líquido incoloro por encima de 16.7°C; por debajo de esta temperatura forma un sólido cristalino, de ahí el término “ácido acético glacial” que comúnmente se aplica a la sustancia pura. El nombre del ácido proviene del acetum, la palabra latina para vinagre.

Lo que debes saber al respecto
- El ácido puro, aunque bastante débil en el sentido del donante de protones, es bastante corrosivo y sus vapores son muy irritantes.
- Una solución 1.0M del ácido tiene un pH de aproximadamente 2.4, correspondiente a que solo cuatro de cada mil moléculas de CH 3 COOH están disociadas.
Para qué se utiliza
Un poco menos de la mitad de la producción mundial de ácido acético se destina a la producción de polímeros. El producto final visible para la mayoría de la gente serían las botellas de plástico flexibles en las que se vende agua potable. Otros usos están relacionados principalmente con la producción de otros químicos, principalmente anhídrido acético, pero también incluyendo aspirina.

Cómo se hace
La fermentación bacteriana de azúcares ha sido la fuente de vinagre desde la antigüedad, y todavía representa la mayor parte del ácido acético y vinagre de grado alimenticio, pero ahora equivale a solo alrededor del 10% de la producción total de ácido acético:
C 6 H 12 O 6 → 3 CH 3 COOH
Existen varias rutas sintéticas importantes para la producción de ácido acético, pero la principal es tratar el metanol con monóxido de carbono:
CH 3 OH + CO → CH 3 COOH



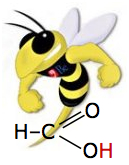 Ácido fórmico
Ácido fórmico Ácido oxálico
Ácido oxálico

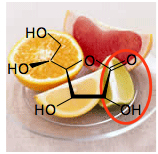
 Aquí no hay grupos carboxilo, pero el grupo -OH a un carbono del doble enlace sigue siendo bastante ácido. Uno de sus isómeros geométricos, el ácido L-ascórbico, es más conocido como Vitamina C; el descubrimiento del papel esencial de esta sustancia en la prevención de la enfermedad del escorbuto (de la que deriva su nombre) rindió dos premios Nobel en 1937. La mayoría de los animales son capaces de sintetizar su propia Vitamina C, pero los primates (junto con los conejillos de indias) parecen haber perdido el gen requerido en algún lugar del camino, por lo que debemos depender de frutas y verduras para nuestro suministro. (Debido a que el ácido ascórbico es soluble en agua, tiende a lixiviarse de las verduras cuando se hierven, por lo que es mucho más saludable cogerlas al vapor).
Aquí no hay grupos carboxilo, pero el grupo -OH a un carbono del doble enlace sigue siendo bastante ácido. Uno de sus isómeros geométricos, el ácido L-ascórbico, es más conocido como Vitamina C; el descubrimiento del papel esencial de esta sustancia en la prevención de la enfermedad del escorbuto (de la que deriva su nombre) rindió dos premios Nobel en 1937. La mayoría de los animales son capaces de sintetizar su propia Vitamina C, pero los primates (junto con los conejillos de indias) parecen haber perdido el gen requerido en algún lugar del camino, por lo que debemos depender de frutas y verduras para nuestro suministro. (Debido a que el ácido ascórbico es soluble en agua, tiende a lixiviarse de las verduras cuando se hierven, por lo que es mucho más saludable cogerlas al vapor).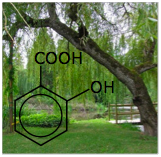
 El ácido en sí resultó ser un poco demasiado irritante para el revestimiento del estómago, por lo que la firma alemana Bayer comenzó a comercializar una versión domesticada, el ácido acetilsalicílico (ASA) bajo el nombre de Aspirina en 1899, y ha ido fuerte desde entonces. Curiosamente, la química detallada de su acción de revivir el dolor y la fiebre no se descubrió hasta 1970.
El ácido en sí resultó ser un poco demasiado irritante para el revestimiento del estómago, por lo que la firma alemana Bayer comenzó a comercializar una versión domesticada, el ácido acetilsalicílico (ASA) bajo el nombre de Aspirina en 1899, y ha ido fuerte desde entonces. Curiosamente, la química detallada de su acción de revivir el dolor y la fiebre no se descubrió hasta 1970.
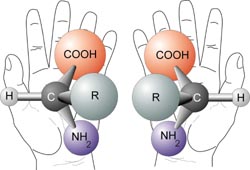
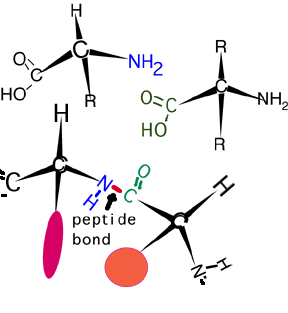 La parte de ácido carboxílico de un aminoácido puede reaccionar con la parte amina de otro para formar un enlace peptídico (un enlace amida) que se muestra aquí.
La parte de ácido carboxílico de un aminoácido puede reaccionar con la parte amina de otro para formar un enlace peptídico (un enlace amida) que se muestra aquí.