11.1: Introducción al Equilibrio Químico
- Page ID
- 70695
- Definir "el estado de equilibrio de un sistema de reacción química”. ¿Cuál es su significado práctico?
- Afirma el significado y significación de los siguientes términos:
- reacción reversible
- reacción cuantitativa
- reacción cinéticamente inhibida
- Explicar el significado de la afirmación "el equilibrio es macroscópicamente estático, pero microscópicamente dinámico”. ¡Muy importante!
- Explicar cómo las magnitudes relacionadas de las constantes de velocidad de reacción directa e inversa en la expresión Mass Action afectan la composición de equilibrio de un sistema de reacción.
- Describe varias cosas que podrías buscar durante un experimento que ayuden a determinar si un sistema de reacción está en su estado de equilibrio.
El cambio químico es uno de los dos conceptos centrales de la ciencia química, siendo el otro la estructura. Los orígenes mismos de la Química misma están enraizados en las observaciones de transformaciones como la combustión de la madera, la congelación del agua, y la obtención de metales de sus minerales que siempre han sido parte de la experiencia humana. Fue, después de todo, la búsqueda de algún tipo de constancia subyacente al cambio lo que llevó a los pensadores griegos de alrededor del 200 a. C. a la idea de elementos y posteriormente a la del átomo. El estudio científico de la materia tardaría casi 2000 años en recoger estos conceptos e incorporarlos a lo que surgiría, en la última parte del siglo XIX, como una visión moderna del cambio químico.
Cambio químico: ¿hasta dónde, qué tan rápido?
El cambio químico ocurre cuando los átomos que componen una o más sustancias se reordenan de tal manera que se forman nuevas sustancias. Estas sustancias son los componentes del sistema de reacción química; aquellos componentes que disminuyen en cantidad se denominan reactivos, mientras que los que aumentan son productos. Un sistema de reacción química dado se define por una ecuación química neta equilibrada que se escribe convencionalmente como
\[\text{reactants} \rightarrow \text{products}\]
Lo primero que necesitamos saber sobre una reacción química representada por una ecuación equilibrada es si realmente puede tener lugar. Si los reactivos y productos son todos sustancias capaces de una existencia independiente, entonces en principio, la respuesta es siempre “sí”. Esta respuesta debe calificarse, sin embargo, por las siguientes consideraciones:
- ¿Qué tan completa es la reacción?
- Es decir, ¿qué fracción de los reactivos se convierten en productos? Algunas reacciones convierten esencialmente el 100% de los reactivos en productos, mientras que para otras la cantidad de productos puede ser indetectable. Muchos están en algún punto intermedio, lo que significa que al final quedan cantidades significativas de todos los componentes. Posteriormente, en otra parte del curso, aprenderás que la tendencia de una reacción a ocurrir puede predecirse enteramente a partir de las propiedades de los reactivos y productos a través de las leyes de la termodinámica.
- ¿Qué tan rápido ocurre la reacción?
- Algunas reacciones terminan en microsegundos; otras tardan años. La velocidad de cualquier reacción puede variar en un amplio rango dependiendo de la temperatura, el estado de la materia (gas, líquido, sólido) y la presencia de un catalizador. A diferencia de la cuestión de la integridad, no existe una manera sencilla de predecir la velocidad de reacción.
- ¿Cuál es el mecanismo de la reacción?
- ¿Qué sucede, a nivel atómico o molecular, cuando los reactivos se transforman en productos? ¿Qué especies intermedias (las que se producen pero luego se consumen para que no aparezcan en la ecuación de reacción neta) están involucradas? Esta es la visión microscópica o cinética del cambio químico, y no puede ser predicha por la teoría ya que se desarrolla actualmente y debe inferirse de los resultados de los experimentos.
Se dice que una reacción que es termodinámicamente posible pero para la que no se dispone de un mecanismo razonablemente rápido está limitada cinéticamente. Por el contrario, uno que ocurre rápidamente pero sólo en pequeña medida es termodinámicamente limitado. Como verá más adelante, a menudo hay formas de sortear ambos tipos de limitaciones, y su descubrimiento y aplicaciones prácticas constituyen un área importante de la química industrial.
¿Qué es el equilibrio?
Básicamente, el término se refiere a lo que podríamos llamar un “equilibrio de fuerzas”. En el caso del equilibrio mecánico, esta es su definición literal. Un libro sentado sobre una mesa permanece en reposo porque la fuerza descendente ejercida por la gravedad terrestre que actúa sobre la masa del libro (esto es lo que se entiende por el “peso” del libro) se equilibra exactamente con la fuerza repulsiva entre átomos que impide que dos objetos ocupen simultáneamente el mismo espacio, actuando en este caso entre la superficie de la mesa y el libro. Si coges el libro y lo elevas por encima del tablero de la mesa, la fuerza ascendente adicional ejercida por tu brazo destruye el estado de equilibrio a medida que el libro se mueve hacia arriba. Si deseas sostener el libro en reposo sobre la mesa, ajustas la fuerza ascendente para equilibrar exactamente el peso del libro, restaurando así el equilibrio.

Un objeto se encuentra en un estado de equilibrio mecánico cuando es estático (inmóvil) o en un estado de movimiento inmutable. De la relación f = ma, es evidente que si la fuerza neta sobre el objeto es cero, su aceleración también debe ser cero, así que si podemos ver que un objeto no está experimentando un cambio en su movimiento, sabemos que está en equilibrio mecánico.
Equilibrio térmico
Otro tipo de equilibrio que todos experimentamos es el equilibrio térmico. Cuando dos objetos se ponen en contacto, el calor fluirá del objeto más cálido al más frío hasta que sus temperaturas se vuelvan idénticas. El equilibrio térmico surge de la tendencia de la energía térmica a ser lo más dispersa o “diluida” posible.
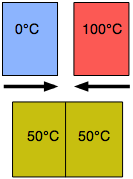
Un objeto metálico a temperatura ambiente se sentirá fresco en tu mano cuando lo recojas por primera vez porque los sensores térmicos en tu piel detectan un flujo de calor de tu mano hacia el metal, pero a medida que el metal se acerca a la temperatura de tu mano, esta sensación disminuye. El tiempo que se necesita para lograr el equilibrio térmico depende de la facilidad con la que se conduzca el calor dentro y entre los objetos; por lo tanto, un objeto de madera se sentirá más cálido que un objeto metálico incluso si ambos están a temperatura ambiente porque la madera es un conductor térmico relativamente pobre y, por lo tanto, eliminará el calor de su mano más despacio.
El equilibrio térmico es algo que muchas veces queremos evitar, o al menos posponer; es por eso que aislamos edificios, transpiramos en verano y usamos ropa más pesada en el invierno.
Equilibrio químico
Cuando se produce una reacción química en un recipiente que impide la entrada o escape de alguna de las sustancias involucradas en la reacción, las cantidades de estos componentes cambian a medida que algunos se consumen y se forman otros. Eventualmente este cambio llegará a su fin, tras lo cual la composición permanecerá inalterada mientras el sistema permanezca intacto. Entonces se dice que el sistema está en su estado de equilibrio, o más simplemente, “en equilibrio”.
Por qué las reacciones van hacia el equilibrio
¿Cuál es la naturaleza del “equilibrio de fuerzas” que impulsa una reacción hacia el equilibrio químico? Es esencialmente el equilibrio alcanzado entre la tendencia de la energía a residir dentro de los enlaces químicos de las moléculas estables, y su tendencia a dispersarse y diluirse. Las reacciones exotérmicas son particularmente efectivas en esto, porque el calor liberado se dispersa en el mundo infinitamente más amplio de los alrededores.
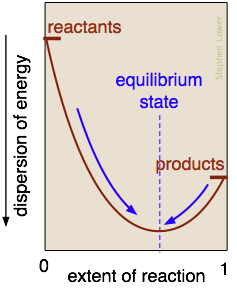
En la reacción aquí representada, este punto de equilibrio se produce cuando aproximadamente el 60% de los reactivos se han convertido en productos. Una vez que se haya alcanzado este estado de equilibrio, no se producirá ningún cambio neto adicional. Los únicos cambios espontáneos que se permiten siguen a las flechas apuntando hacia la máxima dispersión de energía.
¡El equilibrio es la muerte!
El equilibrio químico es algo que definitivamente quieres evitar por ti mismo el mayor tiempo posible. La miríada de reacciones químicas en los organismos vivos se mueven constantemente hacia el equilibrio, pero se les impide llegar allí mediante la entrada de reactivos y la eliminación de productos. Entonces, en lugar de estar en equilibrio, tratamos de mantener una condición de “estado estable” que los fisiólogos llaman homeostasis, mantenimiento de un ambiente interno constante. ¡El equilibrio es la muerte!
Por el momento, es muy importante que conozcas esta definición:
La dirección en la que se escribe una reacción química (y por lo tanto qué componentes se consideran reactivos y cuáles son productos) es arbitraria. Considera las siguientes dos reacciones:
\[\underset{\text{synthesis of hydrogen iodide}}{H_2 + I_2 \rightarrow 2 HI} \label{10.1}\]
\[\underset{\text{dissociation of hydrogen iodide}}{2 HI \rightarrow H_2 + I_2} \label{10.2}\]
Las ecuaciones\(\ref{10.1}\) y\(\ref{10.2}\) representan el mismo sistema de reacción química en el que se invierten los papeles de los componentes, y ambos producen la misma mezcla de componentes cuando se completa el cambio. Esto es fundamental para el concepto de equilibrio químico. No hace diferencia si comenzamos con dos moles de HI o un mol cada uno de H 2 e I 2; una vez que la reacción se haya completado, las cantidades de estos dos componentes serán las mismas. En general, entonces, podemos decir que la composición de un sistema de reacción química tenderá a cambiar en una dirección que lo acerque a su composición de equilibrio. Una vez que se ha alcanzado esta composición de equilibrio, no se producirá ningún cambio adicional en las cantidades de los componentes mientras el sistema permanezca intacto.
La composición de un sistema de reacción química tenderá a cambiar en una dirección que lo acerque a su composición de equilibrio.
Los dos diagramas a continuación muestran cómo las concentraciones de los tres componentes de esta reacción química cambian con el tiempo. Examine cuidadosamente los dos conjuntos de gráficas, señalando qué sustancias tienen concentraciones iniciales cero y, por lo tanto, son “productos” de las ecuaciones de reacción mostradas. Satisfacer que estos dos conjuntos representan el mismo sistema de reacción química, pero con las reacciones que ocurren en direcciones opuestas. Lo más importante es observar cómo las concentraciones finales (equilibrio) de los componentes son las mismas en los dos casos.
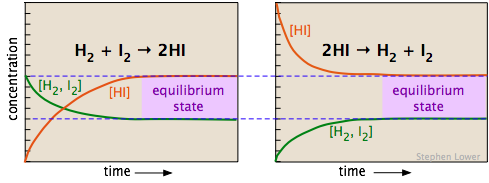
Ya sea que se inicie con una mezcla equimolar de H 2 e I 2 (izquierda) o una muestra pura de yoduro de hidrógeno (mostrada a la derecha, utilizando el doble de la concentración inicial de HI para mantener igual el número de átomos), se alcanza la composición después del equilibrio (regiones sombreadas en el derecha) será lo mismo.
La composición de equilibrio es independiente de la dirección desde la que se aproxima (es decir, las condiciones iniciales).
Una ecuación química de la forma A → B representa la transformación de A en B, pero no implica que todos los reactivos se conviertan en productos, o que la reacción inversa B → A tampoco pueda ocurrir. En general, se puede esperar que ocurran ambos procesos (directo e inverso), dando como resultado una mezcla de equilibrio que contiene cantidades finitas de todos los componentes del sistema de reacción. (Utilizamos la palabra componentes cuando no deseamos distinguir entre reactivos y productos.)
Si el estado de equilibrio es aquel en el que están presentes cantidades significativas tanto de reactivos como de productos (como en el ejemplo de yoduro de hidrógeno dado anteriormente), entonces se dice que la reacción es incompleta o reversible. Este último término es preferible porque evita confusiones con “completo” en su otro sentido de ser completado o terminado, lo que implica que la reacción ha seguido su curso y ahora está en equilibrio.
Tenga en cuenta que no hay diferencia fundamental entre los significados de A → B y A B. Algunos libros de texto más antiguos solo usan A = B.
- Si se desea enfatizar la reversibilidad de una reacción, la flecha única en la ecuación se reemplaza por un par de líneas en forma de gancho que apuntan en direcciones opuestas, como en A
B.
- Se dice que una reacción es completa o cuantitativa cuando la composición de equilibrio no contiene una cantidad significativa de los reactivos. Sin embargo, una reacción que se completa cuando se escribe en una dirección se dice que “no ocurre” cuando se escribe en la dirección inversa.
En principio, todas las reacciones químicas son reversibles, pero esta reversibilidad puede no ser observable si la fracción de productos en la mezcla de equilibrio es muy pequeña, o si la reacción inversa es muy lenta (el término del químico es "cinéticamente inhibido “)
¿Cómo ayudó Napoleón Bonaparte a descubrir reacciones reversibles?
Podemos agradecer a Napoleón por traer el concepto de reversibilidad de reacción a la Química. Napoleón reclutó al eminente químico francés Claude Louis Berthollet (1748-1822) para que lo acompañara como asesor científico en la más lejana de sus campañas, la expedición a Egipto en 1798. Una vez en Egipto, Berthollet notó depósitos de carbonato de sodio alrededor de los bordes de algunos lagos de sal que allí se encuentran. Ya estaba familiarizado con la reacción
\[Na_2CO_3 + CaCl_2 \rightarrow CaCO_3 + 2 NaCl \label{10.3}\]
que se sabía que procedía a su finalización en el laboratorio. De inmediato se dio cuenta de que el Na 2 CO 3 debió haberse formado por el reverso de este proceso provocado por la altísima concentración de sal en las aguas que se evaporan lentamente. Esto llevó a Berthollet a cuestionar la creencia de la época de que una reacción sólo podía proceder en una sola dirección. Su famoso libro de texto Essai de statique chimique (1803) presentó sus especulaciones sobre la afinidad química y su descubrimiento de que un exceso del producto de una reacción podría conducirlo en sentido inverso.
Desafortunadamente, Berthollet se dejó llevar un poco por la idea de que una reacción podría verse influenciada por las cantidades de sustancias presentes, y sostuvo que lo mismo debería ser cierto para las composiciones de compuestos individuales. Esto lo puso en conflicto con la recientemente aceptada Ley de Proporciones Definidas (que un compuesto se compone de números fijos de sus átomos constituyentes), por lo que sus ideas (las buenas junto con las malas) fueron rápidamente desacreditadas y permanecieron en gran parte olvidadas durante 50 años. (Irónicamente, ahora se sabe que ciertas clases de compuestos de hecho exhiben una composición variable del tipo que Berthollet imaginó.)
¿Cuál es la ley de la acción masiva?
Las ideas de Berthollet sobre las reacciones reversibles fueron finalmente reivindicadas por experimentos realizados por otros, especialmente los químicos noruegos (y cuñados) Cato Guldberg y Peter Waage. Durante el periodo 1864-1879 mostraron que un equilibrio puede ser abordado desde cualquier dirección (ver la ilustración de yoduro de hidrógeno anterior), implicando que cualquier reacción
\[aA + bB \rightarrow cC + dD\]
es realmente una competencia entre una reacción “delantera” y una reacción “inversa”. Cuando una reacción está en equilibrio, las velocidades de estas dos reacciones son idénticas, por lo que no se observa ningún cambio neto (macroscópico), aunque los componentes individuales se están transformando activamente a nivel microscópico.
¡El Equilibrio Químico es dinámico!
Guldberg y Waage demostraron que para una reacción
\[aA + bB \rightarrow cC + dD\]
la velocidad (velocidad) de la reacción en cualquier dirección es proporcional a lo que llamaron las “masas activas” de los diversos componentes:
- velocidad de reacción directa = k f [A] a [B] b
- velocidad de reacción inversa = k r [C] c [D] d
en el que las constantes de proporcionalidad k se denominan constantes de velocidad y las cantidades entre corchetes representan concentraciones. Si combinamos los dos reactivos A y B, la reacción directa comienza inmediatamente; luego, a medida que los productos C y D comienzan a acumularse, se inicia el proceso inverso. A medida que avanza la reacción, la velocidad de la reacción directa disminuye mientras que la de la reacción inversa aumenta. Finalmente, los dos procesos avanzan a la misma velocidad, y la reacción está en equilibrio:
velocidad de reacción directa = velocidad de reacción inversa
\[k_f [A]^a [B]^b = k_r [C]^c [D]^d\]
Es muy importante que entiendas el significado de esta relación. El estado de equilibrio es aquel en el que no hay cambio neto en las cantidades de reactivos y productos. Pero no confundas esto con un estado de “no cambio”; en equilibrio, las reacciones hacia adelante y hacia atrás continúan, pero a ritmos idénticos, esencialmente cancelándose entre sí.
El equilibrio es macroscópicamente estático, ¡pero microscópicamente dinámico! Para ilustrar mejor el carácter dinámico del equilibrio químico, supongamos que ahora cambiamos la composición del sistema previamente en equilibrio agregando algo de C o retirando algo de A (cambiando así sus “masas activas”). La tasa inversa superará temporalmente la tasa de avance y se producirá un cambio en la composición (“un cambio en el equilibrio”) hasta que se logre una nueva composición de equilibrio.Composición del Estado de Equilibrio Depende de la relación de las constantes de velocidad hacia adelante y hacia atrás.
Asegúrese de comprender la diferencia entre la velocidad de una reacción y una constante de velocidad. Este último, generalmente designado por k, relaciona la velocidad de reacción con la concentración de uno o más de los componentes de la reacción —por ejemplo, velocidad = k [A]. En equilibrio las tasas de los procesos directo e inverso son idénticas, pero las constantes de velocidad son generalmente diferentes. Para ver cómo funciona esto, considere la reacción simplificada A → B en los siguientes tres escenarios.
- k f >> k r
- Si las constantes de velocidad son muy diferentes (en muchos órdenes de magnitud), entonces esto requiere que las concentraciones de equilibrio de los productos superen las de los reactivos en la misma proporción. Así, la composición de equilibrio estará fuertemente a la “derecha”; se puede decir que la reacción es “completa” o “cuantitativa”.

- k f << k r
- Las tasas sólo pueden ser idénticas (equilibrio alcanzado) si las concentraciones de los productos son muy pequeñas. Describimos el equilibrio resultante como fuertemente favoreciendo a la izquierda; se forma muy poco producto. En los casos más extremos, podríamos incluso decir que “la reacción no tiene lugar”.

- k f ≈ k r
- Si k f y k r tienen valores comparables (dentro de, digamos, varios órdenes de magnitud), entonces concentraciones significativas de productos y reactivos están presentes en equilibrio; decimos que la reacción es “incompleta” y “reversible”.
Las imágenes que se muestran a continuación ofrecen otra forma más de ver estos tres casos. Las gráficas muestran cómo cambian las concentraciones relativas del reactivo y del producto durante el transcurso de la reacción. Las parcelas difieren en los supuestos que hacemos sobre la relación de k f a k r. La composición de equilibrio del sistema se ilustra por las proporciones de A y B en las partes horizontales de cada parcela donde la composición permanece sin cambios. En cada caso, las dos constantes de velocidad son suficientemente cercanas en magnitud para que cada reacción pueda considerarse “incompleta”.
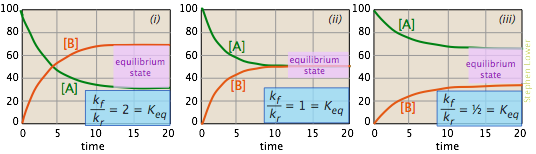
- En la gráfica (i) la constante de velocidad directa es dos veces más grande que la constante de velocidad inversa, por lo que se favorece el producto (B), pero hay suficiente reacción inversa para mantener una cantidad significativa de A.
- En (ii), las constantes de velocidad hacia adelante y hacia atrás tienen magnitudes idénticas. No en vano, también lo son los valores de equilibrio de [A] y [B].
- En (iii), la constante de velocidad inversa excede la constante de velocidad directa, por lo que la composición de equilibrio definitivamente está “a la izquierda”.
La Ley de Acción de Masas es, pues, esencialmente la afirmación de que la composición de equilibrio de una mezcla de reacción puede variar según las cantidades de componentes que estén presentes. Esto por supuesto es justo lo que Berthollet observó en sus estanques salinos egipcios, pero ahora entendemos que es una consecuencia de la naturaleza dinámica del equilibrio químico.
¿Cuándo es una Reacción en Equilibrio?
Claramente, si observamos que se produce algún cambio, un cambio de color, la liberación de burbujas de gas, la aparición de un precipitado o la liberación de calor, sabemos que la reacción aún no está en equilibrio. Sin embargo, la ausencia de cualquier cambio aparente no establece por sí misma que la reacción esté en equilibrio. El estado de equilibrio es aquel en el que no sólo no se produce ningún cambio en la composición, sino en el que no se presenta ninguna tendencia energética para un mayor cambio. Desafortunadamente, ¡la “tendencia” no es una propiedad que sea directamente observable! Consideremos, por ejemplo, la reacción que representa la síntesis del agua a partir de sus elementos:
\[2 H_{2(g)} + O_{2(g)} \rightarrow 2 H_2O_{(g)} \label{10.5}\]
Puede almacenar los dos reactivos gaseosos en el mismo recipiente indefinidamente sin que se produzca ningún cambio observable. Pero si creas una chispa eléctrica en el contenedor o introduces una llama, ¡bang! Después de que te levantes del piso y te quitas la metralla de lo que queda de tu cuerpo, ¡sabrás muy bien que el sistema no estaba inicialmente en equilibrio! Ocurre que esta reacción en particular tiene una tremenda tendencia a darse, pero por razones que discutiremos en un capítulo posterior, nada puede pasar hasta que “la activemos” de alguna manera— en este caso exponiendo la mezcla a una llama o chispa, o (de una manera más suave) introduciendo un alambre de platino, que actúa como catalizador.
Se dice que una reacción de este tipo es altamente favorecida termodinámicamente, pero inhibida cinéticamente. La reacción similar de hidrógeno y yodo
\[H_{2(g)} + I_{2(g)} \rightarrow 2 HI_{(g)} \label{10.6}\]
por el contrario, solo se ve moderadamente favorecida termodinámicamente (y por lo tanto es incompleta), pero su cinética es poco espectacular y razonablemente fácil.
Algunas Pruebas Simples para el Estado de Equilibrio
- Como explicamos anteriormente en el contexto de la ley de acción masiva, la adición o remoción de un componente de la reacción afectará las cantidades de todos los demás. Por ejemplo, si añadimos más de un reactivo, esperaríamos ver cambiar la concentración de un producto. Si esto no sucede, entonces es probable que la reacción se inhiba cinéticamente y que el sistema sea incapaz de alcanzar el equilibrio.
- Casi siempre ocurre, sin embargo, que una vez que realmente comienza una reacción, continuará por sí sola hasta que alcance el equilibrio, así que si podemos observar el cambio tal como ocurre y verlo ralentizar y detenerse, podemos estar razonablemente seguros de que el sistema está en equilibrio. Este es, con mucho, el criterio más común del químico.
- Existe otra prueba experimental para el equilibrio en una reacción química, aunque en realidad solo es aplicable al tipo de reacciones que describimos anteriormente como reversibles. Como veremos más adelante, el estado de equilibrio de un sistema siempre es sensible a la temperatura, y muchas veces a la presión, por lo que cualquier cambio en estas variables, sin embargo, pequeño, interrumpirá temporalmente el equilibrio, resultando en un cambio observable en la composición del sistema a medida que avanza hacia su nuevo estado de equilibrio.
Resumen
Asegúrese de comprender a fondo las siguientes ideas esenciales que se han presentado anteriormente.
- Cualquier reacción que pueda ser representada por una ecuación química equilibrada puede tener lugar, al menos en principio. Sin embargo, hay dos calificaciones importantes:
- La tendencia a que se produzca el cambio puede ser tan pequeña que la cantidad de productos formados puede ser muy baja, y quizás insignificante.
Se dice que una reacción de este tipo está inhibida termodinámicamente. La tendencia al cambio químico se rige únicamente por las propiedades de los reactivos y productos, y puede predecirse aplicando las leyes de la termodinámica. - La velocidad a la que procede la reacción puede ser muy pequeña, o incluso cero, en cuyo caso decimos que la reacción está cinéticamente inhibida. Las velocidades de reacción dependen del mecanismo de la reacción, es decir, de lo que realmente sucede con los átomos a medida que los reactivos se transforman en productos. Los mecanismos de reacción generalmente no pueden predecirse, y deben elaborarse experimentalmente. Además, la misma reacción puede tener diferentes mecansims bajo diferentes condiciones.
- La tendencia a que se produzca el cambio puede ser tan pequeña que la cantidad de productos formados puede ser muy baja, y quizás insignificante.
- A medida que avanza un cambio químico, las cantidades de los componentes en un lado de la ecuación de reacción disminuirán, y las del otro lado aumentarán. Eventualmente la reacción se ralentiza y la composición del sistema deja de cambiar. En este punto la reacción se encuentra en su estado de equilibrio, y no se producirá ningún cambio adicional en la composición mientras el sistema quede inalterado.
- Para muchas reacciones, el estado de equilibrio es aquel en el que los componentes de ambos lados de la ecuación (es decir, tanto reactivos como productos) están presentes en cantidades significativas. Se dice que tal reacción es incompleta o reversible.
- La composición de equilibrio es independiente de la dirección desde la que se aborda; el etiquetado de las sustancias como “reactivos” o “productos” es enteramente una cuestión de conveniencia. (Ver las gráficas de reacción de yoduro de hidrógeno anteriores.)
- La ley de acción masiva establece que cualquier cambio químico es una competencia entre una reacción directa (de izquierda a derecha en la ecuación química) y una reacción inversa. La velocidad de cada uno de estos procesos se rige por las concentraciones de las sustancias que reaccionan; a medida que avanza la reacción, estas velocidades se acercan entre sí y en equilibrio se vuelven idénticas.
- De lo anterior se deduce que el equilibrio es un proceso dinámico en el que continúa ocurriendo el cambio microscópico (las reacciones hacia adelante y hacia atrás), pero el cambio macroscópico (cambios en las cantidades de sustancias) está ausente.
- Cuando una reacción química está en equilibrio, cualquier alteración del sistema, como un cambio de temperatura, o la adición o eliminación de uno de los componentes de la reacción, “desplazará” la composición a un nuevo estado de equilibrio. Esta es la única forma inequívoca de verificar que una reacción está en equilibrio. El hecho de que la composición permanezca estática no prueba en sí mismo que una reacción esté en equilibrio, porque el cambio puede ser cinéticamente inhibido.


