11.2: Principio de Le Chatelier
- Page ID
- 70689
Asegúrese de comprender a fondo las siguientes ideas esenciales:
- Un sistema en su estado de equilibrio permanecerá en ese estado indefinidamente mientras no se altere. Si el equilibrio se destruye sometiendo el sistema a un cambio de presión, temperatura, o el número de moles de una sustancia, entonces tenderá a producirse una reacción neta que mueve al sistema a un nuevo estado de equilibrio. El principio de Le Chatelier dice que esta reacción neta ocurrirá en una dirección que compensará parcialmente el cambio.
- El Principio de Le Chatelier solo tiene efecto práctico para reacciones en las que cantidades significativas tanto de reactivos como de productos están presentes en equilibrio, es decir, para reacciones que son termodinámicamente reversibles.
- La adición de más sustancias productoras a una mezcla de equilibrio desplazará el equilibrio hacia la izquierda; la adición de más sustancias reaccionantes lo desplazará hacia la derecha. Estos efectos se explican fácilmente en términos de reacciones competitivas hacia adelante y hacia atrás, es decir, por la ley de la acción de masas.
- Si una reacción es exotérmica (libera calor), un aumento en la temperatura forzará el equilibrio hacia la izquierda, provocando que el sistema absorba calor y por lo tanto parcialmente ajustando el aumento de temperatura. El efecto contrario ocurre para las reacciones endotérmicas, que se desplazan hacia la derecha por el aumento de la temperatura.
- El efecto de la presión sobre un equilibrio es significativo solo para reacciones que involucran diferentes números de moles de gases en los dos lados de la ecuación. Si el número de moles de gases aumenta, entonces un incremento en la presión total tenderá a iniciar una reacción inversa que consume algunos de los productos, reduciendo parcialmente el efecto del aumento de presión.
- El ejemplo clásico del uso práctico del principio Le Chatelier es el proceso Haber-Bosch para la síntesis de amoníaco, en el que se debe encontrar un equilibrio entre baja temperatura y alta presión.
El Módulo anterior enfatizó el carácter dinámico del equilibrio tal como lo expresa la Ley de Acción de Masas. Esta ley sirve como modelo explicando cómo la composición del estado de equilibrio se ve afectada por las “masas activas” (concentraciones) de reactivos y productos. En esta lección, desarrollamos las consecuencias de esta ley para responder a la pregunta muy práctica de cómo una composición de equilibrio existente se ve afectada por la adición o retirada de uno de los componentes.
Principio de Le Chatelier
Si una reacción está en equilibrio y alteramos las condiciones para crear un nuevo estado de equilibrio, entonces la composición del sistema tenderá a cambiar hasta que se alcance ese nuevo estado de equilibrio. (Decimos “tienden a cambiar” porque si la reacción se inhibe cinéticamente, el cambio puede ser demasiado lento para observarlo o puede que nunca se produzca). En 1884, el ingeniero químico y maestro francés Henri Le Chatelier (1850-1936) demostró que en cada uno de esos casos, el nuevo estado de equilibrio es aquel que reduce parcialmente el efecto del cambio que lo provocó.
Esta ley es conocida por todos los estudiantes de Química como el principio de Le Chatelier. Su formulación original era algo complicada, pero una paráfrasis razonablemente útil de la misma dice lo siguiente:
Principio de Le Chatelier: Si un sistema en equilibrio se somete a un cambio de presión, temperatura, o el número de moles de un componente, habrá una tendencia a una reacción neta en la dirección que reduzca el efecto de este cambio.
Para ver cómo funciona esto (y debes hacerlo, ya que esto es de tal importancia fundamental que simplemente no puedes hacer ninguna química significativa sin una comprensión profunda de este principio), mira nuevamente la reacción de disociación del yoduro de hidrógeno
\[2 HI \rightarrow H_2 + I_2\]
Consideremos una mezcla arbitraria de estos tres componentes en equilibrio, y supongamos que inyectamos más gas hidrógeno en el contenedor. Debido a que la concentración de H 2 ahora supera su nuevo valor de equilibrio, el sistema ya no está en su estado de equilibrio, por lo que ahora se produce una reacción neta a medida que el sistema se mueve al nuevo estado.
El principio de Le Chatelier establece que la reacción neta será en una dirección que tiende a reducir el efecto del H 2 agregado. Esto puede ocurrir si parte del H 2 se consume al reaccionar con I 2 para formar más HI; en otras palabras, se produce una reacción neta en sentido inverso. Los químicos suelen decir simplemente que “el equilibrio se desplaza hacia la izquierda”.
Para tener una mejor idea de cómo funciona esto, examine cuidadosamente el diagrama a continuación que sigue las concentraciones de los tres componentes de esta reacción, ya que podrían cambiar en el tiempo (la escala de tiempo aquí normalmente será de aproximadamente una hora):
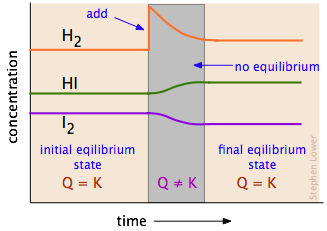
Disrupción y restauración del equilibrio. A la izquierda, las concentraciones de los tres componentes no cambian con el tiempo porque el sistema está en equilibrio. Luego agregamos más hidrógeno al sistema, interrumpiendo el equilibrio. Luego se produce una reacción neta que mueve el sistema a un nuevo estado de equilibrio (derecha) en el que la cantidad de yoduro de hidrógeno ha aumentado; en el proceso, se consumen algunos de los I 2 y H 2. Observe que el nuevo estado de equilibrio contiene más hidrógeno que el estado inicial, pero no tanto como se agregó; como predice el principio de Le Chatelier, el cambio que hicimos (adición de H 2) ha sido parcialmente contrarrestado por el “giro a la derecha”. Tabla\(\PageIndex{1}\) Contiene varios ejemplos que muestran cómo cambiar la cantidad de un componente de reacción puede cambiar un equilibrio establecido.
|
|
|
resultado
|
|---|---|---|
| CO 2 + H 2 → H 2 O (g) + CO | se agrega un agente de secado para absorber H 2 O | Desplazarse a la derecha. La eliminación continua de un producto forzará cualquier reacción a la derecha |
| H 2 (g) + I 2 (g) → 2HI (g) | Se agrega algo de gas nitrógeno | Sin cambios; N 2 no es un componente de este sistema de reacción. |
| NaCl (s) + H 2 SO 4 (l) → Na 2 SO 4 (s) + HCl (g) | la reacción se lleva a cabo en un recipiente abierto | Debido a que el HCl es un gas que puede escapar del sistema, la reacción se fuerza a la derecha. Esta es la base para la producción comercial de ácido clorhídrico. |
| H 2 O (l) → H 2 O (g) | el agua se evapora de un recipiente abierto | La eliminación continua del vapor de agua obliga a la reacción a la derecha, por lo que nunca se logra el equilibrio. |
| HCN (aq) → H + (aq) + CN — (aq) | la solución se diluye | Desplazarse hacia la derecha; el producto [H +] [CN —] disminuye más rápidamente que [HCN]. |
| AgCl (s) → Ag + (aq) + Cl — (aq) | se agrega algo de NaCl a la solución | Desplazamiento hacia la izquierda debido al incremento en Cl — concentración. Esto se conoce como el efecto común de iones sobre la solubilidad. |
| N 2 + 3 H 2 → 2 NH 3 | se agrega un catalizador para acelerar esta reacción | Sin cambios. Los catalizadores afectan solo la velocidad de una reacción; los catalizadores no tienen ningún efecto sobre la composición del estado de equilibrio. |
¿Cómo afectan los cambios de temperatura a Equilibrios?
Prácticamente todas las reacciones químicas van acompañadas de la liberación o absorción de calor. Si consideramos al calor como un “reactivo” o “producto” en una reacción endotérmica o exotérmica respectivamente, podemos usar el principio de Le Chatelier para predecir la dirección en la que un aumento o disminución de la temperatura desplazará el estado de equilibrio. Así, para la oxidación del nitrógeno, un proceso endotérmico, podemos escribir
\[\text{[heat]} + N_2 + O_2 \rightleftharpoons 2 NO\]
Supongamos que esta reacción está en equilibrio a alguna temperatura\(T_1\) y elevamos la temperatura a\(T_2\). El principio de Le Chatelier nos dice que se producirá una reacción neta en la dirección que contrarrestará parcialmente este cambio. Dado que la reacción es endotérmica, se producirá un desplazamiento del equilibrio hacia la derecha.

El óxido nítrico, producto de esta reacción, es uno de los principales contaminantes del aire que inicia una secuencia de pasos que conducen a la formación de smog atmosférico. Su formación es una reacción secundaria no deseada que se produce cuando el aire (que se introduce en la cámara de combustión de un motor para suministrar oxígeno) se calienta a una temperatura alta. Los diseñadores de motores de combustión interna ahora intentan, por diversos medios, limitar la temperatura en la región de combustión, o restringir su parte de mayor temperatura a un pequeño volumen dentro de la cámara de combustión.
¿Cómo afectan los cambios en la presión a los equilibrios?
Recordará que si se reduce la presión de un gas, su volumen aumentará; la presión y el volumen son inversamente proporcionales. Con esto en mente, supongamos que la reacción
\[2 NO_{2(g)} \rightleftharpoons N_2O_{4(g)}\]
está en equilibrio a alguna temperatura y presión arbitrarias, y que duplicamos la presión, tal vez comprimiendo la mezcla a un volumen menor. Por el principio de Le Chatelier sabemos que el estado de equilibrio cambiará a uno que tienda a contrarrestar el aumento de la presión. Esto puede ocurrir si parte del NO 2 reacciona para formar más del tetroóxido de dinitrógeno, ya que se están retirando dos moles de gas del sistema por cada mol de N 2 O 4 formado, disminuyendo así el volumen total del sistema. De esta manera, aumentar la presión desplazará este equilibrio hacia la derecha.
\[Δn_g = (n_{products} – n_{reactants}) = 1 – 2 = –1.\]
En el caso de la reacción de oxidación de nitrógeno
\[N_2 + O_2 \rightleftharpoons 2 NO\]
Δ n g = 0 y el cambio de presión no tendrá ningún efecto sobre el equilibrio.
Los volúmenes de sólidos y líquidos apenas se ven afectados por la presión en absoluto, por lo que para reacciones que no involucran sustancias gaseosas, los efectos de los cambios de presión son normalmente insignificantes. Las excepciones surgen en condiciones de muy alta presión como las que existen en el interior de la Tierra o cerca del fondo del océano. Un buen ejemplo es la disolución del carbonato de calcio
\[CaCO_{3(s)} \rightleftharpoons Ca^{2+} + CO_3^{2–}\]
Hay una ligera disminución en el volumen cuando se lleva a cabo esta reacción, por lo que un aumento en la presión desplazará el equilibrio hacia la derecha, con los resultados de que el carbonato de calcio se vuelve más soluble a presiones más altas.
Los esqueletos de varias variedades de organismos microscópicos que habitan la cima del océano están hechos de CaCo 3, por lo que existe una lluvia continua de esta sustancia hacia el fondo del océano a medida que estos organismos mueren. Como consecuencia, el fondo del océano Atlántico se cubre con una manta de carbonato de calcio. Esto no es cierto para el océano Pacífico, que es más profundo; una vez que los esqueletos caen por debajo de cierta profundidad, la mayor presión hace que se disuelvan. Algunos de los montes submarinos (montañas submarinas) en el Pacífico se extienden por encima del límite de solubilidad de manera que sus partes superiores están cubiertas con sedimentos de CaCo 3.
El efecto de la presión sobre una reacción que involucra sustancias cuyos puntos de ebullición se encuentran dentro del rango de temperatura comúnmente encontrado será sensible a los estados de estas sustancias a la temperatura de interés. Para las reacciones que involucran gases, solo son importantes los cambios en las presiones parciales de aquellos gases directamente involucrados en la reacción; la presencia de otros gases no tiene ningún efecto.
La producción comercial de hidrógeno se lleva a cabo tratando gas natural con vapor a altas temperaturas y en presencia de un catalizador (“reformado con vapor de metano”):
\[CH_4 + H_2O \rightleftharpoons CH_3OH + H_2 \nonumber\]
Dados los siguientes puntos de ebullición: CH 4 (metano) = —161°C, H 2 O = 100°C, CH 3 OH = 65°, H 2 = —253°C, predicen los efectos de un incremento en la presión total sobre este equilibrio a 50°, 75° y 120°C.
Solución
Calcular el cambio en los moles de gas para cada proceso:
|
temp
|
ecuación
|
\(Δn_g\)
|
turno
|
|---|---|---|---|
|
50° |
CH 4 (g) + H 2 O (l) → CH 3 OH (l) + H 2 (g) | 0 | ninguno |
| 75° | CH 4 (g) + H 2 O (l) → CH 3 OH (g) + H 2 (g) | +1 | a la izquierda |
| 120° | CH 4 (g) + H 2 O (g) → CH 3 OH (g) + H 2 (g) | 0 | ninguno |
El Proceso Haber y por qué es importante
El proceso Haber para la síntesis de amoníaco se basa en la reacción exotérmica
N 2 (g) + 3 H 2 (g) → 2 NH 3 (g) Δ H = —92 kJ/mol
El principio de Le Chatelier nos dice que para maximizar la cantidad de producto en la mezcla de reacción, se debe realizar a alta presión y baja temperatura. Sin embargo, cuanto menor es la temperatura, más lenta es la reacción (esto es cierto en prácticamente todas las reacciones químicas). Siempre que se tuviera que elegir entre un bajo rendimiento de amoníaco rápidamente o un alto rendimiento durante un largo periodo de tiempo, esta reacción fue inviable económicamente.
El nitrógeno está disponible de forma gratuita, siendo el componente principal del aire, pero el fuerte triple enlace en N 2 hace que sea extremadamente difícil incorporar este elemento en especies como NO 3 — y NH 4 + que sirven como puntos de partida para la amplia variedad de compuestos que contienen nitrógeno que son esenciales para la industria moderna. Esta conversión se conoce como fijación de nitrógeno, y debido a que el nitrógeno es un nutriente vegetal esencial, la agricultura intensiva moderna depende completamente de enormes cantidades de nitrógeno fijo en forma de fertilizante. Hasta alrededor de 1900, la principal fuente de nitrógeno fijo era el NaNO 3 encontrado en extensos depósitos en América del Sur. Varios procesos químicos para la obtención de compuestos nitrogenados se desarrollaron a principios de la década de 1900, pero demostraron ser demasiado ineficientes para satisfacer la creciente demanda.
Aunque la síntesis directa de amoníaco a partir de sus elementos se conocía desde hace algún tiempo, se encontró que el rendimiento del producto era insignificante. En 1905, Fritz Haber (1868-1934) comenzó a estudiar esta reacción, empleando el pensamiento iniciado por Le Chatelier y otros, y el campo recién desarrollado de la termodinámica que sirvió como base de estos principios. Solo de la ley de Le Chatelier, es evidente que esta reacción exotérmica se ve favorecida por la baja temperatura y la alta presión. Sin embargo, no fue tan simple como eso: la velocidad de cualquier reacción aumenta con la temperatura, por lo que trabajando solo con la temperatura, se tiene la opción entre un alto rendimiento de producto logrado solo muy lentamente, o un rendimiento muy bajo rápidamente. Además, el equipo y los aceros aleados de alta resistencia que necesitan para construirlo no existían en ese momento. Haber resolvió el primer problema desarrollando un catalizador que aceleraría enormemente la reacción a temperaturas más bajas.
El segundo problema, y el desarrollo de una forma eficiente de producir hidrógeno, retrasaría la implementación práctica del proceso hasta 1913, cuando llegó la primera planta basada en el proceso Haber-Bosch (como es más bien conocido, siendo Carl Bosch quien resolvió los principales problemas de ingeniería) en funcionamiento. El momento no podría haber sido mejor para Alemania, ya que este país estaba a punto de entrar en la Primera Guerra Mundial, y los Aliados habían establecido un bloqueo naval a Sudamérica, cortando el suministro de nitrato para la industria alemana de municiones.
La planta de Bosch operó el reactor de amoníaco a 200 atm y 550 °C; más tarde, cuando se desarrollaron aceros aleados más fuertes, las presiones de 800-1000 atm se volvieron comunes. La fuente de hidrógeno en las plantas modernas suele ser el gas natural, que en su mayoría es metano:
| CH 4 + H 2 O → CO + 3 H 2 | formación de gas de síntesis a partir de metano |
| CO + H 2 O → CO 2 + H 2 | reacción de desplazamiento llevada a cabo en el reformador |
El proceso Haber-Bosch es considerado como la síntesis química más importante desarrollada en el siglo XX. Además de su importancia científica como primera aplicación a gran escala de las leyes del equilibrio químico, ha tenido un tremendo impacto económico y social; sin una fuente económica de nitrógeno fijo, la producción intensiva de cultivos requerida para alimentar a la creciente población mundial hubiera sido imposible. Haber fue galardonado con el Premio Nobel de Química de 1918 en reconocimiento a su obra. Carl Bosch, quien mejoró el proceso, ganó el Premio Nobel en 1931.
El principio de Le Chatelier en Fisiología
Muchas de las reacciones químicas que ocurren en los organismos vivos están reguladas por el principio de Le Chatelier.
Transporte de oxígeno por la sangre
Pocos de estos son más importantes para los organismos de sangre caliente que los que se relacionan con la respiración aeróbica, en la que el oxígeno se transporta a las células donde se combina con la glucosa y se metaboliza a dióxido de carbono, que luego regresa a los pulmones de los que es expulsado.
hemoglobina + O 2 oxihemoglobina
La presión parcial de O 2 en el aire es de 0.2 atm, suficiente para permitir que estas moléculas sean absorbidas por la hemoglobina (el pigmento rojo de la sangre) en la que se une flojamente en un complejo conocido como oxihemoglobina. En los extremos de los capilares que suministran la sangre a los tejidos, la concentración de O 2 se reduce en aproximadamente un 50% debido a su consumo por las células. Esto desplaza el equilibrio hacia la izquierda, liberando el oxígeno para que pueda difundirse hacia las células.
Mantenimiento del pH de la sangre
El dióxido de carbono reacciona con el agua para formar un ácido débil H 2 CO 3 que provocaría que el pH de la sangre cayera a niveles peligrosos si no se eliminara rápidamente ya que es excretado por las células. Esto se logra combinándolo con el ion carbonato a través de la reacción
\[H_2CO_3 + CO_3^{2–} \rightleftharpoons 2 HCO_3^– \nonumber\]
que se ve obligado a la derecha por la alta concentración local de CO 2 dentro de los tejidos. Una vez que los iones hidrogenocarbonato (bicarbonato) alcanzan los tejidos pulmonares donde la presión parcial de CO 2 es mucho menor, la reacción se invierte y el CO 2 es expulsado.
envenenamiento por monóxido de carbono
El monóxido de carbono, producto de combustión incompleta que está presente en los gases de escape automotrices y en el humo del cigarrillo, se une a la hemoglobina 200 veces más fuertemente que el O 2. Esto bloquea la absorción y el transporte de oxígeno estableciendo un equilibrio competitivo
O 2 -hemoglobina hemoglobina
 Cohemoglobina
Cohemoglobina
El aire que contiene tan poco como 0.1 por ciento de monóxido de carbono puede atar aproximadamente la mitad de los sitios de unión a la hemoglobina, reduciendo la cantidad de O 2 que llega a los tejidos a niveles fatales. La intoxicación por monóxido de carbono se trata mediante la administración de O 2 puro que promueve el desplazamiento del equilibrio anterior hacia la izquierda. Esto puede hacerse aún más efectivo colocando a la víctima en una cámara hiperbárica en la que la presión de O 2 puede hacerse mayor a 1 atm.


