13.4: Pares conjugados y tampones
- Page ID
- 70637
Asegúrese de comprender a fondo los siguientes conceptos esenciales:
- Indicar los valores de C a y C b después de que un ácido o base monoprótico débil haya sido parcialmente neutralizado con base o ácido fuerte.
- Definir la fracción de ionización, y calcular el porcentaje de ionización, de una solución C a M de un ácido monoprótico débil.
- Dibuje una gráfica aproximada que muestre la distribución de especies conjugadas en una solución de un ácido débil que tiene un valor dado de K a.
- Defina una solución de búfer y explique cómo funciona.
- Calcular el pH aproximado de una solución de un ácido monoprótico débil que tiene un pK a dado que ha sido parcialmente neutralizado mediante la adición de una base fuerte.
- Especificar cómo hacer un volumen dado de una solución tampón que tenga un cierto pH, comenzando con un ácido débil e hidróxido de sodio.
- Definir el índice de búfer y explicar su significación y las condiciones bajo las cuales se maximiza su valor.
- Dibuje una gráfica —log C vs pH (Sillén) para un sistema ácido/base monoprótico débil que tenga una concentración nominal dada y pK a, y utilícela para estimar el pH de la solución.
A menudo tendemos a considerar el pH como una cantidad que depende de otras variables como la concentración y fuerza de un ácido, base o sal. Pero en gran parte de la química (y especialmente en la bioquímica), encontramos más útil tratar el pH como la variable “maestra” que controla las concentraciones relativas de las formas ácido y base de uno o más conjuntos de sistemas ácido-base conjugados. En esta lección, exploraremos este enfoque con cierto detalle, mostrando su aplicación a los temas muy prácticos de las soluciones tampón, así como el uso de un enfoque gráfico simple que le permitirá estimar el pH de un ácido o base monoprótico o poliprótico débil ¡sin hacer ninguna aritmética en absoluto!
Cuando el pH toma el control
Si añadimos 0.2 mol de hidróxido de sodio a una solución que contiene 1.0 mol de un ácido débil HA, entonces un número equivalente de moles de ese ácido se convertirá en su forma base A —. La solución resultante contendrá 0.2 mol de A — y 0.8 mol de HA. Tenga en cuenta que debido a que aquí estamos discutiendo la estequiometría, nos interesan las cantidades (moles) de reactivos, no las concentraciones de los reactivos.
El punto importante a entender aquí es que terminaremos con una solución “parcialmente neutralizada” en la que tanto el ácido como su base conjugada están presentes en cantidades significativas. Las soluciones de este tipo son mucho más comunes que las de un ácido puro o una base pura, y es muy importante que las entiendas a fondo.
A una solución que contiene 0.010 moles de ácido acético (HAc), le agregamos 0.002 moles de hidróxido de sodio. Si el volumen de la solución final es de 100 ml, encuentre los valores de C a, C b y la concentración total del sistema C t.
Solución
El ion hidróxido agregado, al ser una base fuerte, reacciona completamente con el ácido acético, dejando 0.010 — 0.002 = 0.008 moles de HAc y 0.002 moles de ion acetato Ac —. Las concentraciones finales son
\[C_a = \dfrac{0.008 \;mol}{0.10\; L} = 0.08 \; M\]
\[C_b = \dfrac{0.002 \; mol}{ 0.10 \; L} = 0.02 M\]
\[Ct = \dfrac{0.010 \;mol}{0.10\; L} = 0.10\; M.\]
Obsérvese que esta solución sería indistinguible de una preparada combinando C a = 0.080 mol de ácido acético con C b = 0.020 mol de acetato de sodio y ajustando el volumen a 100 ml.
Así partiendo de una solución de un ácido débil puro o base débil en agua, podemos agregar suficiente base fuerte o ácido fuerte, respectivamente, para ajustar la relación de las especies conjugadas —es decir, las proporciones [HA]/[A —] en el caso de un ácido, o [B]/[BH +] para una base, a cualquier valor que queramos.
Fracciones de ionización
Para expresar las concentraciones relativas de las formas protonadas y desprotonadas de un sistema ácido-base presente en una solución, podríamos usar la relación simple [HA]/[A] (o su inversa), pero esto adolece del inconveniente de producir un resultado indeterminado cuando la concentración en el denominador es cero. Para muchos propósitos es más conveniente usar las fracciones de ionización
\[\alpha_0 = \dfrac{[HA]}{[HA]+A^-]} = \dfrac{[HA]}{C_a} \label{1-7a}\]
\[\alpha_1 = \dfrac{[A^-]}{[HA]+A^-]} = \dfrac{[A^-]}{C_a} \label{1-7b}\]
La fracción también\(\alpha_1\) se conoce como el grado de disociación del ácido. Haciendo las sustituciones apropiadas usando la relación
\[[H^+] = K_a \dfrac{[HA]}{[A^-]} \label{1-8}\]
podemos expresar las fracciones de ionización como funciones del pH:
\[\alpha_0 = \dfrac{[H^+]}{K_a+[H^+]} \label{1-9a}\]
\[\alpha_1 = \dfrac{K_a}{K_a+[H^+]} \label{1-9b}\]
Observe que los valores para ambas funciones son cercanos a cero o unidad excepto dentro del rango de pH pK a ± 1 (Figura\(\PageIndex{1}\)).
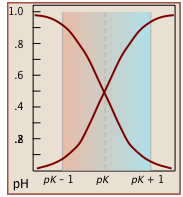
A continuación se muestran gráficas de\(\alpha\) las funciones vs. pH para varios sistemas. Observe los puntos de cruce donde [HA] = [A] cuando [H +] = K a que corresponde al valor unitario del cociente en la aproximación Henderson-Hasselbalch.
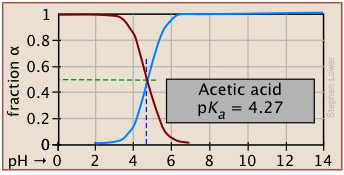

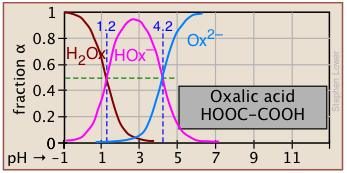
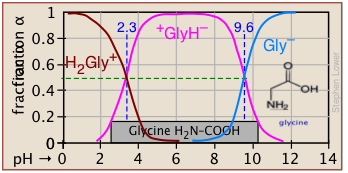
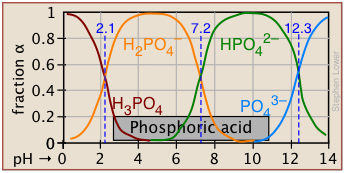
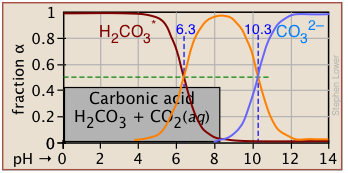
Las fracciones de ionización de una serie de ácidos en un amplio rango de pH se pueden resumir convenientemente como se muestra a continuación.
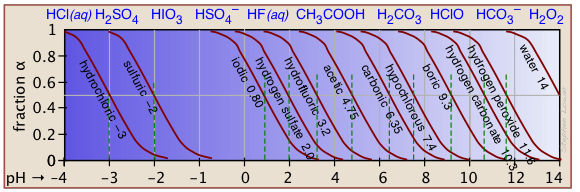
Si conoces el pK a de un ácido, puedes esbozar fácilmente su gráfica de fracción de ionización. Las partes superiores e inferiores extremas sólo pueden ser estimadas, pero el resto de las parcelas son esencialmente líneas rectas.
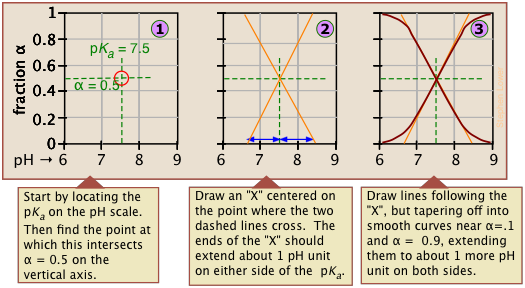
Tan valiosas como estas parcelas son para mostrar cómo la distribución de las especies conjugadas varía con el pH, presentan dos inconvenientes:
- Las parcelas\(\alpha\) cubren solo un solo orden de magnitud, pero las concentraciones reales, que a menudo nos interesan más, varían en un rango mucho mayor de pH 0 a 14.
- Son de poca ayuda si se desea estimar el pH de una solución del ácido o base, o de una de sus sales.
Ambas limitaciones son fácilmente superadas por el uso de parcelas logarítmicas de fácil construcción que describimos en la siguiente sección.
Soluciones Buffer
La palabra buffer tiene varios significados en inglés, la mayoría de ellos se refieren (en su forma verbal) a amortiguar, blindar, proteger o contrarrestar un efecto adverso. En química, se refiere específicamente a una solución que resiste un cambio en el pH cuando se agrega ácido o base. Una solución tampón (o tamponada) es aquella que resiste un cambio en su pH cuando se agregan o eliminan iones H + u OH — debido a que alguna otra reacción tiene lugar en la misma solución. Las soluciones tampón son componentes esenciales de todos los organismos vivos.
- Nuestra sangre está tamponada para mantener un pH de 7.4 que debe permanecer sin cambios a medida que se agrega CO 2 (ácido carbónico) generado metabólicamente y luego se elimina por nuestros pulmones.
- Los amortiguadores en los océanos, en aguas naturales como lagos y arroyos, y dentro de los suelos ayudan a mantener su estabilidad ambiental frente a la lluvia ácida y los aumentos en el CO 2 atmosférico.
- Muchos procesos industriales, como la elaboración de cerveza, requieren control de tampón, al igual que los estudios de investigación en bioquímica y fisiología que involucran enzimas, son activos solo dentro de ciertos rangos de pH.
El componente esencial de un sistema tampón es un par ácido-base conjugado cuya concentración es bastante alta en relación con las concentraciones de H + u OH añadidos — se espera que tamponen contra. Un sistema tampón simple podría ser una solución 0.2 M de acetato de sodio; el par conjugado aquí es ácido acético HAc y su base conjugada, el ion acetato Ac —. La idea es que este “pool” de pares conjugados estará disponible para engullir cualquier adición pequeña (≤ 10 —3 M) de H+ u OH —que pueda resultar de otros procesos que están sucediendo en la solución.

Esboce un diagrama similar que muestre lo que sucede cuando elimina H + u OH —.
- Contestar
-
Cuando esto suceda, la relación [HaC]/[Ac —], permanecerá sustancialmente sin cambios, al igual que el pH, como verá a continuación.
También se puede pensar en el proceso descrito anteriormente en términos del principio de Le Chatelier: la adición de H + a la solución suprime la disociación de HAc, contrarrestando parcialmente el efecto del ácido agregado, como lo ilustra la ecuación en la parte inferior izquierda del diagrama anterior.
La aproximación Henderson-Hasselbalch
Para desarrollarlo de manera más cuantitativa, consideraremos el caso general de un AH ácido débil al que se le ha agregado una cantidad Cb de base fuerte; piense, por ejemplo, en ácido acético que ha sido parcialmente neutralizado por hidróxido de sodio, produciendo el mismo par conjugado descrito anteriormente, aunque no necesariamente concentraciones idénticas. El balance de masas para tal sistema sería
\[[HA] + [A^–] = C_a + C_b = C_T \label {2-1}\]
en el que C t denota la concentración total de todas las especies en la solución. Debido a que agregamos una base de NaOH fuerte (completamente disociada) al ácido, también notamos que
\[C_b = [Na^+] \label{2-2}\]
Recordando la expresión de equilibrio para un ácido débil
\[K_a = \dfrac{[H^+][A^-]}{[HA]} \label{2-3}\]
Podemos resolver esto para [H +]:
\[[H^+] = K_a \dfrac{[HA]}{[A^-]} \label{2-4}\]
Reescribiendo esto en términos de logaritmos negativos, esto se convierte
\[-\log [H_3O^+] = -\log K_a - log [HA] + \log[A^-] \label{2-5}\]
o, ya que\(pK_a = –\log K_a\), invertimos la relación para preservar el signo positivo:
\[pH = pK_a + \log \dfrac{[A^-]}{[HA]} \label{2-6}\]
Esta ecuación se conoce como la Aproximación Henderson-Hasselbalch. Nos dice que el pH de una solución que contiene un sistema ácido-base débil controla las concentraciones relativas de las formas ácido y base de ese sistema.
¡Es interesante notar que la ecuación H-H no fue desarrollada por químicos!
- Lawrence Henderson (1878-1942) fue un médico estadounidense que enseñó en Harvard y que estudió la acidez de la sangre y su relación con la respiración. En 1908 resolvió la relación que se muestra en la Ecuación\(\ref{2-3}\).
- En 1916, K. Hasselbalch, fisiólogo de la U. de Copenhague, derivó la forma logarítmica en Ecuación\(\ref{2-6}\).
Quizás te preguntes por qué estas dos ecuaciones, cuya derivación ahora consideramos casi trivial, deberían haber inmortalizado los nombres de estos dos científicos. La respuesta es que la teoría del equilibrio químico todavía se estaba desarrollando a principios de 1900, y aún no se había abierto camino en los libros de texto de química. Incluso el concepto de pH era desconocido hasta que la obra de Sørenson apareció en 1909. Fue el misterio (y la necesidad médica) de entender por qué la falta de aliento hizo que la sangre fuera más alcalina, y la respiración demasiado rápida la hizo más ácida, lo que obligó al trabajo de H&H a la química moderna.
De especial interés es el caso en el que el pH de una solución de un sistema ácido-base se ajusta al valor de su pK a. De acuerdo con la ecuación anterior, cuando pH = pK a, el término logarítmico se convierte en cero, de manera que la relación [AB —]/[HA] = 10 0 = 1, lo que significa que [HA] = [AB —]. Es decir, cuando el pH de una solución se ajusta al valor del pK a de un par ácido-base, las concentraciones de las formas ácido y base serán idénticas. Esta condición se puede representar esquemáticamente en un diagrama de energía libre de protones:

Esto dice, en efecto, que cuando el pH de una solución que contiene tanto el ácido como la base conjugada se hace idéntico al ácido pK a, las formas HA y A — poseen energías libres idénticas, y por lo tanto estarán presentes en concentraciones iguales.
Nota
Cuando el pH de una solución se ajusta al valor del pK a de un par ácido-base, las concentraciones de las formas ácido y base serán idénticas.
Fabricación y uso de Buffer Solutions
Los tampones son generalmente más efectivos cuando el sistema tampón pKa no está demasiado lejos del pH objetivo. En estas condiciones, tanto [HA] como [A —] son lo suficientemente grandes como para compensar la retirada o adición, respectivamente, de iones de hidrógeno.
| ácido | fórmulas | pK a | Rango de pH |
|---|---|---|---|
| fosfórico | H 2 PO 4/HPO 4 — | 2.16 | 1-3 |
| carbónico | H 2 CO 3 */HCO 3 — | 3.75 | 3-5 |
| acético | HCOOH/HCOO — | 4.75 | 4-6 |
| fosfato de dihidrógeno | H 2 PO 4 —/HPO 4 2— | 7.21 | 6-8 |
| bórico | H 3 BO 3/H 2 BO 3 — | 9.24 | 8-10 |
| amonio | NH 4 +/NH 3 | 9.25 | 8-10 |
| bicarbonato | HCO 3 —/CO 3 2— | 10.3 | 9-11 |
| fosfato monohidrógeno | HPO 4 2—/PO 4 3— | 12.3 | 11-13 |
La ecuación\(\ref{2-4}\) anterior y su equivalente logarítmico en Ecuación\(\ref{2-6}\) son de uso limitado en los cálculos porque los valores exactos [A —] y [HA] se conocen solo para el caso especial cuando el pH de la solución es idéntico al pK a. La mayoría de las soluciones tampón se ajustarán a otros pH y, por supuesto, una vez que la solución tamponada comience a funcionar contrarrestando el efecto de las adiciones de H + u OH, tanto [A —] como [HA] habrán cambiado. Estas dos ecuaciones son tan ampliamente utilizadas en química práctica (y especialmente en bioquímica) que vale la pena comprometerse con la memoria.
\[[H^+] \approx K_a \dfrac{C_a}{C_b} \label{2-7}\]
\[pH \approx pK_a + \log \dfrac{C_b}{C_a} \label{2-8}\]
Si bien se trata de aproximaciones, suelen estar justificadas porque los sistemas tampón útiles siempre están significativamente más concentrados que los responsables de añadir o eliminar iones hidrógeno. Además, a estas concentraciones iónicas más altas, la K a del sistema tampón rara vez se conocerá con precisión de todos modos. No espere que los pH reales del tampón coincidan con los cálculos a mejor del 5%.
Comparar los efectos de agregar 1.0 mL de 2.5 M HCl a
- 100 mL de agua pura
- 100 mL de solución de dihidrogenofosfato de sodio 0.20 M.
Solución
a)
- cantidad de HCl añadida: (1.0 mL) × (2.5\ mm/mL) = 2.5 mmol = 0.0025 mol
- concentración de H + en solución: (.0025 mol) ÷ (.101 L) = .025 M
- pH = — log (.025) = 1.60, cambio en el pH = 1.60 — 7.00 = —5.4
b) (De la Tabla\(\PageIndex{1}\), el pK a de H 2 PO 4 — es 7.21)
- Inicial C a (H 2 PO 4 —) = C b (HPO 4 2—) = 0.20 M
- pH inicial de la solución tampón: pH = pK a + log (C b/C a) = 7.21 + 0 = 7.21
- El HCl agregado convertirá .0025 mol de HPO 4 2— a H 2 PO 4 —,
cambiando C a (.20 + .0025) mol ÷ (.101 L) = 2.00 M, y
reduciendo C b a (.20 — .0025) mol ÷ (.101 L) = 1.95 M - pH resultante = 7.21 + log (1.95/2.00) = 7.21 —.011 = 7.00
- Cambio en el pH = 7.00 — 7.21 = —.21
Tenga en cuenta que en ambos casos se reduce el pH (¡como debe ser si estamos agregando ácido!) , pero el cambio es mucho menor en la solución tamponada.
¿Cómo prepararías 200 mL de una solución tampón cuyo pH es 9.0?
Solución
El primer paso sería seleccionar un par ácido-base conjugado cuyo pK a esté cerca del pH deseado. Al observar la tabla anterior de valores de pK a, sería adecuado ya sea ácido bórico o ion amonio. Para este ejemplo, seleccionaremos el sistema NH 4 + /NH 3, K a = 5.5E—10, pK a = 9.25.
2) Utilizaremos la Ecuación\(\ref{2-7}\) para determinar la relación C a/C b requerida para establecer [H +] al valor deseado de 1.00 × 10 —9. Para ello, escribe la expresión constante de equilibrio completo para el ácido NH 4 +: NH 4 + → NH 3 + H +, y luego resolverlo para encontrar la relación de concentración requerida:
\ [K_a =\ dfrac {[NH_3] [H^+]} {[NH_4^+]} = 5.5\ veces 10^ {-10} \ nonumber\]
\ [\ dfrac {c_a} {c_b} =\ dfrac {[NH_3]} {[NH_4^+]} =\ dfrac {5.5\ veces 10^ {-10}} {[H^+]} =\ dfrac {5.5\ veces 10^ {-10}} {1.00\ veces 10^ {-9}} =\ dfrac {5.5 veces\ 10^ {-10}} {10.00\ times 10^ {-10}} = 0.55 \ nonumber\]
3) La forma más fácil (si no particularmente elegante) de resolverlo es asumiendo inicialmente que disolveremos 1.00 mol de NH 4 Cl sólido en agua, agregaremos suficiente OH, para neutralizar parcialmente parte de este ácido de acuerdo con la ecuación de reacción NH 4 + + OH — → NH 3 + H 2 O, y luego agregar agua suficiente para hacer el volumen 1.00 L.
masa de cloruro de amonio:
(1 mol) × (53.5 g M ol) = 53.8 g
let x = moles de NH 4 + que deben convertirse en NH 3.
Entonces C a/C b = (1- x)/x = .55; resolviendo esto da x = .64, 1—x = .36.
4) Entonces para hacer 1 L del tampón, disolver .36 × 53.8 g = 19.3 g de NH sólido 4 Cl en una pequeña cantidad de agua. Añadir .64 moles de NaOH (lo más fácil de hacer a partir de una solución madre), y luego suficiente agua para hacer 1.00 L.
5) Para hacer 200 mL del tampón, simplemente multiplique cada una de las cifras anteriores por 0.200.
Errores de la aproximación Henderson-Hasselbalch
La Aproximación Henderson-Hasselbalch es ampliamente utilizada en cálculos prácticos. Lo que la mayoría de los libros no te dicen es que Eqution no\(\ref{2-4}\) es más que una “aproximación de una aproximación” que puede dar resultados incorrectos y engañosos cuando se aplica a situaciones en las que los supuestos simplificadores no son válidos. Un tratamiento exacto de los pares ácido-base conjugados, incluyendo una correcta derivación de la ecuación de Henderson-Hasselbalch, se da en el capítulo de Cálculos Exactos.
La Aproximación Henderson-Hasselbalch solo es válida para concentraciones bastante altas
Las aproximaciones que conducen a la ecuación H-H limitan su uso confiable a valores de C a y C b que están dentro de un orden de magnitud entre sí, y son bastante altos. Además, el pK a del ácido debe ser moderado.
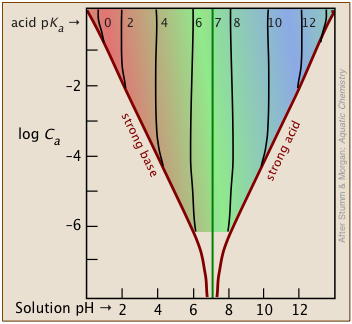
La porción sombreada de este conjunto de parcelas indica los valores de C a y K a que arrojan resultados útiles. Claramente, cuanto menor es la concentración de tampón, más estrecho es el rango de ácido pK a s. La mayoría de las soluciones tampón tienden a estar bastante concentradas, con C a y C b típicamente alrededor de 0.01 - 0.1 M. Así, un tampón basado en una solución .01 M de un ácido como el clórico (HClO 3) con pK a de 1.9 caerá justo fuera del límite “seguro” cerca de la parte superior izquierda del diagrama.
\[\underbrace{[H^+] = K_a \dfrac{[HA]}{[A^-]}}_{\text{exact}} \label{2-9a}\]
\(\ref{2-9a}\)La ecuación es simplemente una reescritura de la expresión constante de equilibrio, y por lo tanto siempre es cierta. Por supuesto, sin conocer los valores reales de equilibrio de [HA] y [A —], esta relación es de poco uso directo en los cálculos de pH.
\[\underbrace{[H^+] \approx K_a \dfrac{C_a}{C_b}}_{\text{approximate}} \label{2-9b}\]
\(\ref{2-9b}\)La ecuación nunca es cierta, pero dará buenos resultados si el ácido es suficientemente débil en relación a su concentración para evitar que el [H +] sea demasiado alto. De lo contrario, el alto [H +] convertirá una fracción significativa de la A — en la forma ácida HA, de manera que la relación [HA]/[A —] diferirá de C a/C b en las dos ecuaciones anteriores. El consumo de H + por la base también elevará el pH por encima del valor predicho como vimos en el ejemplo anterior del problema.
Índice de búfer
Los términos intensidad del tampón y capacidad tampón se emplean comúnmente como sinónimos para el índice de tampón, pero en algunos contextos, la capacidad del tampón denota la cantidad de ácido fuerte o base fuerte que altera el pH del tampón en 1 unidad. (véase más adelante). ¿Qué tan efectivo es un sistema tampón dado para resistir los cambios en el pH? La expresión más directa de esto es la velocidad de cambio del pH a medida que se agregan pequeñas cantidades de ácido o base fuerte al sistema: Δ C /Δ (pH). Expresado en notación de cálculo, este es el índice de búfer, definido como
\[\beta = \left| \dfrac{dC}{d(pH)} \right| \label{2-19}\]
C aquí se refiere a la concentración de ácido fuerte o base añadida a la solución. Debido a que el ácido o base agregado afecta el pH de manera opuesta, tomamos el valor absoluto de esta función para asegurar que β sea siempre positivo. El valor de β puede calcularse analíticamente a partir de C a, C b, K a, K b y [H +]. Al tomar la segunda derivada de β, se puede demostrar que el índice de tampón tiene un valor máximo cuando el pH = pK a.
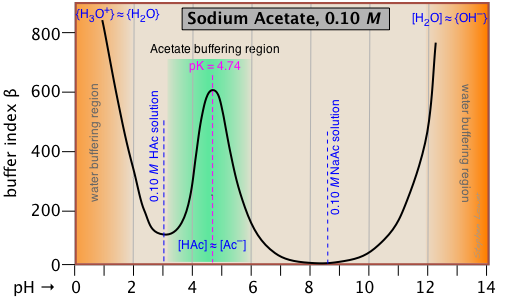
Esta gráfica de índice de tampón para una solución 0.10 M de acetato de sodio es típica, y confirma que el tamponamiento es más eficiente dentro de aproximadamente ±1 unidad de pH de pK a. Pero, ¿qué pasa con el amortiguamiento aún mayor que aparentemente ocurre en los dos extremos del pH (sombreado naranja)? Esto se debe al amortiguamiento asociado con el agua misma, y se verá en todas las soluciones tampón acuosas.
El agua pura es tamponada por el par conjugado H 3 O + /H 2 O a pH muy bajo, y por H 2 O/OH- a pH alto. Esto se entiende fácilmente si piensa en agregar un poco de ácido ácido fuerte al agua pura; incluso una gota de HCl hará que el pH baje hacia 0. Si continúa agregando ácido, el pH no bajará significativamente por debajo de 0, porque no quedarán suficientes moléculas de agua libre para hidratar el HCl y producir iones H 3 O +, por lo que la solución está fuertemente tamponada.
Tenga en cuenta que si restáramos el efecto del tamponamiento de NaAc de la parcela anterior, la parcela restante para el agua misma exhibiría un mínimo a pH 7, donde tanto [H 3 O +] como [OH —] comparten un valor mínimo común.
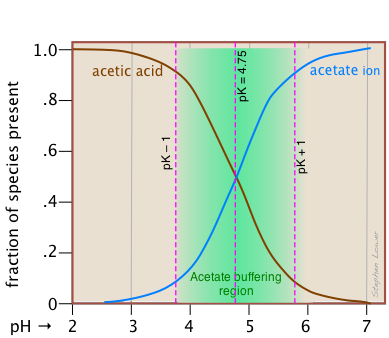
Esta vista alternativa muestra cómo las fracciones de distribución de HAc y Ac — se relacionan con el rango de tamponamiento efectivo de este par conjugado, el cual se define convencionalmente como ±1 unidad de pH del pK a. El término capacidad tampón es un medio alternativo de expresar la capacidad de un sistema tampón para absorber la adición de ácido o base fuerte sin provocar que el pH se desvíe en más de una unidad del tampón puro.
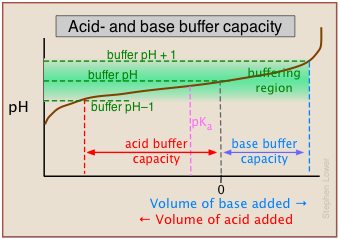
En este ejemplo, las capacidades de tampón para la adición de ácido y base diferirán porque el pH del tampón se ha ajustado a un valor que difiere de su pK a.
La importancia de la concentración de tampón
Los sistemas tampón deben estar apreciablemente más concentrados que las concentraciones de ácido o base fuertes que se requieren para absorber mientras permanecen dentro del rango de pH deseado. Una vez que el ácido o base agregado haya consumido la mayor parte de una u otra de las especies conjugadas que comprenden el tampón, el pH ya no se estabilizará. Y por supuesto, concentraciones de tampón muy pequeñas se acercarán al pH del agua pura.
Una visión más completa: Gráfica Log-C vs pH
A estas parcelas se les suele denominar parcelas de Sillén. Lars Gunnar Sillén (1916-1970) fue un químico sueco que estudió la distribución de especies iónicas en soluciones acuosas y especialmente en los océanos. Debido a que las concentraciones de especies conjugadas pueden variar en muchos órdenes de magnitud, es mucho más útil expresarlas en una escala logarítmica. Dado que el pH ya es logarítmico, se puede obtener una “vista de pájaro” de un sistema ácido-base en una gráfica compacta logarítmica.
Aún mejor, estas parcelas se construyen fácilmente sin ningún cálculo o aritmética —o incluso ningún papel cuadriculado— cualquier papel de desecho, incluso la parte posterior de un sobre, será suficiente. Una regla u otra regla, sin embargo, dará resultados más precisos. Además, puedes usar estas gráficas para estimar el pH de una solución de un ácido o base monoprótico o poliprótico sin contender con ecuaciones cuadráticas o de orden superior, ¡ni hacer ninguna aritmética en absoluto! Los resultados no serán tan precisos como se obtendría de una solución numérica adecuada, pero dadas las incertidumbres de cómo las constantes de equilibrio se ven afectadas por la presencia de otros iones en la solución, esto rara vez es un problema.
Aparte de estas ventajas, el uso de gráficas log-c vs pH le permitirá conocer la química de los sistemas ácido-base que no se pueden obtener simplemente haciendo cálculos numéricos. La forma básica de la parcela, y el punto de partida para cualquier uso de tales parcelas, se ve así:
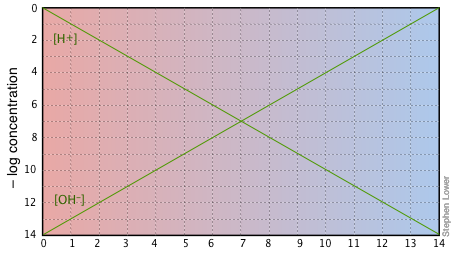
Si examina cuidadosamente esta parcela, verá que no es más que una definición de pH y PoH, así como una definición de una solución neutra a pH 7. Observe, por ejemplo, que cuando el pH es 4.0, [H +] = 10 —4 M y [OH —] = 10 —10 M.
Un ejemplo sencillo: solución de ácido acético
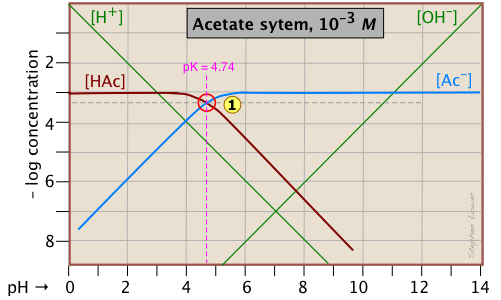
Aquí hay una parcela de log C para una solución de 10 —3 M de ácido acético (“HaC”) en agua. A pesar de que puede parecer un poco complicado al principio, es realmente muy sencillo. La línea marrón pesada de la izquierda traza la concentración del HAc ácido en función del pH. La línea azul de la derecha muestra cómo la concentración de la base Ac — depende del pH. Las partes horizontales de estas líneas se alinean con “3" en el eje —log- C, correspondiente a la concentración nominal de 10 —3 M (C a).
¿Cómo conocemos las formas y ubicación de las parcelas para las concentraciones de ácido acético [HAc] y el ion acetato [Ac —]? Aunque ambas concentraciones, por supuesto, variarán con el pH, sus desviaciones de 10 —3 M son demasiado pequeñas para revelarse en una gráfica logarítmica hasta que el pH se aproxime al pK a.
- A pH muy bajo, prácticamente todo el sistema de acetato estará en su forma ácida (es decir, [HAc] = 10 —3), y de manera similar, a pH alto, la forma base [Ac —] = 10 —3 M.
- Cuando pH = pK a, las concentraciones de las especies conjugadas son idénticas, como lo indica el cruce de las líneas que representan las dos concentraciones. Estas concentraciones serán la mitad de la concentración total dada por C a, por lo que [HAc] = [Ac —] = ½ C a = 0.5E—3 M. ¿A dónde va esto en el eje log-C? Bueno, el logaritmo de 0.5 es —0.3 (¡un dato útil para recordar!) , por lo que el punto de cruce en
se desplaza 0.3 de una unidad log-C por debajo del nivel —3 en el eje y.
- Debido a que el punto
define tanto el pK a como la concentración de un sistema ácido-base particular, se le conoce como el punto del sistema.
- ¿Qué pasa con las laderas de las parcelas cuando se inclinan? Resulta que estas pendientes son +1 para
[Ac —] y —1 para [HaC]. Dado que las pendientes de las líneas para [H +] y [OH —] son ±1, podemos utilizarlas como pautas; solo hacer que las parcelas de [Ac —] y [HA] sean paralelas a ellas. - Las porciones curvas de la trama que une las partes horizontales y diagonales a ambos lados del punto del sistema se pueden dibujar a mano alzada sin errores indebidos; ¡las gráficas logarítmicas son muy indulgentes!
Estimando el pH
De especial interés en la química ácido-base son los valores de pH de una solución de un ácido y de su base conjugada en agua pura; como saben, estos corresponden a los puntos de inicio y equivalencia en la titulación de un ácido con una base fuerte. Continuando con el ejemplo del sistema de ácido acético, mostramos a continuación otra trama que es igual que la anterior, pero con algunas líneas y números más agregados.
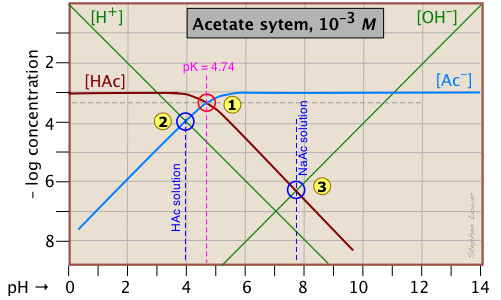
pH del ácido acético en agua pura. Supongamos que le gustaría encontrar el pH de una solución 0.001 M de ácido acético en agua pura. De la ecuación
\[HAc + H_2O \rightleftharpoons H_3O^+ + Ac^– \label{Acetate 2-1} \]
we know that equal numbers of moles of hydronium and acetate ions will be formed, so the concentrations of these species should be about the same:
\[[H^+] \approx [Ac^–] \label{Acetate 2-2}\]
will hold. The equivalence of these two concentrations corresponds to the point labeled on the logC-pH plot; this occurs at a pH of about 4, and this is the pH of a 0.001 M solution of acetic acid in pure water.
pH of sodium acetate in pure water. A 0.001 M solution of NaAc in water corresponds to the composition of a solution of acetic acid that has been titrated to its equivalence point with sodium hydroxide. The acetate ion, being the conjugate base of a weak acid, will undergo hydrolysis according to
\[Ac^– + H_2O \rightleftharpoons HAc + OH^– \label{Acetate 2-3}\]
which establishes the approximate relation
\[[HAc] \approx [OH^–] \label{Acetate 2-4}\]
This condition occurs where the right sloping part of the line representing [HAc] intersects the [OH–] line at in the plot above. As you would expect for a solution of the conjugate base of a weak acid, this corresponds to an alkaline solution, in this case, at about pH = 7.8.
You will have to admit that estimating a pH in this way is far more painless than an ordinary numerical calculation would be!
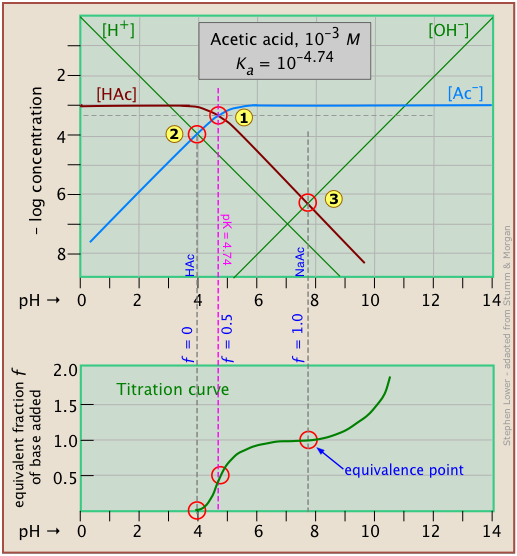
It is interesting to show the Sillén plot for a weak acid system with its titration curve, both on the same pH scale. In this example, the titration plot has been turned on its side and reversed in order to illustrate the correspondence of its ƒ=0 (initial), ƒ=0.5 and ƒ=1 (equivalence) points with the corresponding points on the upper plot.
Ammonia - a weak base
Ammonia, unlike most gases, is extremely soluble in water. Solutions of NH3 in water are properly known as aqueous ammonia, NH3(aq); the name "ammonium hydroxide" is still often used, even though there is no evidence to suggest that a species NH4OH exists. Ammonia is the conjugate base of the ammonium ion NH4+. The fact that ammonia is a base has no special significance insofar as the construction and interpretation of the log-C vs pH diagram is concerned; such diagrams always refer to conjugate acid-base systems, rather than to individual acids and bases.

Thus the system point defines the NH4+/NH3 pair (pKa 9.3) at 25°C and a total concentration
\[C_T = C_a + C_b = 0.0010\; M. \label{NH3 2-5}\]
To estimate the pH of a solution of ammonia in pure water, we make use of the charge balance requirement (known as the proton condition)
\[[NH_4^+] + [H^+] = [OH^-] \label{NH3 2-5.5}\]
which we simplify by assuming that, because NH4+ is a weak acid, [NH4+] >> [H+] and we can drop the [H+] term; thus the approximation
\[[NH_4^+] \approx [OH^-] \label{NH3 2-6}\]
which corresponds to the crossing point and a pH of 10.0. Similarly, at the crossing point
, [NH3] ≈ [H+]. This comes from the proton condition
\[[NH_3] + [H^+] – [OH^–] = 0 \label{NH3 2-7}\]
by dropping the [OH–] term on the assumption that its value is negligible compared to [H+].
Equation \(\ref{NH3 2-7}\) is referred to as the "proton condition". Sorry to sneak it in without warning, but we hope that having piqued your curiosity, you might take the time to look at the following discussion of this important tool for estimating the pH of a solution of a pure acid, base, or a salt.
Mass- and charge balance, and the proton condition
In any aqueous solution of an acid or base, certain conservation conditions are strictly observed. Together with concentration and the Ka or Kb , these put certain constraints on the system that determine the state of the system. The most fundamental of these are conservation of mass and of electric charge, which of course apply to chemical changes of all kinds. We commonly express these as mass balance and charge balance, respectively. (The latter of these is sometimes referred to as the electroneutrality condition.)
Using the above example of the ammonium system as an illustration of this, we are interested in two particular instances of practical importance: what conditions apply to solutions made by dissolving a) pure ammonia, or b) ammonium chloride, in water?
Sillén diagram
Charge balances
- CT, NH3 = [NH3] + [NH4+] = 10–2 M
- CT, Ac = [HAc] + [Ac–] = 10–2 M
- NH3: [H+] + [NH4+] = [OH–]
- NaAc: [Na+] + [H+] = [Ac–] + [OH–]
OK so far? That's really all we need, but it's usually more convenient to combine these with mass balances on the protons alone, so that we have a single equation for each of the two solutions. The resulting equations are known as the proton conditions for the two solutions.
To avoid a lot of algebra, there is a simple short-cut for writing a proton condition equation:
- Identify the substance you are starting with — the pure acid, base, or salt, and also H2O itself, that make up the solution whose pH you wish to know at the concentration for which the log C-pH chart is drawn. we call this the proton reference level (if that appellation scares you, it is sometimes referred to as the "basis substance".)
- On the left side of the proton condition, write concentration expressions for all species that possess protons in excess of the reference level.
- On the right side, write concentrations of all species that possess fewer protons the reference level.
Let's try it for our ammonia system.
Solution of NH3 in water:
The proton reference level (PRL) is defined by NH3(aq) and H2O.
Proton condition: [H3O+] + [NH4+] = [OH–]
(Notice that the substances that define the PRL (in case, H2O and NH3) never appear in the proton condition equation.)
Solution of NH4Cl (or of any other strong-anion ammonium salt) in water:
The PRL is defined by NH4+ and H2O.
Proton condition: [H3O+] = [NH3] + [OH–]
(The chloride ion has nothing to do with protons, so it does not appear here.)
This proton condition stuff seems awfully complicated: why do we bother?
Good question: the answer is that what seems complicated at first sometimes turns out to be simpler and easier to understand than any alternative. Think of it this way: acid-base reactions involve the transfer of protons: some protons jump up to higher proton-free energy levels (e.g., NH3 + H2O → NH4+ + OH–), others drop down to proton-vacant levels (H3O+ → NH3 → H2O + NH4+). But no matter what happens, the total number of "available" protons (that is, all "dissociable" protons, including those in H3O+) must be conserved — thus the "mass balance on protons". So let's look again at the log C - pH plot for the ammonium system, which we reproduce here for your convenience:

Consider first the solution of ammonium chloride, whose proton condition is given by [H3O+] = [NH3] + [OH–]. We know that NH4Cl, being the salt of a weak base and a strong acid, will give a solution that is slightly acidic. In such a solution, [OH–] will be quite small so that we can neglect it without too much error. We can then write the proton condition as [H+] ≈ [NH3]. On the plot above, this corresponds to point where the lines representing these quantities cross. At this pH of around 6.2, [OH–] is about two orders of magnitude smaller than [NH3], so we are justified in dropping it.
Similarly, for a solution of ammonia in water, the proton condition [H3O+] + [NH4+] = [OH–] that we worked out above can be simplified to [NH4+] ≈ [OH–] (point ) with hardly any error at all, since [H+] is here about six orders of magnitude smaller than [NH4+].
In our discussion of the plot for the acetic acid system, we arrived at the proton conditions [H+] ≈ [Ac–] (for HAc in water) and [H+] ≈ [OH–] (for NaAc) by simply using the stoichiometries of the reactions. This can work in the simplest systems, but not in the more complicated ones involving polyprotic systems. In general, it is far safer to write out the complete proton condition in order to judge what concentrations, if any, can be dropped.
Ammonium acetate solution: solution of a salt
Having looked at the Sillén diagrams for acetic acid and ammonia, let's examine the log C-pH plot for this salt of acetic acid and ammonia.
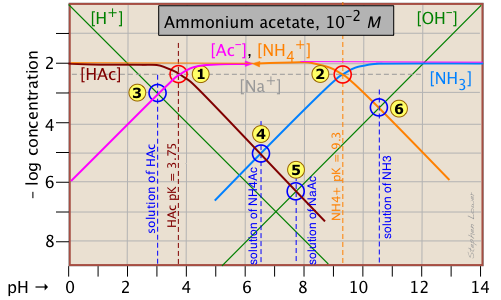
You will recall that we dealt with solutions of the salts sodium acetate and ammonium chloride in the two examples described above. What is different here is that both components of the salt CH3COONH4 ("NH4Ac") are "weak" in the sense that their conjugate species NH3 and HAc are also present in significant quantities. This means that we are really dealing with two acid-base systems — the ones shown previously — on the same plot.
Each system retains its own system point, ![]() for the acetate system and
for the acetate system and para el sistema de amonio. Obsérvese que las dos parcelas previamente mostradas fueron para soluciones de 10 —3 M, por lo que los puntos no pertenecientes al sistema para esta solución más concentrada ocurren a diferentes valores de pH. Los pH de las soluciones 10 —2 M de HAc
, NaAc
y NH 3
![]() se localizan usando las mismas condiciones de protones que antes.
se localizan usando las mismas condiciones de protones que antes.
Lo único nuevo aquí es el punto, que corresponde a la solución de acetato de amonio en la que nos interesa. La condición protónica para esta solución es [H +] + [HAc] = [NH 3 (aq)] + [OH —]. La inspección de la parcela revela que [H +] << [HaC] y [OH —] << [NH 3 (aq)], por lo que la condición del protón puede simplificarse a [HaC] ≈ [NH 3 (aq)], correspondiente a la intersección de estas dos líneas en
.
Sistemas polipróticos
Ahora que puede encontrar su camino alrededor de las parcelas logarítmicas de c-pH que abarcan dos sistemas ácido-base, los sistemas polipróticos que describimos a continuación no deberían ser ningún problema en absoluto.
El Sistema Carbonato
Un conocimiento profundo del sistema de ácido carbónico-carbonato es esencial para comprender la química de las aguas naturales y la bioquímica de la respiración en humanos y otros animales. Hay dos cosas especiales sobre este sistema que debes saber:
- Una solución de dióxido de carbono en agua se encuentra principalmente en forma de CO 2 hidratado, CO 2 (aq). Pero una pequeña fracción de CO 2 disuelto reacciona con el agua para formar ácido carbónico, H 2 CO 3. Debido a que este ácido no puede aislarse, la práctica común es agregar un asterisco a la fórmula para designar la concentración “total” de CO 2
[CO 2 + H 2 CO 3]: así H 2 CO 3 *. - Debido a que el CO 2 es un gas, las soluciones que contienen especies de carbonato de todo tipo pueden equilibrarse con la atmósfera, que normalmente contiene pequeñas cantidades de CO 2. Esto significa que una solución de bicarbonato de sodio que esté abierta a la atmósfera puede perder CO 2 a la atmósfera a pH bajo, y absorberlo a pH alto. Se dice que un sistema de este tipo es abierto. Alternativamente, se puede cerrar un sistema para intercambiar con la atmósfera. Las parcelas de Sillén para sistemas de carbonato abiertos y cerrados tienen apariencias muy diferentes.
Esta parcela de Sillén para el sistema cerrado H 2 CO 3 * es típica de otros sistemas de ácido diprótico ya que hay tres especies conjugadas y dos puntos del sistema. La concentración de 10 —3 M trazada aquí es típica de lo que se encuentra en las aguas subterráneas que están en contacto con sedimentos que contienen carbonato.
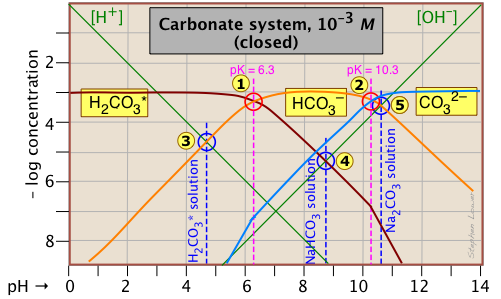
El pH de una solución 10 —3 M de CO 2, NaHCO 3 y Na 2 CO 3 se indica por las anotaciones azules.
| soluto, (nivel de referencia) | condición de protones | aproximación |
|---|---|---|
| dióxido de carbono (H 2 CO 3 *) | [H +] = [HCO 3 —] + 2 [CO 3 2—] + [OH —] | [H +] ≈ [HCO 3 —] |
| bicarbonato de sodio (NaHCO 3) | [H +] + [H 2 CO 3] = [CO 3 2—] + [OH —] | [H 2 CO 3] ≈ [OH —] |
| carbonato de sodio (Na 2 CO 3) | [H +] + 2 [H 2 CO 3 *] + [HCO 3 —] = [OH —] | [HCO 3 —] ≈ [OH —] |
Deberías tomarte unos minutos para verificar las aproximaciones en la columna más a la derecha. Observe los factores de 2 que multiplican algunas de las concentraciones. Por ejemplo, el término “2 [CO 3 2—]” en la primera línea de la tabla significa que la especie CO 3 2— está a dos pasos del nivel de referencia de protones H 2 CO 3 *, por lo que se necesitarían dos iones hidrógeno para equilibrar un solo ion carbonato.
Otra nueva característica introducida aquí es la duplicación de las pendientes de las líneas que representan [H 2 CO 3 *] y [CO 3 2—] donde cruzan los valores de pH correspondientes a los K a s que se eliminan un paso de sus propios puntos del sistema y
cerca de —log C = 7.
El sistema de fosfato
Este sistema triprótico es ampliamente utilizado para preparar soluciones tampón en aplicaciones bioquímicas. En su forma fundamental, aquí no hay nada nuevo, salvo un punto adicional del sistema correspondiente al pK a de H 2 PO 4 —.
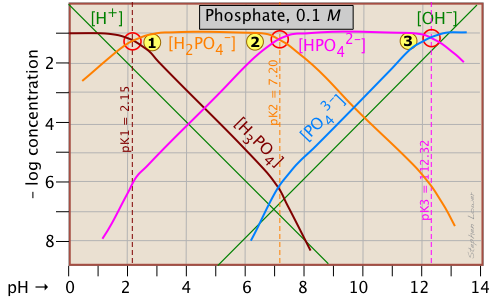
El pH de una solución 10 —3 M de H 3 PO 4, NaH 2 PO 4, Na 2 HPO 4 y Na 3 PO 4 se puede estimar estableciendo las condiciones de protones de la siguiente manera. Desafortunadamente, estas estimaciones se vuelven un poco más complicadas debido a la proximidad de los tres puntos del sistema. ¡Pero es mucho más fácil que hacer una solución numérica que requiere resolver un polinomio de primer grado!
| soluto, (nivel de referencia) | condición de protones | aproximación |
|---|---|---|
| ácido fosfórico (H 3 PO 4) | [H +] = [H 2 PO 4 —] + 2 [HPO 4 2—] + 3 [PO 4 3—] + [OH —] | [H +] ≈ [H 2 PO 4 —] |
| dihidrogenofosfato de sodio (NaH 2 PO 4) | [H +] + [H 3 PO 4] = [HPO 4 2—] + 2 [PO 4 3—] + [OH —] |
[H +] + [H 3 PO 4] ≈ [HPO 4 2—] |
|
hidrogenofosfato disódico (Na 2 HPO 4) |
[H +] + 2 [H 2 PO 4 —] + [H 2 PO 4 —] = 3 [PO 4 3—] + [OH —] | [H 3 PO 4 -] = [PO 4 3—] + [OH —] |
| fosfato trisódico (Na 3 PO 4) | [H +] + 3 [H 3 PO 4] +2 [H 2 PO 4 —] + [HPO 4 2—] = [OH —] | [HPO 4 2—] ≈ [OH —] |
Debido a que la parcela de fosfato está bastante abarrotada, se muestra aquí una modificada en la que se enfatizan los detalles de las estimaciones de pH para las soluciones de H 3 PO 4 y sus sales.
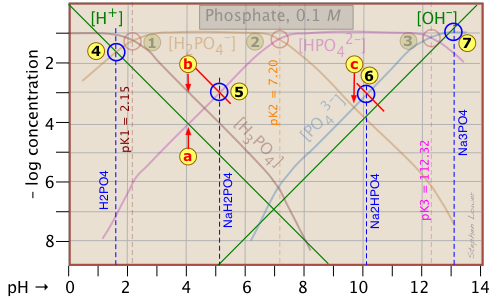
La estimación del pH de 10 —3 M soluciones de ácido fosfórico y fosfato trisódico
![]() , con base en las aproximaciones de la tabla anterior son sencillas.
, con base en las aproximaciones de la tabla anterior son sencillas.
Los de NaH 2 PO 4 y Na 2 HPO 4
![]() , sin embargo, se complican por la presencia de dos términos de concentración en el lado derecho de las respectivas aproximaciones de condición protónica.
, sin embargo, se complican por la presencia de dos términos de concentración en el lado derecho de las respectivas aproximaciones de condición protónica.
A menos que esté en un curso avanzado, es posible que desee omitir los siguientes detalles. Lo importante a saber es que las estimaciones gráficas de estos sistemas más problemáticos son fundamentalmente posibles.
Así, para el dihidrogenofosfato de sodio, si tuviéramos que seguir el patrón de los otros sistemas, la aproximación en el punto de cruce sería
[H +] = [HPO 4 2—], correspondiente al punto![]() . Pero la inspección de la parcela muestra que a ese pH (4.0), la concentración de H 3 PO 4 es diez veces mayor que la de H + (punto
. Pero la inspección de la parcela muestra que a ese pH (4.0), la concentración de H 3 PO 4 es diez veces mayor que la de H + (punto![]() ). Se puede hacer una estimación aproximada del pH mediante la construcción de una línea (mostrada en rojo) que es paralela a las de H 3 PO 4 y H +, pero que se eleva en un factor de 10. Esto da como resultado el nuevo punto de cruce
). Se puede hacer una estimación aproximada del pH mediante la construcción de una línea (mostrada en rojo) que es paralela a las de H 3 PO 4 y H +, pero que se eleva en un factor de 10. Esto da como resultado el nuevo punto de cruce.
De igual manera, el pH de una solución de hidrogenofosfato disódico no corresponde al punto de cruce![]() debido al valor significativo de [HPO 4 3—] a este pH. Nuevamente, construimos una línea por encima de este punto de cruce que predice un pH correspondiente al punto
debido al valor significativo de [HPO 4 3—] a este pH. Nuevamente, construimos una línea por encima de este punto de cruce que predice un pH correspondiente al punto![]() .
.
Si bien estas estratagemas pueden parecer bastante crudas, cabe señalar que las incertidumbres asociadas a ellas tienden a minimizarse en una parcela logarítmica. Además, hay que tener en cuenta que en una solución tan concentrada como 0.1M, no son aplicables los valores de pK a que se encuentran en las tablas. La alternativa de resolver el pH algebraicamente, tomando en consideración los coeficientes de actividad para las altas concentraciones iónicas, rara vez vale la pena el esfuerzo.
Cómo dibujar diagramas de Sillén
La relación entre el pH de una solución y las concentraciones de ácidos débiles y sus especies conjugadas es algebraicamente bastante complicada. Pero sobre la mayor parte del rango de pH, se pueden hacer suposiciones simplificadoras que, cuando se expresan en forma logarítmica, se trazan como líneas rectas que tienen pendientes integrales de 0, ±1, ±2, etc. Es solo dentro del estrecho rango de pH cerca del pK a que estos supuestos simplificadores se descomponen, pero en un gráfica logarítmica, se puede dibujar una curva suave que cubra este rango sin introducir un error significativo.
|
Aquí está su papelería básica: una gráfica que muestra los dos iones siempre presentes en cualquier solución acuosa. En la práctica, por lo general se puede cortar la parte inferior donde las concentraciones son menores que\(10^{–10}\, M\). |
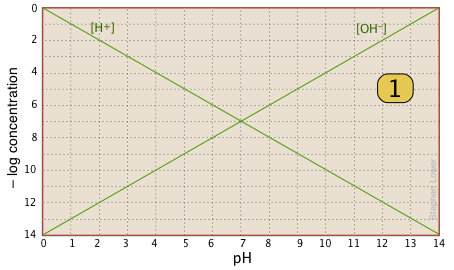 |
|
Para cualquier sistema ácido-base dado, es necesario conocer el pK a y la concentración nominal CT. Encuentra el punto en el que se cruzan estas dos líneas. |
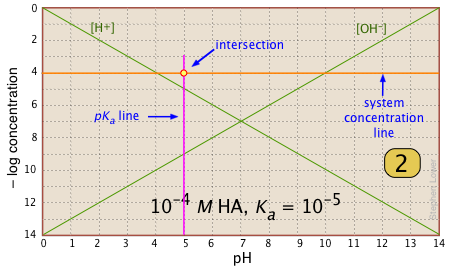 |
|
Localice y marque el punto del sistema en la línea pK a. Será 0.3 de una unidad log-C por debajo de la línea de concentración. Aquí es donde [HA] |
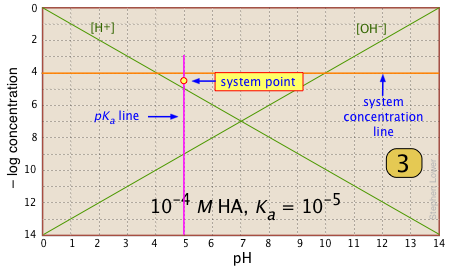 |
|
Para pH < pK a, [HA] se traza como una línea a través del punto del sistema con pendiente = 0. Para pH > pK a, la línea asume una pendiente de —1. Utilice las líneas [H +] y |
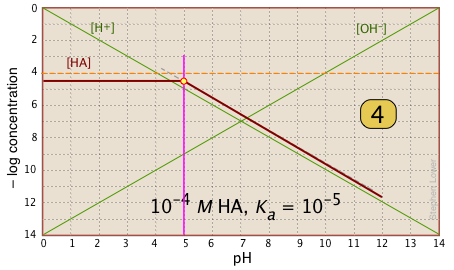 |
| En el intervalo de pH de ± pK a, la pendiente cambia de 0 a +1. Se puede aproximar esto con una línea inclinada como se muestra, o “prettify” con una curva suave. | 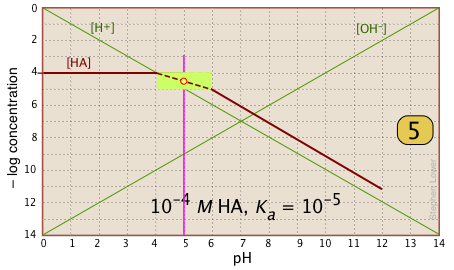 |
| Por último, dibuja las líneas para la forma conjugada [A —], usando pendientes +1 y 0. | 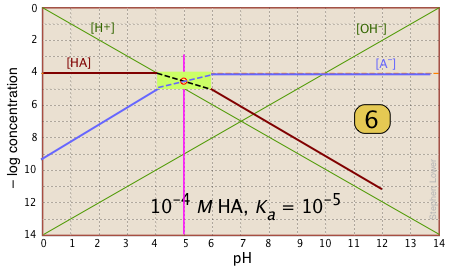 |
¿Para qué sirve todo esto?
Supongamos que tiene una solución de NaA cuyo pH es 8. Estimar la concentración del ácido HA en la solución. Todo lo que necesitas hacer es mirar la parcela. La línea [HA] cruza la línea que marca este pH en — log C = 6, o [HA] = 10 —6. Esta cantidad demasiado pequeña para reducir significativamente [A —], que permanece en aproximadamente CT = 10 —6 M.
Referencias
- Contornos sin límites en soluciones tampón. Estos resumen los principales puntos y ejemplos de problemas tal como se presentan en los principales libros de texto. Son una excelente ayuda para la revisión previa al examen. Química: La ciencia central (8 subtemas)
- Una colección de ejercicios de práctica (con soluciones) sobre tampones y titulaciones de Bryn Mawr College.
- La ecuación de Henderson-Hasselbalch: su historia y limitaciones - Henry N. Po y N.M. Senoza, J.Chem. Ed. 78 (11) 2001 (1499-1503)
- Un tratamiento detallado de los diagramas log-C vs pH se puede encontrar en el libro Diagramas ácido-base de Kahlert y Schotz. Está disponible en línea en algunas bibliotecas universitarias.


