13.3: Encontrar el pH de ácidos, bases y sales débiles
- Page ID
- 70638
Asegúrese de comprender a fondo los siguientes conceptos esenciales que se han presentado anteriormente.
- Explicar la diferencia entre los términos C a y [HA] ya que se refieren a una solución acuosa del ácido HA.
- Definir el grado de disociación y esbozar una gráfica que muestre cómo los valores de\(alpha\) para un par conjugado HA y A — se relacionan entre sí y con el pK a.
- Derivar la relación entre la concentración de ácido y la constante de disociación a la concentración de iones hidrógeno en una solución de un ácido débil.
- Vuelva a escribir la relación anterior en forma polinómica.
- Derivar la aproximación que a menudo se utiliza para estimar el pH de una solución de un ácido débil en agua.
- Calcular el pH de una solución de un ácido o base débil monoprótico débil, empleando la “regla del cinco por ciento” para determinar si la aproximación 2-4 está justificada.
- Predecir si una solución acuosa de una sal será ácida o alcalina, y explique por qué escribiendo una ecuación apropiada.
La mayoría de los ácidos son débiles; hay cientos de miles de ellos, mientras que hay menos de una docena de ácidos fuertes. Podemos tratar las soluciones de ácidos débiles de la misma manera general que lo hicimos para los ácidos fuertes. La única diferencia es que ahora debemos tomar en cuenta la “disociación” incompleta del ácido. Comenzaremos con el caso simple del ácido puro en agua, para luego pasar de ahí al más general en el que estén presentes sales del ácido. Estas últimas mezclas se conocen como soluciones tampón y son extremadamente importantes en química, fisiología, industria y en el medio ambiente. Para mantener nuestra notación lo más simple posible, nos referiremos a “iones hidrógeno” y [H +] por brevedad, y, donde sea práctico hacerlo, asumiremos que el ácido HA “ioniza” o “disocia” en H + y su base conjugada A−.
1 Soluciones acuosas de ácidos o bases débiles
Un ácido débil (representado aquí como HA) es aquel en el que la reacción
\[HA \rightleftharpoons A^– + H^+ \label{1-1}\]
está incompleto. Esto significa que si agregamos 1 mol del ácido puro HA al agua y hacemos que el volumen total sea 1 L, la concentración de equilibrio de la base conjugada A — será menor (a menudo mucho menor) que 1 M/L, mientras que la de HA no disociada será solo ligeramente menor que 1 M /L. La ecuación nos\(\ref{1-1}\) dice que la disociación de un ácido débil HA en agua pura produce concentraciones idénticas de sus especies conjugadas. Representemos estas concentraciones por x. Entonces, en nuestra solución “1 M", la concentración de cada especie es como se muestra aquí:
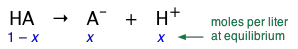 (1-2)
(1-2)
Al tratar problemas que involucran ácidos o bases, hay que tener en cuenta que cuando hablamos de “la concentración”, generalmente nos referimos a la concentración nominal o analítica que comúnmente se denota con C a. Por ejemplo, para una solución elaborada combinando 0.10 mol de ácido fórmico puro HCOOH con agua suficiente para componer un volumen de 1.0 L, C a = 0.10 M. Sin embargo, sabemos que la concentración de la especie real [HCOOH] será menor el 0.10 M porque algunos termina como el ion formiato HCOO —. Por supuesto, siempre será el caso de que la suma
\[[HCOOH] + [HCOO^–] = C_a\]
Para el caso general de un HA ácido, podemos escribir una ecuación de balance de masas
\[C_a = [HA] + [A^–] \label{1-3}\]
lo que nos recuerda que la parte “A” del ácido siempre debe estar en alguna parte!
Para un ácido fuerte como el clorhídrico, su disociación total significa que [HCl] = 0, por lo que la relación de balance de masas en Ecuación\(\ref{1-3}\) reduce a la expresión trivial C a = [Cl-]. Cualquier ácido para el cual [HA] > 0 es por definición un ácido débil.
Del mismo modo, para una base B podemos escribir
\[C_b = [B] + [HB^+] \label{1-4}\]
Nota
“Concentración del ácido” y [HA] son típicas no lo mismo.
Concentraciones de equilibrio del ácido y su base conjugada
De acuerdo con las ecuaciones anteriores, las concentraciones de equilibrio de A — y H + serán idénticas (siempre y cuando el ácido no sea tan débil o diluido que podamos descuidar la pequeña cantidad de H + aportada por la autoprotólisis de H 2 O). Representemos estas concentraciones por x. Luego, en una solución que contiene 1 M/L de un ácido débil, la concentración de cada especie es como se muestra aquí:
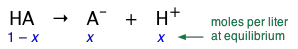 (1-5)
(1-5)
Sustituyendo estos valores en la expresión de equilibrio para esta reacción, obtenemos
\[\dfrac{[A^-][H^+]}{[HA]} = \dfrac{x^2}{1-x} \label{1-6}\]
Para predecir el pH de esta solución, debemos resolver para x. La presencia de términos tanto en x como en x 2 aquí nos dice que se trata de una ecuación cuadrática. En la mayoría de los casos prácticos en los que K a es 10 —4 o menor, podemos suponer que x es mucho menor que 1 M, lo que nos permite hacer la aproximación simplificadora
\[(1 – x) \approx 1 \label{1-7}\]
para que
\ (x^2\ aprox Ka\]
y por lo tanto
\[x = \sqrt{K_a} \label{1-8}\]
Esta aproximación generalmente no será válida cuando el ácido sea muy débil o muy diluido.
Soluciones de concentración arbitraria
El desarrollo anterior fue para una solución elaborada tomando 1 mol de ácido y añadiendo agua suficiente para hacer su volumen 1.0 L. En tal solución, la concentración nominal del ácido, denotada por C a, es de 1 M.
Podemos generalizar esto fácilmente a soluciones en las que C a tiene algún valor:
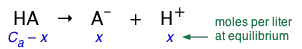 (1-9)
(1-9)
A la relación anterior se le conoce como “balance de masas en A”. Expresa el simple hecho de que la parte “A” del ácido debe estar siempre en alguna parte —ya sea unida al hidrógeno, o en forma del anión hidratado A —.
La expresión de equilibrio correspondiente es
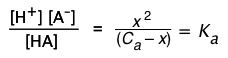 (1-10)
(1-10)
y las aproximaciones (cuando estén justificadas) 1-3a y 1-3b se convierten
(C a — x) ≈ C a (1-11)
x ≈ (C a K a) ½ (1-12)
Estimar el pH de una solución 0.20 M de ácido acético, K a = 1.8 × 10 —5.
Solución
Por brevedad, representaremos el ácido acético CH 3 COOH como HAc, y el ion acetato por Ac —. Como antes, establecemos x = [H +] = [Ac —], descuidando la pequeña cantidad de H + que proviene de la disociación del agua.
Sustitución en los rendimientos de expresión de equilibrio
El valor bastante pequeño de K a sugiere que podemos dejar caer el término x en el denominador, de modo que
(x 2/0.20) ≈ 1.8E-5 o x ≈ (0.20 × 1.8E—5) ½ = 1.9E-3 M
El pH de la solución es
—log (1.9E—3) = 2.7
Grado de disociación
A pesar de que sabemos que el proceso HA → H + A — no describe correctamente la transferencia de un protón a H 2 O, a los químicos les resulta conveniente utilizar el término “ionización” o “disociación”. El “grado de disociación” (denotado por\(\alpha\) de un ácido débil es solo la fracción
\[\alpha = \dfrac{[\ce{A^{-}}]}{C_a} \label{1-13}\]
que a menudo se expresa como un porcentaje (\(\alpha\)× 100).
El grado de disociación depende de la concentración
Es importante entender que mientras que K a para un ácido dado es esencialmente una constante,\(\alpha\) dependerá de la concentración del ácido. Tenga en cuenta que estas ecuaciones también son válidas para bases débiles si se utilizan K b y C b en lugar de K a y C a.
Esto se puede mostrar sustituyendo la Eq 5 en la expresión por K a:
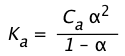 (1-14)
(1-14)
Resolver esto para\(\alpha\) resulta en una ecuación cuadrática, pero si el ácido es lo suficientemente débil como para poder decir (1 —) ≈ 1, la relación anterior se vuelve
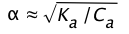 (1-15)
(1-15)
la cantidad de HA que se disocia varía inversamente con la raíz cuadrada de la concentración; a medida que C a se acerca a cero, se\(\alpha\) acerca a la unidad y [HA] se acerca a C a.
Este principio es una instancia de la ley de dilución de Ostwald que relaciona la constante de disociación de un electrolito débil (en este caso, un ácido débil), su grado de disociación y la concentración.
Una explicación común, pero incorrecta, de esta ley en términos del principio de Le Chatelier establece que la dilución aumenta la concentración de agua en la ecuación HA + H 2 O → H 3 O + A —, provocando con ello que este equilibrio se desplace hacia la derecha. El error aquí es que [H 2 O] en la mayoría de las soluciones acuosas es tan grande (55.5 M) que puede considerarse constante; esta es la razón por la que el término [H 2 O] no aparece en la expresión para K a. Otra explicación común es que la dilución reduce [H 3 O +] y [A —], desplazando así el proceso de disociación hacia la derecha. Sin embargo, la dilución reduce de manera similar [HA], lo que desplazaría el proceso hacia la izquierda. De hecho, estos dos procesos compiten, pero el primero tiene mayor efecto porque dos especies están involucradas.
Probablemente sea más satisfactorio evitar por completo los argumentos tipo Le Chatelier, y considerar la ley de dilución como un efecto de entropía, consecuencia de la mayor dispersión de energía térmica en todo el sistema. Esta energía es transportada por las unidades moleculares dentro de la solución; la disociación de cada unidad de HA produce dos nuevas partículas que luego van por su propio camino, extendiendo (o “diluyendo”) la energía térmica más extensamente y aumentando masivamente el número de estados microscópicos energéticamente equivalentes, de los cuales la entropía es una medida. (Más sobre esto aquí)
El grado de disociación depende del pH
Las parcelas de este tipo se discuten con más detalle en la siguiente lección de este conjunto bajo el epígrafe fracciones de ionización.
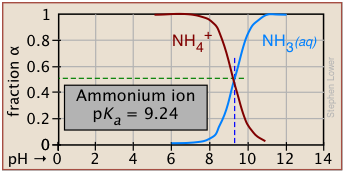
El principio de Le Chatelier predice que el alcance de la reacción
\[\ce{HA → H^{+} + A^{–} }\]
se verán afectados por la concentración de iones hidrógeno y, por lo tanto, por el pH. Esto se ilustra aquí para el ion amonio. Observe que cuando el pH es el mismo que el pK a, las concentraciones de las formas ácido y base del par conjugado son idénticas.
Una solución 0.75 M de un HA ácido tiene un pH de 1.6. ¿Cuál es su porcentaje de disociación?
Solución
La estequiometría de disociación HA → H + + AB — nos dice que las concentraciones [H +] y [A —] serán idénticas. Así [H +] = 10 —1.6 = 0.025 M = [A —]. La fracción de disociación
\[α = \dfrac{[\ce{A^{–}}]}{[\ce{HA}]} = \dfrac{0.025}{0.75} = 0.033\]
y así el ácido es 3.3% disociado a una concentración de 0.75 M.
En ocasiones se da el porcentaje de disociación, y se debe evaluar K a.
Un AH ácido débil se disocia al 2 por ciento en una solución de 1.00 M. Encuentra el valor de K a.
Solución
La concentración de equilibrio de HA será 2% menor que su concentración nominal, por lo que [HA] = 0.98 M, [A —] = [H +] = 0.02 M. Sustituir estos valores en la expresión de equilibrio da
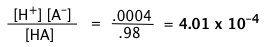
“Concentración del ácido” y [HA] no son lo mismo
Al tratar problemas que involucran ácidos o bases, hay que tener en cuenta que cuando hablamos de “la concentración”, generalmente nos referimos a la concentración nominal o analítica que comúnmente se denota con C a.
Entonces, para una solución elaborada combinando 0.10 mol de ácido fórmico puro HCOOH con agua suficiente para componer un volumen de 1.0 L, C a = 0.10 M. Sin embargo, sabemos que la concentración de la especie real [HCOOH] será menor el 0.10 M porque algunos termina como el ion formiato HCOO —. No obstante, siempre ocurrirá que la suma
[HCOOH] + [HCOO —] = C a.
Para el caso general de un HA ácido, podemos escribir una ecuación de balance de masas
C a = [HA] + [A —] (1-16)
lo que nos recuerda que la parte “A” del ácido siempre debe estar en alguna parte!
Del mismo modo, para una base B podemos escribir
C b = [B] + [HB +] (1-17)
El grado de disociación varía inversamente con la concentración
Si representamos la disociación de una solución C a M de un ácido débil por
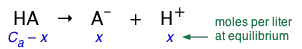 (1-18)
(1-18)
entonces su constante de disociación viene dada por
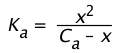 (1-19)
(1-19)
Debido a que el término C a está en el denominador aquí, vemos que la cantidad de HA que se disocia varía inversamente con la concentración; a medida que C a se acerca a cero, [HA] se acerca a C a.
Si representamos la fracción del ácido que se disocia como
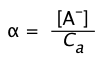 (1-20)
(1-20)
entonces la Eq 8 se convierte
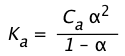 (1-21)
(1-21)
Si el ácido es suficientemente débil como para que x no supere el 5% de C a,
el término -término en el denominador se puede bajar, rindiendo
K a ≈ C a 2 (1-22)
Tenga en cuenta que las ecuaciones anteriores también son válidas para bases débiles si se utilizan Kb y C b en lugar de K a y C a.
Comparar el porcentaje de disociación de 0.10 M y .0010 M soluciones de ácido bórico (\(K_a = 3.8 \times 10^{-10}\)).
Solución
El ácido bórico es suficientemente débil como para que podamos usar la aproximación de Eq 1-22 para calcular a: = (5.8E—10/.1) ½ = 7.5E-5; multiplicar por 100 para obtener .0075% diss. Para el ácido más diluido, un cálculo similar arroja 7.6E—4, o 0.76%.
2 Realización de cálculos ácido-base
En el Ejemplo de Problema 1, calculamos el pH de una solución de ácido monoprótico, haciendo uso de una aproximación para evitar la necesidad de resolver una ecuación cuadrática. Esto plantea la pregunta: ¿qué tan “exactos” deben ser los cálculos del pH? Resulta que la relación entre el pH y la concentración nominal de un ácido, base o sal (y especialmente mezclas arbitrarias de estos) puede llegar a ser bastante complicada, requiriendo la solución de conjuntos de ecuaciones simultáneas.
Sin embargo, para casi todas las aplicaciones prácticas, se pueden hacer algunas aproximaciones que simplifiquen la matemática sin restar importancia a la precisión de los resultados.
Las constantes de equilibrio rara vez se conocen exactamente
Como señalamos en la lección anterior, el valor “efectivo” de una constante de equilibrio (la actividad) generalmente será diferente del valor dado en las tablas en todas las soluciones iónicas menos en las más diluidas. Incluso si el ácido o base en sí se diluye, la presencia de otros iones “espectador” como Na + a concentraciones muy superiores a 0.001 M puede introducir error.
El consejo habitual es considerar que los valores de K a sean precisos a ±5 por ciento en el mejor de los casos, e incluso más inciertos cuando las concentraciones iónicas totales superan 0.1 M. Como consecuencia de esta incertidumbre, generalmente hay pocas razones prácticas para expresar los resultados de un cálculo de pH a más de dos dígitos significativos.
Encontrar el pH de una solución de un ácido monoprótico débil
Este es, con mucho, el tipo de problema más común que encontrarás en una clase de Química de primer año. Se le da la concentración del ácido, expresada como C a moles/L, y se le pide que encuentre el pH de la solución. El primer paso muy importante es asegurarse de entender el problema escribiendo la ecuación que expresa las concentraciones de cada especie en términos de un solo desconocido, que representamos aquí por x:
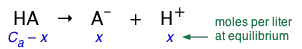 (2-1)
(2-1)
Sustituyendo estos valores en la expresión para\(K_a\), obtenemos
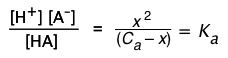 (2-2)
(2-2)
¡No te molestes en memorizar estas ecuaciones! Si entiendes el concepto de balance de masas en “A” expresado en (2-1), y puedes escribir la expresión para K a, simplemente sustituyes las x en esta última, ¡y estás fuera! Si sientes la necesidad de memorizar cosas que no necesitas, es probable que realmente no entiendas el material, ¡y eso debería ser una verdadera preocupación!
Para predecir el pH de esta solución, primero debemos encontrar [H +], es decir, x. La presencia de términos tanto en x como en x 2 aquí nos dice que se trata de una ecuación cuadrática. Esto se puede reorganizar en x 2 = K a (1 — x) que, cuando se escribe en forma polinómica estándar, se convierte en el cuadrático
\[[\ce{H^{+}}]^2 – C_a [H^{+}] – K_w = 0 \label{2-3}\]
Sin embargo, ¡no entres en pánico! Como explicaremos más adelante, en la mayoría de los casos prácticos podemos hacer algunas aproximaciones simplificadoras que eliminan la necesidad de resolver una cuadrática. Y cuando, como sucede ocasionalmente, un cuadrático es inevitable, te mostraremos algunas formas relativamente indoloras de afrontarlo.
Cómo lidiar con las ecuaciones cuadráticas
Lo que hagas dependerá de qué herramientas tengas disponibles. Si solo estás armado con una calculadora simple, entonces siempre está la venerable fórmula cuadrática de la que quizás hayas aprendido en la secundaria, pero si es posible, debes evitarla: su uso directo en el presente contexto es algo laborioso y susceptible al error.
¡El uso de la fórmula cuadrática estándar en una computadora o calculadora programable puede llevar a resultados raros!
La razón de esto es que si b 2 >> |4 ac |, una de las raíces requerirá la resta de dos términos cuyos valores son muy cercanos; esto puede llevar a un error considerable cuando se lleva a cabo por software que tiene precisión finita.
Uno puede sortear esto calculando la cantidad
\[Q = –\dfrac{b + \pm (b) \sqrt{ b^2 – 4ac}}{2}\]
de donde las raíces son x 1 = Q/a y x 2 = c/Q. (Consulte cualquier libro de texto sobre computación numérica para obtener más información sobre este y otros metnodios.)
Sin embargo, ¿quién quiere molestarse con estas cosas para resolver problemas típicos de química? ¡Mejor evitar las cuadráticas por completo si es posible!
Recuerde: siempre hay dos valores de x (dos raíces) que satisfacen una ecuación cuadrática. Para todos los cálculos de equilibrio ácido-base que estén correctamente establecidos, estas raíces serán reales, y sólo una será positiva; esta es la que tomas como respuesta.
Aproximaciones, aplicadas juiciosamente, simplifican la matemática
Ya hemos encontrado dos de estas aproximaciones en los ejemplos de la sección anterior:
- En todas las soluciones menos en las más diluidas, podemos suponer que la disociación del ácido HA es la única fuente de H +, siendo insignificante el aporte debido a la autoprotólisis del agua.
- Pudimos simplificar las expresiones de equilibrio asumiendo que el término x, que representa la cantidad de ácido disociado, es tan pequeño en comparación con la concentración nominal del ácido C a que se puede descuidar. Así, en el Ejemplo de Problema 1, el término en el denominador que tiene la forma (0.1 - x), que representa la concentración de equilibrio del ácido no disociado, se sustituye por 0.1.
La mayoría de las personas que trabajan en el campo de la química práctica nunca encontrarán situaciones en las que la primera de estas aproximaciones no sea válida. Este no es el caso, sin embargo, para el segundo.
¿Debo dejar caer la x, o seguir adelante con la forma cuadrática?
Si el ácido está bastante concentrado (generalmente con C a > 10 —3 M) y suficientemente débil como para que la mayor parte permanezca en su forma protonada HA, entonces la concentración de H + que produce puede ser suficientemente pequeña como para que la expresión de K a reduce a
K a ≈ [H +] 2/C a
para que
[H +] ≈ (K a C a) ½ (2-4)
Esto puede ser una gran comodidad porque evita la necesidad de resolver una ecuación cuadrática. No obstante, también te expone al peligro de que esta aproximación pueda no estar justificada.
El consejo habitual es que si esta primera aproximación de x supera el 5 por ciento del valor del que se está restando (0.10 en el presente caso), entonces no se justifica la aproximación. A esto lo llamaremos la “regla del cinco por ciento”.
Problema Ejemplo 5 - pH y grado de disociación
- Estimar el pH de una solución 0.20 M de ácido acético, K a = 1.8 × 10 —5.
- ¿Qué porcentaje del ácido se disocia?
Solución
Por brevedad, representaremos el ácido acético CH 3 COOH como HAc, y el ion acetato por Ac —. Como antes, establecemos x = [H +] = [Ac —], descuidando la pequeña cantidad de H + que proviene de la disociación del agua.
Sustitución en los rendimientos de expresión de equilibrio
¿Podemos simplificar esto aplicando la aproximación 0.20 — x ≈ 0.20? Al mirar el número del lado derecho de esta ecuación, observamos que es bastante pequeño. Esto significa que el lado izquierdo debe ser igualmente pequeño, lo que requiere que el denominador sea bastante grande, por lo que probablemente podamos salirnos con la suya cayendo x.
(x 2/0.20) = 1.8E-5 o x = (0.20 × 1.8E—5) ½ = 1.9E-3 M
La “regla del 5 por ciento” requiere que el resultado anterior no sea mayor al 5% de 0.20, o 0.010. Debido a que 0.0019 cumple esta condición, podemos establecer
x = [H +] ≈ 1.9 × 10 —3 M, y el pH será —log (1.9 × 10 —3) = 2.7
b) Porcentaje de disociación: 100% × (1.9 × 10 —3 M)/(0.20 M) = 0.95%
Las bases débiles se tratan de una manera exactamente análoga:
La metilamina CH 3 NH 2 es un gas cuyo olor se nota alrededor de los peces en descomposición. Una solución de CH 3 NH 2 en agua actúa como una base débil. Se encontró que una solución 0.10 M de esta amina en agua está 6.4% ionizada. Usa esta información para encontrar\ Kb y pK b para metilamina.
Solución: Cuando la metilamina “ioniza”, toma un protón del agua, formando el ion metilaminio:
CH 3 NH 2 + H 2 O → CH 3 NH 3 + OH —
Dejar x = [CH 3 NH 3 +] = [OH —] = .064 × 0.10 = 0.0064
[CH 3 NH 2] = (0.10 — .064) = 0.094
Sustituya estos valores en expresión de equilibrio por\ Kb:
Para asegurarnos de que podemos parar aquí, observamos que (3.6E4/.01) = .036; esto es menor que .05, así que pasamos la regla del 5% y podemos usar la aproximación y soltar el término
x en el denominador.
pK b = — log\ Kb = — log (4.4 × 10 —10) = 3.36
Sin embargo, ¡uno no siempre se baja tan fácilmente!
Con una K a de 0.010, HClO 2 es uno de los ácidos débiles “más fuertes”, gracias a los dos átomos de oxígeno cuya electronegatividad retira alguna carga negativa del átomo de cloro, facilitando que el hidrógeno salga como protón.
Encuentra el pH de una solución 0.015 M de ácido clórico en agua pura.
i)
La aproximación 0.10 — x ≈ .015 nos da
x ≈ (K a C a) ½ = (0.10 ×.010) ½ = (.001) ½ = .032 (ii)
Este resultado debería sonar campanas de alarma en tu cabeza de inmediato; aquí no hay forma de que uno pueda obtener 0.032 moles de H + de 0.010 moles de ¡incluso el ácido más fuerte!
La dificultad, en este caso, surge del valor numérico de K a que difiere de la concentración nominal 0.10 M por solo un factor de 10. Como resultado,
x/C a = .032/0.10 = 0.32 que claramente supera el límite del 5%; no tenemos más remedio que enfrentar el monte completo de la solución cuadrática. (véase el Ejemplo de Problema 8 a continuación).
Aproximaciones sucesivas te llevarán allí con matemáticas mínimas
En el método de aproximaciones sucesivas, comienzas con el valor de [H +] (es decir, x) que calculaste según (2-4), que se convierte en la primera aproximación. Luego sustituye esto por (2-2), que resuelves para obtener una segunda aproximación. Este ciclo se repite hasta que las diferencias entre las respuestas sucesivas se vuelven lo suficientemente pequeñas como para ignorarlas.
Estimar el pH de una solución acuosa 0.10 M de HClO 2, K a = 0.010, utilizando el método de aproximaciones sucesivas.
Solución: La condición de equilibrio es
i)
Resolvemos esto para x, dando como resultado la primera aproximación x 1, y luego conectamos sucesivamente cada resultado a la ecuación anterior, produciendo aproximaciones x 2 y x 3:
ii)
Las dos últimas aproximaciones x 2 y x 3 están dentro del 5% entre sí.
Tenga en cuenta que si hubiéramos usado x 1 como respuesta, el error habría sido del 18%.
(Una solución numérica exacta produce las raíces 0.027016 y —0.037016)
Use una calculadora gráfica o computadora para encontrar la raíz positiva
Las raíces reales de una ecuación polinómica se pueden encontrar simplemente trazando su valor en función de una de las variables que contiene.
En este ejemplo, se encontró el pH de una solución 10 —6 M de ácido hipocloroso (HOCl, K a = 2.9E—8) trazando el valor de
y = ax 2 + b x + c, cuyas raíces son los dos valores de x que corresponden a y = 0.
Este método generalmente requiere un poco de prueba y error informado para hacer visibles las ubicaciones de las raíces dentro de la escala de los ejes.
Sea perezoso y use un solucionador de ecuaciones cuadráticas en línea
Si busca en Google “solucionador de ecuaciones cuadráticas”, encontrará numerosos sitios en línea que ofrecen soluciones rápidas y fáciles de “llenar los espacios en blanco”.
Desafortunadamente, pocos de estos serán útiles para problemas ácido-base que involucran números que deben expresarse en “notación E” (por ejemplo, 2.7E-11.) De los que sí lo hacen, el del sitio MathisFun es muy recomendable; otros se pueden encontrar aquí y en el sitio Quad2Deg.
Si puedes acceder a un solucionador de ecuaciones cuádruples en tu dispositivo electrónico personal o a través de Internet, esto es rápido e indoloro. Todo lo que necesitas hacer es escribir la ecuación en forma polinómica ax 2 + b x + c = 0, insertar valores para
a, b y c, ¡y listo!
Esto es tan fácil, que mucha gente prefiere evitar por completo la "prueba del 5%”, e ir directo a una solución exacta. Sin embargo, ¡asegúrate de poder hacer el 5% -cosa para exámenes donde los dispositivos accesibles a Internet no están permitidos!
Estimar el pH de una solución acuosa 0.10 M de HClO 2, K a = 0.010.
Solución
La ecuación de reacción HClO 2 → H + ClO 2 — define la expresión de equilibrio
Multiplicar la mitad derecha de los rendimientos de la expresión anterior
x 2 = 0.010 × (0.10 — x) = .0010 — .01 x que organizamos en forma polinómica estándar:
x 2 + 0.01 x — 0.0010 = 0
Al ingresar los coeficientes {1 .01 —.001} en un solucionador cuádruple en línea se obtienen las raíces
.027 y —.037. Tomando el positivo, tenemos [H +] = .027 M;
el pH de la solución es — log .027 = 1.6.
Nota: un error común es olvidar ingresar el signo menos para el último término; ¡intenta hacer esto y mira cómo el programa explota!
Evite las matemáticas por completo y haga una gráfica de log-C vs pH
Esto no sólo es sencillo de hacer (todo lo que necesitas es un trozo de papel y una recta), sino que te dará mucha más información sobre lo que está pasando, especialmente en los sistemas polipróticos. Todo explicado en la Sección 3 de la siguiente lección.
Soluciones de sales
La mayoría de las sales no forman soluciones de pH neutro
Las sales como el cloruro de sodio que se pueden elaborar combinando un ácido fuerte (HCl) con una base fuerte (NaOH, KOH) tienen un pH neutro, pero estas son excepciones a la regla general de que las soluciones de la mayoría de las sales son ligeramente ácidas o alcalinas.
Las sales de una base fuerte y un ácido débil producen soluciones alcalinas.
“Hidrolisis” significa literalmente “división de agua”, como lo ejemplifica la reacción A — + H 2 O → HA + OH —. El término describe lo que se creía que sucedía antes del desarrollo del modelo de transferencia de protones de Brønsted-Lowry.
Esta importante propiedad ha sido históricamente conocida como hidrólisis, término que todavía utilizan los químicos.
Algunos ejemplos:
- Cianuro Potasio
- KCN se puede pensar en la sal elaborada combinando la base fuerte KOH con el ácido débil HCN: K + + OH — → KOH. Cuando el KCN sólido se disuelve en agua, este proceso se invierte, produciendo una solución de los dos iones. K +, al ser un “ion fuerte”, no reacciona con el agua. Sin embargo, el “ion débil” CN —al ser la base conjugada de un ácido débil, tendrá tendencia a abstraer protones del agua: CN — + H 2 O → HCN + OH —, haciendo que la solución permanezca ligeramente alcalina.
- Bicarbonato de sodio
- NaHCO 3 (más propiamente conocido como hidrogenocarbonato de sodio) se disuelve en agua para producir una solución del ion hidrogenocarbonato HCO 3 —. Este ion es un anfolito —es decir, es tanto la base conjugada del ácido carbónico débil H 2 CO 3, como el ácido conjugado del ion carbonato CO 3 2—:
Por lo tanto, el ion HCO 3 es anfiprótico: puede tanto aceptar como donar protones, por lo que ambos procesos tienen lugar:

No obstante, si comparamos el K a y el K b de HCO 3 —, es evidente que su naturaleza básica gana, por lo que una solución de NaHCO 3 será ligeramente alcalina. (El valor de pK b se encuentra recordando que K a + K b = 14.)
- Acetato de sodio
- Una solución de CH 3 COONa sirve como modelo para la sal de iones fuertes de cualquier ácido orgánico, ya que todos estos ácidos son débiles: CH 3 COO — + H 2 O → CH 3 COOH + OH —
Las sales de la mayoría de los cationes (iones positivos) dan soluciones ácidas
Los protones pueden provenir del catión mismo (como ocurre con el ion amonio NH 4 +), o de aguas de hidratación que están unidas a un ion metálico.
Este último efecto ocurre con prácticamente todas las sales de metales más allá del Grupo I; es especialmente notable para sales de iones de transición como el hexaaquohierro (III) (“ion férrico”):
Fe (H 2 O) 6 3+ → Fe (H 2 O) 5 OH 2+ + H + (2-5)
Esto se produce porque el campo positivo del metal mejora la capacidad de las moléculas H 2 O en la capa de hidratación para perder protones. En el caso del ion hexahirado mostrado anteriormente, a cuya sucesión de pasos similares puede ocurrir, pero para la mayoría de los propósitos prácticos solo el primer paso es significativo.
Encuentra el pH de una solución 0.15 M de cloruro de aluminio.
Solución
El ion aluminio existe en el agua como hexaacuoaluminio Al (H 2 O) 6 3+, cuyo pK a = 4.9, K a = 10 —4.9 = 1.3E—5. Ajuste x = [H +] = [Al (H 2 O) 5 OH 2+], la expresión de equilibrio es
Usando la aproximación anterior, obtenemos
x ≈ (1.96E—6) ½ = 1.4E—3, correspondiente a pH = 2.8.
Finalmente, calculamos x/ C a = 1.4E—3 ÷ 0.15 = .012 confirmando que estamos dentro de la "regla del 5%”.
Las únicas sales comúnmente encontradas en las que el protón es donado por el catión mismo son las del ion amonio:
\[\ce{NH_4^{+}→ NH)3(aq) + H^{+}\lable{2-6}\]
Calcular el pH de una solución 0.15 M de NH4Cl. El ion amonio K a es 5.5E—10.
Solución
De acuerdo con la ecuación 6 anterior, podemos establecer [NH3] = [H +] = x, obteniendo la misma expresión de equilibrio que en el problema anterior.
Debido a que K a es bastante pequeño, podemos usar con seguridad la aproximación 0.15 - 1 ≈ .015, que produce pH = —log 0.90E—5 = 5.0
La mayoría de las sales de ácidos débiles forman soluciones alcalinas
Como se indica en el ejemplo, tales equilibrios favorecen fuertemente el lado izquierdo; cuanto más fuerte sea el AH ácido, menos alcalina será la solución salina.
Debido a que un ion derivado de un ácido débil como el HF es la base conjugada de ese ácido, no debería sorprenderte que una sal como NaF forme una solución alcalina, aunque el equilibrio favorezca mucho al lado izquierdo:
F — + H 2 O HF + OH — (2-7)
Solución de fluoruro de sodio
Encuentra el pH de una solución 0.15 M de NaF. (HF K a = 6.7E—4)
Solución: La reacción es F- + H 2 O = HF + OH —; debido a que el HF es un ácido débil, el equilibrio favorece fuertemente el lado derecho. Los rendimientos habituales de aproximación
Sin embargo, al calcular x/ C a = .01 ÷ 0.15 = .07, encontramos que esto no cumple con la "regla del 5%” para la validez de la aproximación. Por lo tanto, ampliamos la expresión de equilibrio
en forma polinómica estándar x 2 + 6.7E—4 x — 1.0E—4 = 0 e ingresa los coeficientes {1 6.7E—4 —.0001} en un solucionador cuadrático. Esto arroja la raíz positiva x = 0.0099 que resulta estar lo suficientemente cerca de la aproximación que podríamos haberla retenido después de todo.. ¡quizás el 5% es un poco demasiado restrictivo para cálculos de 2 dígitos significativos!
¿Y una sal de un ácido débil y una base débil?
Una sal de un ácido débil da una solución alcalina, mientras que la de una base débil produce una solución ácida. ¿Qué pasa si disolvemos una sal de un ácido débil y una base débil en agua? ¡Ah, esto puede ponerse un poco complicado! Sin embargo, esta situación se presenta con mucha frecuencia en aplicaciones tan diversas como la química fisiológica y la geoquímica.
Como ejemplo de cómo se podría abordar tal problema, considere una solución de formiato amónico, que contenga los iones NH 4+ y HCOO-. El ácido fórmico, el ácido orgánico más simple, tiene un pK a de 3.7; para NH 4 +, pK a = 9.3.
Aquí son posibles tres equilibrios que involucran a estos iones; además de las reacciones de los iones amonio y formiato con el agua, también debemos tener en cuenta su tendencia a reaccionar entre sí para formar la especie neutra parental:
| NH 4 + → NH 3 + H + | K 1 = 10 —9.3 |
| HCOO — + H 2 O → HCOOH + OH — | K 2 = (1O —14 /10 —3.7) = 10 —10.3 |
| NH 4 + + HCOO — → NH 3 + HCOOH | K 3 |
La inspección revela que la última ecuación anterior es la suma de las dos primeras, más la inversa de la disociación del agua
| H + + OH — → H 2 O | K 4 = 1/ K w |
Por lo tanto, el valor de K 3 es
(2-8)
Un tratamiento riguroso de este sistema requeriría que resolvamos estas ecuaciones simultáneamente con el balance de carga y las dos ecuaciones de balance de masa. Sin embargo, debido a que K 3 es varios órdenes de magnitud mayor que K 1 o K 2, podemos simplificar enormemente las cosas descuidando los otros equilibrios y considerando solo la reacción entre los iones amonio y formiato.
Observe que los productos de esta reacción tenderán a suprimir la extensión de los dos primeros equilibrios, reduciendo su importancia incluso más de lo que indicarían los valores relativos de las constantes de equilibrio.
formiato amónico
Estimar el pH de una solución 0.0100 M de formiato amónico en agua.
Solución: A partir de la estequiometría de HCOONH 4,
[NH 4 +] = [HCOO —] y [NH 3] = [HCOOH] (i)
luego, de la Ecuación 8 anterior,
![]() ii)
ii)
en la que K b es la constante base del amoníaco, K w /10 —9.3.
Del equilibrio de disociación del ácido fórmico tenemos
iii)
Ahora reescribimos la expresión para K 3
![]() iv)
iv)
que rinde
(v)
y así el pH es 6.5
Lo interesante de este último ejemplo es que el pH de la solución es aparentemente independiente de la concentración de la sal. Si K a = K b, entonces esto siempre es cierto y la solución será neutra (descuidando los efectos de actividad en soluciones de alta fuerza iónica). De lo contrario, es solo una aproximación que sigue siendo válida siempre y cuando la concentración de sal sea sustancialmente mayor que la magnitud de cualquiera de las constantes de equilibrio. Claramente, el pH de cualquier solución debe acercarse al del agua pura a medida que la solución se vuelve más diluida.
Sales de iones analitos
Los ácidos polipróticos forman múltiples aniones; aquellos que por sí mismos pueden donar protones, y por lo tanto son anfipróticos, se llaman analitos. El más conocido de estos es el ion bicarbonato (hidrogenocarbonato), HCO 3 —, que comúnmente conocemos en forma de su sal sódica NaHCO 3 como bicarbonato de sodio.
La otra serie de analitos que se encuentra ampliamente, especialmente en bioquímica, son las derivadas del ácido fosfórico:

Las soluciones de iones analitos que más a menudo necesitamos tratar son las de “iones fuertes”, generalmente Na +, pero a veces las de cationes del Grupo 2 como Ca 2+.
El tratamiento exacto de estos sistemas es generalmente bastante complicado, pero para los casos especiales en los que los sucesivos Ka del ácido parental están separados por varios órdenes de magnitud (como en los dos sistemas ilustrados anteriormente), una serie de aproximaciones reduce el problema a la expresión simple
(2-9)
lo cual, notará, ya que con la sal de un ácido débil y una base débil discutida en la subsección anterior predice que el pH es independiente de la concentración de la sal. Esto, por supuesto, es un indicio seguro de que este tratamiento es incompleto. Afortunadamente, sin embargo, funciona razonablemente bien para la mayoría de los propósitos prácticos, que comúnmente involucran soluciones tampón.
Tratamiento exacto de soluciones de ácidos y bases débiles
Cuando se trata de sistemas ácido-base que tienen K a muy pequeños, y/o soluciones que están extremadamente diluidas, puede ser necesario considerar todas las especies presentes en la solución, incluyendo las menores como OH —.
Esto casi nunca se requiere en los cursos de primer año. Sin embargo, para los estudiantes de cursos más avanzados, este “enfoque integral” (como suele llamarse) ilustra la importante metodología general para tratar problemas de equilibrio más complejos. También muestra explícitamente cómo hacer diversas aproximaciones simplifica gradualmente el tratamiento de sistemas más complejos.
Para mantener el tamaño de la presente lección dentro de límites razonables (y para proteger los ojos sensibles de los principiantes del impacto de confrontar ecuaciones simultáneas), este material ha sido colocado en una lección separada.
Un ácido diprótico H 2 A puede donar sus protones en dos pasos:
H 2 A → HA — →HA —
y de manera similar, para un ácido tripótico H 3 A:
H 3 A → H 2 A — → HA 2— → A 3—
En general, podemos esperar que K a 2 para la “segunda ionización” sea menor que K a 1 para el primer paso porque es más difícil eliminar un protón de una especie cargada negativamente. La magnitud de esta diferencia depende en gran medida de si los dos protones removibles están unidos al mismo átomo, o a átomos separados más separados.
Algunos ácidos polipróticos que debes conocer
Estos ácidos se enumeran en el orden decreciente de K a1. Los números por encima de las flechas muestran las K a sucesivas de cada ácido.
- Observe cómo los sucesivos K a de cada ácido se vuelven más pequeños y cómo sus proporciones se relacionan con las estructuras de cada ácido.
- El ácido sulfúrico es el único ácido poliprótico fuerte que es probable que encuentre.
- Nunca se ha detectado ácido sulfuroso; lo que denominamos H 2 SO 3 se representa más adecuadamente como una forma hidratada de dióxido de azufre: que se disocia en el ion hidrosulfito:
SO 2 ·H 2 O → HSO 3 — + H +. El ion HSO 3 — existe solo en solución; no se conocen sales sólidas de bisulfito. - De igual manera, nunca se ha aislado ácido carbónico puro, pero sí existe como especie minoritaria en una solución acuosa de CO 2: [CO 2 (aq)] = 650 [H 2 CO 3]. La fórmula H 2 CO 3 normalmente representa la combinación CO 2 (aq) y “verdadero” H 2 CO 3. Este último es en realidad alrededor de mil veces más fuerte de lo que indica el pK a de 6.3, que es el promedio ponderado de la mezcla de equilibrio.

Comparar los sucesivos valores pK a de los ácidos sulfúrico y oxálico (ver sus estructuras en el recuadro, arriba a la derecha), y explicar por qué deberían ser tan diferentes.
Solución: Los dos valores pK a de ácido sulfúrico difieren en 3.0 — (—1.9) = 4.9, mientras que para el ácido oxálico la diferencia es 1.3 — (—4.3) = 3.0. Esa es una diferencia de casi 100 entre los dos K a. Siempre se espera que la extracción de un segundo protón de una molécula que ya porta alguna carga negativa sea menos favorable energéticamente. En el ácido sulfúrico, los dos protones provienen de grupos —OH conectados al mismo átomo de azufre, por lo que la carga negativa que impide la pérdida del segundo protón se localiza más cerca del sitio de su remoción. En el ácido oxálico, los dos protones se eliminan de los grupos —OH unidos a átomos de carbono separados, por lo que la carga negativa de los iones mono-negativos ejercerá menos restricción en la pérdida del segundo protón.
Soluciones de ácidos polipróticos en agua pura
Con la excepción del ácido sulfúrico (y algunos otros ácidos dipróticos fuertes que rara vez se encuentran), la mayoría de los ácidos polipróticos tienen valores de K a1 suficientemente pequeños como para que sus soluciones acuosas contengan concentraciones significativas del ácido libre así como de los diversos aniones disociados.
Así, para un ácido diprótico típico H 2 A, debemos considerar los tres equilibrios acoplados
\[\ce{H_2A → H^+ + HA^{–} }\,\,\, K_1\]
\[\ce{HA^{–} → H^{+} + HA^{2–}} \,\,\,K_2\]
\[\ce{H_2O → H+ + OH– } \,\,\,K_w\]
Un tratamiento exacto de tal sistema de cuatro incógnitas [H 2 A], [HA —], [A 2—] y [H +] requiere la solución de una ecuación cuártica. Si incluimos [OH —], ¡es aún peor! En la mayoría de los casos prácticos, podemos hacer algunas aproximaciones simplificadoras:
- A menos que la solución sea extremadamente diluida o K 1 (y todas las K posteriores) sean extremadamente pequeñas, podemos olvidar que cualquier ion hidróxido está presente en absoluto.
- Si\ (K_1\) es bastante pequeño, y las proporciones de K sucesivas son razonablemente grandes, es posible que podamos, sin introducir demasiado error, descuidar a las otras K y tratar al ácido como monoprótico.
Además de los tres equilibrios enumerados anteriormente, una solución de un ácido poliprótico en agua pura está sujeta a las siguientes dos condiciones:
Balance de materiales: aunque la distribución de especies entre la forma ácida H 2 A y su base forma HAB —y A2— puede variar, su suma (definida como la “concentración total de ácido” Ca es una constante para una solución particular:
C a = [H 2 A] + [HA —] + [A 2—]
Balance de carga: La solución puede no poseer una carga eléctrica neta:
[H 3 O +] = [OH —] + [HA —] + 2 [A 2—]
¿Por qué multiplicamos [A 2—] por 2? Se necesitan dos moles de H 3 O + para equilibrar la carga de 1 mol de A 2—.
Tratamiento simplificado de soluciones de ácido poliprótico
Los cálculos que se muestran en esta sección son todo lo que necesita para los problemas de ácido poliprótico encontrados en la mayoría de los cursos universitarios de química de primer año. Los cursos más avanzados pueden requerir los métodos más exactos en la Lección 7.
Debido a que las constantes de equilibrio sucesivas para la mayoría de los ácidos polipróticos débiles con los que normalmente tratamos disminuyen en varios órdenes de magnitud, generalmente podemos salirnos con la suya considerando solo el primer paso de ionización. En la medida en que esto es cierto, aquí no hay nada realmente nuevo que aprender. Sin embargo, sin entrar en mucha aritmética complicada, muchas veces podemos ir más lejos y estimar la cantidad adicional de H + producida por el segundo paso de ionización.
a) Calcular el pH de una solución 0.050 M de CO 2 en agua.
Para H 2 CO 3, K 1 = 10 —6.4 = 4.5E—7, K 2 = 10 —10.3 = 1.0E—14.
b) Estimar la concentración del ion carbonato CO 3 2— en la solución.
Solución
a) Debido a que K 1 y K 2 difieren en casi cuatro órdenes de magnitud, inicialmente descuidaremos el segundo paso de disociación. Debido a que este último paso produce solo una pequeña concentración adicional de H +, podemos suponer que [H +] = [HCO 3 —] = x:
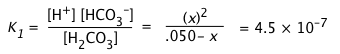 i)
i)
¿Podemos simplificar aún más esta expresión dejando caer la x en el denominador? Intentemos:
x = [0.05 × (4.5E—7)] ½ = 1.5E—4.
Aplicando la “prueba del 5 por ciento”, el cociente x/ C a no debe superar 0.05. Trabajando esto arroja (1.5E—4)/(.05) = .003, así podemos evitar una cuadrática.
x = [H +] ≈ (K a C a) ½ = [(4.5E—7) × .01] ½ = (.001) ½ = 0.032 M,
y el
pH = — log .032 = 1.5.
b) Ahora deseamos estimar [CO 3 2—] ≡ x.
Al examinar la segunda etapa de disociación, es evidente que ésta consumirá x mol/L de HCO 3 —, y producirá una cantidad equivalente de H + que se suma a la cantidad que calculamos en (a).
 ii)
ii)
Debido al valor muy pequeño de K 2 en comparación con K 1, podemos suponer que las concentraciones de HCO 3 — y H + producidas en la primera etapa de disociación no se alterarán significativamente en esta etapa. Esto nos permite simplificar la expresión constante de equilibrio y resolver directamente para [CO 3 2—]:
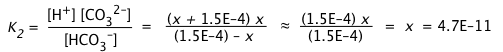 iii)
iii)
Por supuesto, no es coincidencia que esta estimación de [CO 3 2—] arroje un valor idéntico a K 2; esto es enteramente consecuencia de los supuestos simplificadores que hemos hecho. Sin embargo, siempre que K 2 << K 1 y la solución no esté altamente diluida, el resultado será lo suficientemente preciso para la mayoría de los propósitos.
Ácido sulfúrico: Un caso especial
Si bien este es un ácido fuerte, también es diprótico, y en su segundo paso de disociación actúa como un ácido débil. Debido a que el ácido sulfúrico es tan ampliamente empleado tanto en el laboratorio como en la industria, es útil examinar el resultado de tomar en consideración su segunda disociación.
Estimar el pH de una solución 0.010 M de H 2 SO 4. K 1 = 10 3, K 2 = 0.012
Solución: Debido a que K 1 > 1, podemos suponer que una solución de este ácido se disociará completamente en H 3 O + y iones bisulfito HSO 4 —. Así, el único equilibrio que debemos considerar es la disociación de una solución 0.010 M de iones bisulfito.
HSO 4 — + H 2 O → SO 4 2— + H 3 O +
Estableciendo [H +] = [SO 4 2—] = x, y dejando caer x del denominador, produce
x ≈ (0.010 x .012) ½ = (1.2E—4) ½ = 0.0011
Aplicando la “regla del cinco por ciento”, encontramos que x/C a = .0011/.01 = .11 que está muy por encima del error permisible, por lo que debemos proceder con la forma cuadrática. Reescribir la expresión de equilibrio en forma polinómica da
x 2 + 0.022 x — 1.2E—4 = 0
Al insertar los coeficientes {1 .022 .000012} en una utilidad quad-solver se obtienen las raíces 4.5E—3 y —0.0027. Tomando la raíz positiva, obtenemos
pH = — log (.0045) = 2.3
Así, la segunda “ionización” de H 2 SO 4 sólo ha reducido el pH de la solución en 0.1 unidad desde el valor (2.0) que teóricamente tendría si solo se considerara el primer paso.
4 Aminoácidos y Zwitteriones
Zwitteriones: hermafroditas moleculares
Los aminoácidos, los componentes básicos de las proteínas, contienen grupos amino —NH 2 que pueden aceptar protones, y grupos carboxilo —COOH que pueden perder protones. Bajo ciertas condiciones, estos eventos pueden ocurrir simultáneamente, de manera que la molécula resultante se convierte en un “doble ion” que va por su nombre alemán Zwitterion.
Glicina: el aminoácido más simple
El más simple de los veinte aminoácidos naturales que se presentan en las proteínas es la glicina H 2 N—CH 2 —COOH, que usamos como ejemplo aquí. Las soluciones de glicina se distribuyen entre las especies ácidas, zwitteriones y básicas:
(3-1)
Aunque la especie zwitteriónica es anfiprótica, difiere de un anfolito típico como el HCO 3, en que es eléctricamente neutra debido a la cancelación de las cargas eléctricas opuestas en los grupos amino y carboxilo.
Los aminoácidos son el tipo de zwitteriones más comúnmente encontrados, pero otras sustancias, como los compuestos de amonio cuaternario, también entran en esta categoría. Para obtener más información sobre los zwitteriones, consulte este artículo de Wikipedia o esta página de ChemGuide del Reino Unido.
En el siguiente desarrollo, utilizamos las abreviaturas H 2 Gly + (glicinio), HGly (zwitterion) y Gly — (glicinato) para denotar las formas disueltas.
Las dos constantes de acidez son
(3-2)
Si la glicina se disuelve en agua, el balance de carga requiere que
\[H_2Gly^+ + [H^+] \rightletharpoons [Gly^–] + [OH^–] \label{3-3}\]
Sustituir las expresiones constantes de equilibrio (incluida la de la autoprotólisis del agua) en la relación anterior produce
(3-4)
Si las Ecuaciones ii y iii en este Ejemplo Problema se recalculan para un rango de valores de pH, se pueden graficar las concentraciones de cada especie contra el pH para glicina 0.10 M en agua:
Este diagrama de distribución muestra que el zwitterión es la especie predominante entre los valores de pH correspondientes a los dos pK a s dados en la Ecuación\(\ref{3-1}\).
Calcular el pH y las concentraciones de las diversas especies en una solución 0.100 M de glicina.
Solución
Sustitución en la Eq 4 anterior rendimientos
i)
Las concentraciones de las formas ácido y base se encuentran a partir de sus respectivas expresiones constantes de equilibrio (Ecuaciones 2):
ii)
iii)
Las pequeñas concentraciones de estas especies de carga única en relación con C a = 0.10 muestran que el zwitterión es la única especie significativa de glicina en la solución.


