13.7: Cálculos exactos y aproximaciones
- Page ID
- 70663
- Comprender las ecuaciones exactas que implican los equilibrios ácido-base complejos en soluciones acuosas
Los métodos para tratar los equilibrios ácido-base que desarrollamos en las unidades anteriores de esta serie son ampliamente utilizados en la práctica ordinaria. Aunque muchos de estos implican aproximaciones de diversos tipos, los resultados suelen ser lo suficientemente buenos para la mayoría de los propósitos. A veces, sin embargo —por ejemplo, en problemas que involucran soluciones muy diluidas, las aproximaciones se descomponen, muchas veces porque ignoran las pequeñas cantidades de H + y OH — iones siempre presentes en el agua pura. En esta unidad, observamos el tratamiento exacto o “integral” de algunos de los tipos más comunes de problemas de equilibrios ácido-base.
Sistemas ácido-base fuertes
La definición habitual de un ácido o base “fuerte” es aquella que está completamente disociada en solución acuosa. El ácido clorhídrico es un ejemplo común de un ácido fuerte. Cuando el gas HCl se disuelve en agua, la solución resultante contiene los iones H 3 O +, OH —, y Cl —, pero excepto en soluciones muy concentradas, la concentración de HCl es insignificante; para todos los fines prácticos, las moléculas de “ácido clorhídrico”, HCl, no existen en soluciones acuosas diluídas. Para especificar las concentraciones de las tres especies presentes en una solución acuosa de HCl, necesitamos tres relaciones independientes entre ellas.
Condiciones limitantes
Estas relaciones se obtienen observando que ciertas condiciones deben mantenerse siempre para las soluciones acuosas:
- El equilibrio de disociación del agua siempre debe satisfacerse:\[[H^+][OH^–] = K_w \label{1-1}\]
- El ácido no disociado y su base conjugada deben estar en balance de masa. Las concentraciones reales del ácido y su base conjugada pueden depender de una serie de factores, pero su suma debe ser constante, e igual a la “concentración nominal”, que designamos aquí como\(C_a\). Para una solución de HCl, esta ecuación sería\[[HCl] + [Cl^–] = C_a \label{1-2}\] Debido a que un ácido fuerte está por definición completamente disociado, podemos descuidar el primer término y escribir la condición de balance de masas como\[[Cl^–] = C_a \label{1-3}\]
- En cualquier solución iónica, la suma de las cargas eléctricas positivas y negativas debe ser cero; es decir, todas las soluciones son eléctricamente neutras. Esto se conoce como el principio de electroneutralidad. \[[H^+] = [OH^–] + [Cl^–] \label{1-4}\]
El siguiente paso es combinar estas tres condiciones limitantes en una sola expresión que relaciona la concentración de iones hidronio con\(C_a\). Esto se hace mejor iniciando con una ecuación que relacione varias cantidades y sustituyendo los términos que queremos eliminar. Así podemos deshacernos del\([Cl^–]\) término sustituyendo Ecuación\(\ref{1-3}\) en Ecuación\(\ref{1-4}\):
\[[H^+] = [OH^–] + C_a \label{1-5}\]
El\([OH^–]\) término puede ser eliminado mediante el uso de Ecuación\(\ref{1-1}\):
\[[H^+] = C_a + \dfrac{K_w}{[H^+]} \label{1-6}\]
Esta ecuación nos dice que la concentración de iones hidronio será la misma que la concentración nominal de un ácido fuerte siempre y cuando la solución no esté muy diluida. A medida que la concentración de ácido cae por debajo de aproximadamente 10 —6 M, sin embargo, predomina el segundo término;\([H^+]\) se\(10^{–7} M\) aproxima\(\sqrt{K_w}\) o a 25 °C. La concentración de iones hidronio por supuesto nunca puede caer por debajo de este valor; ¡ninguna cantidad de dilución puede hacer que la solución sea alcalina!
¡Ninguna cantidad de dilución puede hacer alcalina la solución de un ácido fuerte!
Observe que la ecuación\(\ref{1-6}\) es una ecuación cuadrática; en forma polinómica regular se reescribiría como
\[[H^+]^2 – C_a[H^+] – K_w = 0 \label{1-7}\]
La mayoría de los problemas prácticos que involucran ácidos fuertes se refieren a soluciones más concentradas en las que se\(\ref{1-7}\) puede dejar caer el segundo término de la Ecuación, produciendo la relación simple
\[[H^+] \approx [A^–]\]
Actividades y Soluciones Concentradas de Ácidos Fuertes
En soluciones más concentradas, las interacciones entre iones hacen que sus concentraciones “efectivas”, conocidas como sus actividades, se desvíen de sus concentraciones “analíticas”. Así, en una solución preparada añadiendo 0.5 moles del ácido muy fuerte HClO 4 a agua suficiente para hacer el volumen 1 litro, las mediciones de depresión del punto de congelación indican que las concentraciones de iones hidronio y perclorato son solo de aproximadamente 0.4 M. Esto no quiere decir que el ácido esté solo 80% disociado; no hay evidencia de moléculas de HClO 4 en la solución. Lo que ha ocurrido es que alrededor del 20% de los iones H 3 O + y ClO 4 — han formado complejos de pares iónicos en los que las especies cargadas opuestamente están ligadas flojamente por fuerzas electrostáticas. De igual manera, en una solución 0.10 M de ácido clorhídrico, la actividad de H + es 0.81, o solo 81% de su concentración. (Consulte el cuadro verde a continuación para obtener más información sobre esto.)
Las actividades son importantes porque solo estas funcionan correctamente en los cálculos de equilibrio. La relación entre la concentración de una especie y su actividad se expresa por el coeficiente de actividad\(\gamma\):
\[a = \gamma C \label{1-8}\]
A medida que una solución se diluye, se\(\gamma\) acerca a la unidad. A concentraciones iónicas por debajo de aproximadamente 0.001 M, generalmente se pueden usar concentraciones en lugar de actividades con error insignificante. Recordemos que el pH se define como el logaritmo negativo de la actividad del ión hidrógeno, no su concentración.
No se pueden determinar las actividades de iones individuales, por lo que los coeficientes de actividad en las soluciones iónicas son siempre el promedio, o la media, de aquellos para todas las especies iónicas presentes. Esta cantidad se denota como\(\gamma_{\pm}\).
A concentraciones muy altas, las actividades pueden apartarse salvajemente de las concentraciones. Esta es una consideración práctica cuando se trata de ácidos minerales fuertes que están disponibles en concentraciones de 10 M o mayores. En una solución 12 M de ácido clorhídrico, por ejemplo, el coeficiente medio de actividad iónica* es 207. Esto significa que bajo estas condiciones con [H +] = 12, la actividad {H +} = 2500, correspondiente a un pH de aproximadamente —3.4, en lugar de —1.1 como podría predecirse si se estuvieran utilizando concentraciones. Estos coeficientes de actividad muy altos también explican otro fenómeno: por qué se puede detectar el olor de HCl sobre una solución concentrada de ácido clorhídrico a pesar de que este ácido está supuestamente "100% disociado”.
A estas altas concentraciones, un par de iones “disociados”\(H^+\) y ocasionalmente\(Cl^–\) se encontrarán tan cerca entre sí que pueden actuar momentáneamente como una unidad de HCl; algunos de estos pueden escapar como\(HCl(g)\) antes de que los movimientos térmicos los vuelvan a romper. Bajo estas condiciones, la “disociación” comienza a perder su significado para que en efecto, la disociación ya no sea completa. Si bien la concentración de siempre\(HCl(aq)\) será muy pequeña, su propio coeficiente de actividad puede ser tan grande como 2000, lo que significa que su tendencia a escapar de la solución es extremadamente alta, por lo que la presencia de incluso una cantidad minúscula es muy notoria.
Ácidos y bases monopróticos débiles
La mayoría de los ácidos son débiles; hay cientos de miles de ellos, mientras que no hay más de unas pocas docenas de ácidos fuertes. Podemos tratar las soluciones de ácidos débiles exactamente de la misma manera general que lo hicimos para los ácidos fuertes. La única diferencia es que ahora debemos incluir la expresión de equilibrio para el ácido. Comenzaremos con el caso simple del ácido puro en agua, para luego pasar de ahí al más general en el que están presentes cationes fuertes. En esta exposición, nos referiremos a “iones hidrógeno” y\([H^+]\) por brevedad, y asumiremos que el ácido se\(HA\) disocia en\(H^+\) y su base conjugada\(A^-\).
Ácido puro en agua
Además de las especies H +, OH —, y A− que tuvimos en el caso del ácido fuerte, ahora tenemos el HA ácido no disociado; cuatro variables, que requieren cuatro ecuaciones.
- Equilibrios
\[ [H^+][OH^–] = K_w \label{2-1}\]
\[ K_a = \dfrac{[H^+][A^–]}{[HA]} \label{2-2}\]
- Balance de masa
\[ C_a = [HA] + [A^–] \label{2-3}\]
- Saldo de carga
\[[H^+] = [OH^–] + [HA^–] \label{2-4}\]
Para eliminar [HA] de la ecuación\(\ref{2-2}\), resolvemos Ecuación\(\ref{2-4}\) para este término, y sustituimos la expresión resultante en el numerador:
\[ K_a =\dfrac{[H^+]([H^+] - [OH^-])}{C_a-([H^+] - [OH^-]) } \label{2-5}\]
Esta última ecuación se simplifica multiplicando y reemplazando [H +] [OH —] por K w. Luego nos deshacemos del término [OH —] reemplazándolo por K w/[H +]
\[[H^+] C_b + [H^+]^2 – [H^+][OH^–] = K_a C_a – K_a [H^+] + K_a [OH^–]\]
\[[H^+]^2 C_b + [H^+]^3 – [H^+] K_w = K_a C_a – K_a [H^+] + \dfrac{K_a K_w}{[H^+]}\]
Reorganizado en forma polinómica estándar, esto se convierte en
\[[H^+]^3 + K_a[H^+]^2 – (K_w + C_aK_a) [H^+] – K_a K_w = 0 \label{2-5a}\]
Para la mayoría de las aplicaciones prácticas, podemos hacer aproximaciones que eliminan la necesidad de resolver una ecuación cúbica.
Aproximación 1: Descuidar a la población de hidróxido
A menos que el ácido sea extremadamente débil o la solución esté muy diluida, la concentración de OH —puede descuidarse en comparación con la de [H +]. Si asumimos que [OH —] [H +], entonces la Ecuación\(\ref{2-5a}\) puede simplificarse a
\[K_a \approx \dfrac{[H^+]^2}{C_a-[H^+]} \label{2-6}\]
que es una ecuación cuadrática:
\[[H^+]^2 +K_a[H^+]– K_aC_a \approx 0 \label{2-7}\]
y así, a partir de la fórmula cuadrática,
\[ [H^+] \approx \dfrac{K_a + \sqrt{K_a + 4K_aC_a}}{2} \label{2-8}\]
Calcular el pH de una solución 0.0010 M de ácido acético,\(K_a = 1.74 \times 10^{–5}\).
Solución
Primera aproximación:
\[[H^+] = \sqrt{(1.0 \times 10^{–3}) × (1.74 \times 10^{–5}} = \sqrt{1.74 \times 10^{–8}} = 1.3 \times 10^{–4}\; M. \nonumber \]
Aplicando la "prueba del 5%”,
\[\dfrac{1.3 \times 10^{–4}}{1.0 \times 10^{–3}} = 0.13\nonumber \]
Esto supera 0.05, por lo que debemos resolver explícitamente la Ecuación cuadrática\(\ref{2-7}\) para obtener dos raíces:\(+1.2 \times 10^{–4}\) y\(–1.4 \times 10^{-4}\). Tomando la raíz positiva, tenemos
\[pH = –\log (1.2 \times 10^{–4}) = 3.9 \nonumber \]
Aproximación 2: Ácidos muy concentrados
Si el ácido está bastante concentrado (generalmente más de 10 —3 M), con frecuencia se puede lograr una mayor simplificación haciendo la suposición de que\([H^+] \ll C_a\). Esto se justifica cuando la mayor parte del ácido permanece en su forma protonada [HA], de manera que se produce relativamente poco H +. En este caso, Ecuación\(\ref{2-6}\) reduce a
\[ K_a \approx \dfrac{[H^+]^2}{C_a} \label{2-9}\]
o
\[[H^+] \approx \sqrt{K_aC_a} \label{2-10}\]
Calcular el pH y el porcentaje de ionización de 0.10 M de ácido acético “HaC” (CH 3 COOH),\(K_a = 1.74 \times 10^{–5}\).
Solución:
Por lo general, es mejor comenzar usando Ecuación\(\ref{2-9}\) como primera aproximación:
\[[H^+] = \sqrt{(0.10)(1.74 \times 10^{–5})} = \sqrt{1.74 \times 10^{–6}} = 1.3 \times 10^{–3}\; M\nonumber \]
Esta aproximación generalmente se considera válida si [H +] es menor al 5% de C a; en este caso, [H +]/C a = 0.013, que es menor a 0.05 y por lo tanto dentro del límite. Esta misma cantidad también corresponde a la fracción de ionización, por lo que el porcentaje de ionización es de 1.3%. El pH de la solución es
\[pH = –\log 1.2 \times 10^{-3} = 2.9\nonumber \]
Aproximación 3: Muy Débil y Ácida
Si el ácido es muy débil o su concentración es muy baja, el\(H^+\) producido por su disociación puede ser poco mayor que eso debido a la ionización del agua. Sin embargo, si la solución sigue siendo ácida, aún puede ser posible evitar resolver la ecuación cúbica\(\ref{2-5a}\) asumiendo que el término\(([H^+] - [OH^–]) \ll C_a\) en la Ecuación\(\ref{2-5}\):
\[ K_a = \dfrac{[H^+]^2}{C_a - [H^+]} \label{2-11}\]
Esto se puede reorganizar en forma cuadrática estándar
\[[H^+]^2 + K_a [H^+] – K_a C_a = 0 \label{2-12}\]
Para soluciones diluidas de ácidos débiles, se puede requerir un tratamiento exacto. Con la ayuda de una computadora o calculadora gráfica, resolver un polinomio cúbico es ahora mucho menos formidable de lo que solía ser. Sin embargo, los errores de redondeo pueden hacer que estos solucionadores cúbicos computarizados exploten; generalmente es más seguro usar una aproximación cuadrática.
El ácido bórico, B (OH) 3 (“H 3 BO 3 “) es un ácido débil que se encuentra en el océano y en algunas aguas naturales. Como ocurre con muchos compuestos de boro, existe alguna duda sobre su verdadera naturaleza, pero para la mayoría de los propósitos prácticos puede considerarse monoprótico con\(K_a = 7.3 \times 10^{–10}\):
\[Bi(OH)_3 + 2 H_2O \rightleftharpoons Bi(OH)_4^– + H_3O^+\nonumber \]
Encuentra el [H +] y el pH de una solución 0.00050 M de ácido bórico en agua pura.
Solución
Debido a que este ácido es bastante débil y su concentración baja, utilizaremos la forma cuadrática Ecuación\(\ref{2-7}\), que arroja la raíz positiva\(6.12 \times 10^{–7}\), correspondiente a pH = 6.21. ¡Observe que esto es solo seis veces la concentración de\(H^+\) presente en agua pura!
Es instructivo comparar este resultado con lo que arrojaría la aproximación cuadrática, que\([H^+] = 6.04 \times 10^{–7}\) así lo arrojaría\(pH = 6.22\).
Bases débiles
Las bases débiles que más comúnmente se encuentran son:
- aniones A — de ácidos débiles:
\[A^– + H_2O \rightleftharpoons HA + OH^–\]
\[CO_3^{2–} + H_2O \rightleftharpoons HCO_3^– + OH^–\]
- amoníaco
\[NH_3 + H_2O \rightleftharpoons NH_4^+ + OH^–\]
- aminas, por ejemplo, metilamina
\[CH_3NH_2 + H_2O \rightleftharpoons CH_3NH_3^++ H_2O\]
Solución de un anión de un ácido débil
Obsérvese que, para mantener la electroneutralidad, los aniones deben ir acompañados de cationes suficientes para equilibrar sus cargas. Así, para una solución C b M de la sal NaA en agua, tenemos las siguientes condiciones:
- Especies
Na +, A —, HA, H 2 O, H +, OH —
- Equilibrios
\[[H^+][OH^–] = K_w \label{2-13}\]
\[ K_b =\dfrac{[HA][OH^-]}{[A^-]} \label{2-14}\]
- Balance de masa
\[C_b = [Na^+] = [HA] + [A^–] \label{2-15}\]
- Saldo de carga
\[[Na^+] + [H^+] = [OH^–] + [A^–] \label{2-16}\]
Sustituyendo el término [Na +] en la Ecuación\(\ref{2-15}\) por\(C_b\) y combinando con\(K_w\) y el balance de masas, se obtiene una relación que es análoga a la de la Ecuación\(\ref{2-5}\) para ácidos débiles:
\[K_b =\dfrac{[OH^-] ([OH^-] - [H^+])}{C_b - ([OH^-] - [H^+])} \label{2-17}\]
Las aproximaciones
\[ K_b \approx \dfrac{[OH^-]^2}{C_b - [OH^-]} \label{2-18}\]
y
\[[OH^–] \approx \sqrt{K_b C_b} \label{2-19}\]
pueden derivarse de manera similar.
Calcular el pH y las concentraciones de todas las especies en una solución 0.01 M de metilamina, CH 3 NH 2 (\(K_b = 4.2 \times 10^{–4}\)).
Solución
Comenzamos usando la ecuación de aproximación más simple\(\ref{2-14}\):
\[[OH^–] = \sqrt{(K_b C_b}- = \sqrt{(4.2 \times 10^{-4})(10^{–2})} = 2.1 \times 10^{–3}\nonumber \]
Para ver si esta aproximación está justificada, aplicamos un criterio similar al que usamos para un ácido débil: [OH —] no debe superar el 5% de C b. En este caso,
\[ \dfrac{[OH^–]}{ C_b} = \dfrac{(2.1 \times 10^{-3}} { 10^{–2}} = 0.21\nonumber \]
así que debemos usar la forma cuadrática Ecuación\(\ref{2-12}\) que arroja la raíz positiva\(1.9 \times 10^{–3}\) que corresponde a\([OH^–]\)
\[[H^+] = \dfrac{K_w}{[OH^–} = \dfrac{1 \times 10^{-14}}{1.9 \times 10^{–3}} = 5.3 \times 10^{-12}\nonumber \]
y
\[pH = –\log 5.3 \times 10^{–12} = 11.3.\nonumber \]
A partir de la ecuación de saldo de carga, resuelva para
\[[CH_3NH_2] = [OH^–] – [H^+] \approx [OH^–] = 5.3 \times 10^{–12}\; M. \nonumber \]
Para la concentración de la forma ácida (ion metilaminio CH 3 NH 3 +), use la ecuación del balance de masas:
\[[CH_3NH_3^+] = C_b – [CH_3NH_2] = 0.01 – 0.0019 =0.0081\; M.\nonumber \]
Mezclas de Ácidos
Muchos problemas prácticos relacionados con la química ambiental y fisiológica implican soluciones que contienen más de un ácido. En esta sección, nos limitaremos a un caso mucho más sencillo de dos ácidos, con miras a mostrar el método general de abordar tales problemas comenzando con ecuaciones de equilibrio de carga y masa y haciendo suposiciones simplificadoras cuando se justifiquen. En general, los iones hidrógeno producidos por el ácido más fuerte tenderán a suprimir la disociación del más débil, y ambos tenderán a suprimir la disociación del agua, reduciendo así las fuentes de H + que deben tratarse.
Considerar una mezcla de dos ácidos débiles HX y HY; sus respectivas concentraciones nominales y constantes de equilibrio se denotan por C x, C y, K x y K y,
Comenzando con la expresión de saldo de carga
\[ [H^+] = [X^–] + [Y^–] + [OH^–] \label{3-1}\]
Utilizamos las constantes de equilibrio para reemplazar las concentraciones de bases conjugadas con expresiones de la forma
\[ [X^-] = K_x \dfrac{[HX]}{[H^+]} \label{3-2}\]
para rendir
\[ [H^+] = \dfrac{[HX]}{K_x} + \dfrac{[HY]}{K_y} + K_w \label{3-3}\]
Si ninguno de los ácidos es muy fuerte o muy diluido, podemos sustituir las concentraciones de equilibrio por concentraciones nominales:
\[ [H^+] \approx \sqrt{C_cK_x + C_yK_y K_w} \label{3-4}\]
Estimar el pH de una solución que sea 0.10M en ácido acético (\(K_a = 1.8 \times 10^{–5}\)) y 0.01M en ácido fórmico (\(K_a = 1.7 \times 10^{–4}\)).
Solución
Debido a que K w es insignificante en comparación con los productos C a K a, podemos simplificar\ Ecuación\(ref{3-4}\):
\[[H^+] = \sqrt{1.8 \times 10^{–6} + 1.7 \times 10^{-6}} = 0.0019\nonumber \]
Que corresponde a un pH de\(–\log 0.0019 = 2.7\)
Obsérvese que el pH de cada ácido por separado a su concentración especificada estaría alrededor de 2.8. Sin embargo, si se usa ácido cloroacético 0.001 M (K a = 0.0014) en lugar de ácido fórmico, la expresión anterior se convierte en
\[ [H^+] \approx \sqrt{ 1.4 \times 10^{-6} + 1.75 \times 10^{-14}} = 0.00188 \label{3-5}\]
que excede la concentración del ácido más fuerte; debido a que el ácido acético hace una contribución insignificante a [H +] aquí, la simple aproximación dada anteriormente\ Ecuación\(\ref{3-3}\) es claramente inválida. Ahora usamos la expresión de balance de masa para el ácido más fuerte
\[[HX] + [X^–] = C_x \label{3-6}\]
para resolver para [X —] que se combina con la constante de equilibrio K x para rendir
\[[X^-] = C_x - \dfrac{[H^+][X^]}{K_x} \label{3-7}\]
Resolver esto para [X —] da
\[ [X^-] = \dfrac{C_xK_x}{K_x + [H^+]} \label{3-8}\]
La aproximación para el ácido acético más débil (HY) sigue siendo válida, por lo que la conservamos en la expresión de electronegatividad sustituida:
\[ [H^+] \dfrac{C_xK_x}{K_x+[H^+]} + \dfrac{C_yK_y}{[H^+]} \label{3-9}\]
que es una ecuación cúbica que puede resolverse por aproximación.
Se han publicado varios métodos para calcular la concentración de iones hidrógeno en soluciones que contienen un número arbitrario de ácidos y bases. Estos generalmente implican cálculos iterativos realizados por una computadora. Véase, por ejemplo, J. Chem. Educación 67 (6) 501-503 (1990) y 67 (12) 1036-1037 (1990).
Equilibrios de ácidos polipróticos
Debido a la gran cantidad de especies involucradas, las soluciones exactas de problemas que involucran ácidos polipróticos pueden llegar a ser muy complicadas. “Así, para el ácido fosfórico H 3 PO 4, las tres etapas de “" disociación "” producen tres bases conjugadas:”
![]()
Afortunadamente, suele ser posible hacer suposiciones simplificadoras en la mayoría de las aplicaciones prácticas. En la sección que sigue, mostraremos cómo se hace esto para el caso menos complicado de un ácido diprótico. Un ácido diprótico HA puede donar sus protones en dos etapas, produciendo primero una especie monoprotonada HA —y luego la forma completamente desprotonada A 2—.
![]()
Dado que hay cinco incógnitas (las concentraciones del ácido, de las dos bases conjugadas y de H + y OH —), necesitamos cinco ecuaciones para definir las relaciones entre estas cantidades. Estos son
- Equilibrios
\[[H^+][OH^–] = K_w \label{4-1}\]
\[ K_1 = \dfrac{[H^+][HA^-]}{[H_2A]} \label{4-2}\]
\[ K_1 = \dfrac{[H^+][HA^{2-}]}{[HA^-]} \label{4-3}\]
- Balance de masa
\[C_a = [H_2A] + [HA^–] + [A^{2–}] \label{4-4}\]
- Saldo de carga
\[[H^+] = [OH^–] + [HA^–] + 2 [A^{2–}] \label{4-5}\]
(Se necesitan 2 moles de\(H^+\) para equilibrar la carga de 1 mol de\(A^{2–}\))
Resolver estas cinco ecuaciones simultáneamente\(K_1\) para producir la expresión bastante intimidante
\[ K_1 = \dfrac{[H^+] \left( [H^+] - [OH^-] \dfrac{2K_2[H^+] - [OH^-]}{[H^+ + 2K_2} \right)}{C_a - \left( [H^+] - [OH^-] \dfrac{K_2 [H^+] -[OH^-]}{[H^+] + 2K_2} \right)} \label{4-6}\]
que es de poco uso práctico salvo en la medida en que proporciona el punto de partida para diversas aproximaciones simplificadoras.
Si la solución es incluso ligeramente ácida, entonces ([H +] — [OH —]) ≈ [H +] y
\[ K_1 = \dfrac{[H^+] \left( [H^+] \dfrac{2K_2[H^+]}{[H^+ + 2K_2} \right)}{C_a - \left( [H^+] \dfrac{K_2 [H^+]}{[H^+] + 2K_2} \right)} \label{4-7}\]
Para cualquiera de los ácidos dipróticos comunes,\(K_2\) es mucho más pequeño que\(K_1\). Si la solución es suficientemente ácida que\(K_2 \ll [H^+]\), entonces se puede hacer una simplificación adicional que elimina\(K_2\) de la Ecuación\(\ref{4-7}\); este es el punto de partida para la mayoría de los cálculos prácticos.
\[ K_1 \approx \dfrac{[H^+]^2}{C_a-[H^+]} \label{4-8}\]
Finalmente, si la solución está suficientemente concentrada y\(K_1\) suficientemente pequeña para que\([H^+] \ll C_a\), entonces Ecuación se\(\ref{4-8}\) reduce a:
\[ [H^+] \approx \sqrt{K_a C_a}\]
Ácido con base conjugada: Soluciones tampón
Las soluciones que contienen un ácido débil junto con una sal del ácido se conocen colectivamente como tampones. Cuando se emplean para controlar el pH de una solución (como en un medio de crecimiento microbiano), se usa comúnmente una sal de sodio o potasio y las concentraciones suelen ser lo suficientemente altas para que la ecuación de Henderson-Hasselbalch arroje resultados adecuados.
Solución exacta
En esta sección, desarrollaremos un tratamiento analítico exacto de soluciones ácido-sal débiles, y mostraremos cómo surge la ecuación H — H como aproximación. Un sistema tampón típico se forma añadiendo una cantidad de base fuerte tal como hidróxido de sodio a una solución de un HA ácido débil. Alternativamente, el mismo sistema se puede preparar combinando cantidades apropiadas de un ácido débil y su sal NaA. Un sistema de este tipo se puede tratar de la misma manera que un ácido débil, pero ahora con el parámetro C b además de C a.
- Especies
Na +, A —, HA, H 2 O, H +, OH —
- Equilibrios
\[[H^+][OH^–] = K_w \label{5-1}\]
\[K_a = \dfrac{[H^+][A^-]}{[HA]} \label{5-2}\]
- Balance de masa
\[C_a + C-b = [HA] + [A^–] \label{5-3}\]
\[C_b = [Na^+] \label{5-4}\]
- Saldo de carga
\[[Na^+] + [H^+] = [OH^–] + [A^–] \label{5-5}\]
Sustituyendo Ecuación\(\ref{5-4}\) en Ecuación\(\ref{5-5}\) produce una expresión para [A —]:
\[[A^–] = C_b + [H^+] – [OH^–] \label{5-6}\]
Inserción de esto en Ecuación\(\ref{5-3}\) y resolución de rendimientos de [HA]
\[[HA] = C_b + [H^+] – [OH^–] \label{5-7)}\]
Finalmente, sustituimos estas dos últimas expresiones en la constante de equilibrio (Ecuación\(\ref{5-2}\)):
\[ [H^+] = K_a \dfrac{C_a - [H^+] + [OH^-]}{C_b + [H^+] - [OH^-]} \label{5-8}\]
que se convierte en cúbico en [H +] cuando [OH —] es reemplazado por (K w/[H +]).
\[[H^+]^3 +(C_b +K_a)[H^+]^2 – (K_w + C_aK_a) [H^+] – K_aK_w = 0 \label{5-8a}\]
Aproximaciones
En casi todos los casos prácticos es posible hacer suposiciones simplificadoras. Así, si se sabe que la solución es ácida o alcalina, entonces se pueden descuidar los términos [OH —] o [H +] en la Ecuación\(\ref{5-8}\). En soluciones ácidas, por ejemplo, la ecuación\(\ref{5-8}\) se convierte
\[ [H^+] = K_a \dfrac{C_a - [H^+]}{C_b + [H^+]} \label{5-9}\]
que se puede reorganizar en una cuadrática en forma polinómica estándar:
\[ [H^+]^2 + (C_b + C_a) [H^+] – K_a C_a = 0 \label{5-10}\]
Si las concentraciones C a y C b son suficientemente grandes, puede ser posible descuidar por completo los términos [H +], lo que lleva a la aproximación común de Henderson-Hasselbalch.
\[ \color{red} [H^+] \approx K_a \dfrac{C_a}{C_b} \label{5-11}\]
Es importante tener en cuenta que la Aproximación Henderson-Hasselbalch es una “aproximación de una aproximación” que generalmente es válida solo para combinaciones de K a y concentraciones que caen dentro de la porción coloreada de esta parcela.
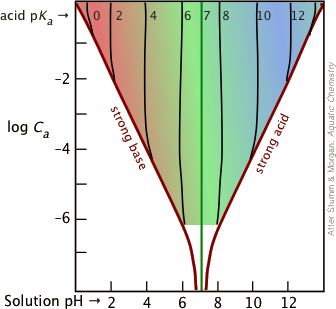
La mayoría de las soluciones tampón tienden a estar bastante concentradas, con C a y C b típicamente alrededor de 0.01 - 0.1 M. Para amortiguadores más diluidos y K a más grandes que te acerquen al límite del área coloreada, es más seguro comenzar con Equation\(\ref{5-9}\).
El ácido cloroso HClO 2 tiene un pK a de 1.94. Calcular el pH de una solución hecha añadiendo 0.01 M/L de hidróxido de sodio a una solución de -.02 M/L de ácido clórico.
Solución
En la solución resultante, C a = C b = 0.01 M. En las parcelas que se muestran arriba, la intersección de la línea log C a = —2 con la parcela para pK a = 2 cae cerca del límite izquierdo del área coloreada, por lo que usaremos la forma cuadrática\(\ref{5-10}\).
Sustitución en\(\ref{5-10}\) rendimientos de ecuaciones
\[H^+ + 0.02 H^+ – (10^{–1.9} x 10^{–2}) = 0 \nonumber\]
lo que produce una raíz positiva 0.0047 = [H +] que corresponde a pH = 2.3.
Nota: El uso de la Aproximación de Henderson-Hassalbach (Ecuación\(\ref{5-11}\)) daría pH = pK a = 1.9.


